高生物量富硒产朊假丝酵母菌株的选育
邹艳,李俊杰,夏诗棋,管斌*,孔青
(中国海洋大学食品科学与工程学院,山东青岛266003)
高生物量富硒产朊假丝酵母菌株的选育
邹艳,李俊杰,夏诗棋,管斌*,孔青
(中国海洋大学食品科学与工程学院,山东青岛266003)
从5株优良的发酵酵母菌中筛选出耐硒和富硒能力较好的产朊假丝酵母,采用耐酸驯化和梯度浓度的耐硒驯化增加菌株的抗性。研究表明,产朊假丝酵母Ⅰ的富硒能力更好。在此基础上,经复合诱变、亚硒酸钠抗性平板初筛和摇瓶复筛,筛选出生物量和含硒量都较高的菌株D-5,再将突变株D-5进行紫外诱变,筛选出1株高生物量和高含硒量的菌株U-16,其菌株生物量为5.86 g/L,总硒量为1 575.40 μg/g,有机硒量为1 500.90 μg/g,其有机硒占胞内总硒比重的95.26%。与出发菌株相比,筛选菌株的生物量提高了67.90%,有机硒量增加了95.95%。
有机硒;产朊假丝酵母;诱变;生物量
ZOU Yan,LI Junjie,XIA Shiqi,GUAN Bin*,KONG Qing
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
硒是维持生物体正常代谢所必需的微量元素[1-3]。尽管每日所需的摄入量非常少,但却在人体中发挥着至关重要的作用[4],缺硒会引起克山病[5]。而我国是一个缺硒大国[6],经过取样调查发现,国土面积的72%都属于缺硒地区,缺硒地区的人口占到我国总人口的2/3。硒源可分为两大类:有机硒和无机硒。与无机硒相比,有机硒具有毒性小[7],机体吸收率高[8],有利于在动物体内吸收利用[9]等优点。有机硒在生物体中主要以硒蛋白和硒代氨基酸的形式存在,是一些抗氧化酶如谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)[10]的组成部分,有保护细胞免受自由基破坏的作用[11-12]。酵母能将环境中的无机硒转化为有机硒[13],具有较强的富硒能力。同时,酵母含有多种氨基酸、维生素和丰富的辅酶以及生物活性物质[14]如还原型谷胱甘肽(glutathione,GSH)。因此硒酵母在医疗保健领域中受到了广泛的关注。
诱变是指利用一些化学、物理或者生物因素诱发生物体的遗传物质发生改变,并且基因的突变频率比自发突变率高[15],因此可利用微生物诱变育种筛选发生正向突变富硒能力强的菌株[16]。
本试验通过耐硒和富硒试验,从5株酵母菌中选出一株富硒能力强的酵母菌,并对此菌株进行化学-紫外复合诱变提高酵母的富硒和耐硒能力,从而获得一株高生物量的富硒酵母。
1 材料与方法
1.1 材料与试剂
产朊假丝酵母(Candida utilis)Ⅰ和Ⅱ:中国科学院微生物保藏中心,热带假丝酵母(Candida tropicalis)、鲁氏酵母(Zygosaccharomyces rouxii)、球拟酵母(Tetragenococcus halophila):保存于本研究室。
液体种子培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L,pH6.0。
斜面固体培养基、固体分离培养基:酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基,在液体种子培养基的基础上加琼脂粉2 g/L。
发酵培养基:葡萄糖30 g/L,酵母粉5 g/L,硫酸铵8 g/L,磷酸二氢钾3 g/L,硫酸镁0.25 g/L,在培养12 h时加入亚硒酸钠25 μg/mL(直径为0.2 μm的滤膜过滤除菌),pH6.0。
1.2 仪器与设备
SPS202F型电子分析天平:梅特勒-托利多承重设备有限公司;PHS-2F型数字pH计、722N型可见分光光度计:上海精科电子有限公司;G2X-9137MBE数显鼓风干燥箱:上海博讯实业有限公司医疗设备厂;HZQ-X100型振荡培养箱:东联电子技术开发有限公司;ZDX-35BI型高压蒸汽灭菌锅、BCM-1000型超净工作台:上海申安医疗器械厂。
1.3 方法
1.3.1 培养方法
菌种活化:将保存于斜面上的菌种接种到斜面固体培养基中,28℃培养36 h,置于冰箱中保藏备用。
种子培养:斜面种子经活化培养后,向种子培养基(100 mL/500 mL)中接入菌体,培养24 h,培养温度28℃,摇床转速为180 r/min。
发酵培养:在发酵培养基(50mL/250mL)中接入10%的种子液,培养温度28℃,摇床转速为180 r/min,培养48 h。1.3.2不同菌株耐硒能力比较
通过将5株酵母菌接种到初始亚硒酸钠质量浓度分别为0、5 μg/mL、10 μg/mL、15 μg/mL、20 μg/mL、25 μg/mL的种子培养基中,培养36 h,测定酵母的生物量。
1.3.3 不同菌株富硒能力比较
将5株酵母菌接种到种子培养基中培养24 h,再按接种量10%的比例接种到亚硒酸钠质量浓度为25 μg/mL的液体发酵培养基中培养48 h,然后测定酵母的有机硒含量和有机硒比重,选出一株富硒能力强的酵母,保藏备用。
1.3.4 菌种的抗性驯化
耐酸驯化:按照10%的接种量将种子液分别接种于pH值为5.5、5.0、4.5、4.0、3.5、3.0的液体发酵培养基中,于28℃、180 r/min条件下培养24 h,观察生长情况以此确定驯化起点。再按照参考文献[17]的步骤进行驯化。
耐硒驯化:选用增加梯度浓度的方法来驯化酵母菌,驯化步骤如下:斜面菌种→摇瓶培养(亚硒酸钠含量为5 μg/mL)→梯度稀释涂平板(亚硒酸钠含量为10μg/mL)→挑单菌落于斜面摇瓶培养(亚硒酸钠含量为10μg/mL)……重复上述过程,直到培养基中亚硒酸钠含量为60 μg/mL为止。从两株产朊假丝酵母中选出一株经耐酸和耐硒驯化后生物量和富硒量都较好的菌株进行后续实验。
1.3.5 化学-紫外复合诱变试验
菌悬液的制备:驯化后在斜面活化两次,接至种子培养基中培养12 h至对数期。取10 mL培养液离心,然后用0.1 mol/L的磷酸缓冲液(pH7.0)洗涤离心两次,加入20 mL缓冲液移至三角瓶中,加入灭好菌的玻璃珠,在摇床里150 r/min振荡10 min。将分散好的菌悬液在血球计数板上计数,稀释到107CFU/mL,待诱变。
化学诱变浓度的确定:在10 mL离心管中加入4 mL菌悬液,再加入硫酸二乙酯(diethyl sulfate,DES),使DES在总体系中的含量分别达到0.5%、1.0%、1.5%、2.0%进行诱变,每个浓度设置两个时间20 min和30 min,不同浓度、不同时间设置三个平行测定死亡率。
化学诱变时间的确定:确定最佳诱变浓度后,分别处理20 min、30 min、40 min、50 min、60 min、70 min、80 min、90 min、100 min,计算死亡率,制作致死率曲线,致死率在80%~90%的为最佳诱变时间[22]。
平板初筛:取在最佳诱变剂量下诱变的菌悬液,用无菌生理盐水制成不同稀释度的菌悬液,取0.1 mL直接涂布于硒含量为60 μg/mL平皿上,于28℃恒温培养2 d。以未经化学诱变的菌落作对照皿,挑取菌落较大且颜色较浅呈粉红色[23]的进行复筛。
摇瓶复筛:挑取菌落较大、颜色较浅呈粉红色的菌落,经斜面传代2次后,再接种于发酵培养基进行复筛,测定其生物量、含硒量。选取含硒量和生物量高的菌株传代5次测其遗传稳定性。
紫外诱变:将紫外灯预热20 min使光源稳定,取制备好的菌悬液5 mL置于直径为6 cm的无菌平皿内,放入无菌磁力搅拌棒,置磁力搅拌器上,15 W紫外灯下30 cm[24]处分别照射30 s、60 s、90 s、120 s、150 s、180 s、210 s。将处理的菌悬液稀释10-4倍涂布平皿,于28℃避光培养2 d后,与未经处理的菌液对比计算致死率,确定最佳诱变时间。
紫外诱变平板初筛和摇瓶复筛同化学诱变,经紫外诱变后平板初筛需要避光培养[25]。
1.3.6 测定方法
生物量检测方法:参考文献[17]的方法进行。
胞内有机硒检测方法:试样的消化、胞内总硒和胞内无机硒的测定方法参照文献[18-20]的方法进行。胞内有机硒含量的计算公式如下:
胞内有机硒含量=胞内总硒含量-胞内无机硒含量。
2 结果与分析
2.1 不同菌株的耐硒和富硒能力比较
以生物量作为菌株耐硒的指标,菌株对硒的耐受性越强,则生物量越大。在发酵培养基中分别添加梯度浓度的亚硒酸钠,在发酵结束后测得各株酵母的生物量如图1所示。
从图1可看出,球拟酵母在未添加亚硒酸钠时的生物量最大,可是当亚硒酸钠含量超过5 μg/mL时,其生物量下降趋势非常明显,而热带假丝酵母和鲁氏酵母下降趋势比较平缓。亚硒酸钠含量为10μg/mL时,产朊假丝酵母Ⅰ和Ⅱ的生物量受到很小的影响。
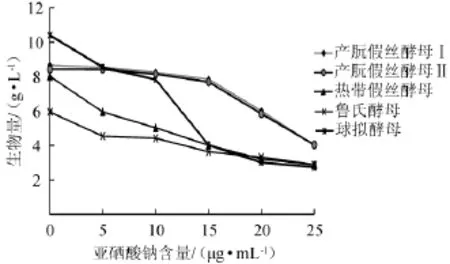
图1 不同亚硒酸钠含量对酵母生物量的影响Fig.1 Effects of different sodium selenite contents on yeast biomass
将5株酵母菌接种到亚硒酸钠含量为25 μg/mL的发酵液体培养基中,培养48 h后酵母的有机硒含量和有机硒转化率见表1。

表1 不同菌株富硒能力的比较Table 1 Comparison of different strains on selenium-enriched ability
由表1可知,产朊假丝酵母Ⅰ的有机硒含量最高,热带假丝酵母的有机硒转化率为最高,但是由于热带假丝酵母的有机硒含量太低不能作为出发菌株。产朊假丝酵母Ⅰ和Ⅱ的有机硒含量和有机硒转化率都较高,可先选出这两株菌进行后续的驯化试验。
2.2 抗性驯化后菌株的生物量和富硒量
将种子液分别接种于pH值为5.5、5.0、4.5、4.0、3.5、3.0的液体发酵培养基中,在28℃、180 r/min条件下培养36 h后,得到的生物量如图2所示。
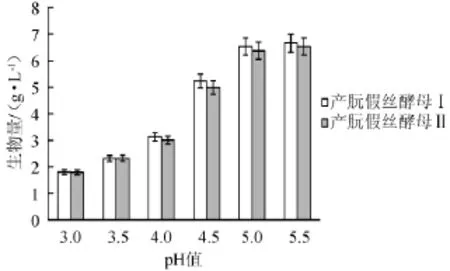
图2 不同pH值对酵母生物量的影响Fig.2 Effect of different pH on yeast biomass
从图2可看出,产朊假丝酵母Ⅰ和Ⅱ在pH值<4.5时生物量有了明显的下降,因此可确定耐酸驯化的起点为pH=4.5。
经过耐酸驯化和耐硒驯化后,两株菌在驯化前和耐酸驯化、耐硒驯化后在亚硒酸钠含量为25 μg/mL的发酵液中培养,其生物量和富硒量分别见图3和图4。
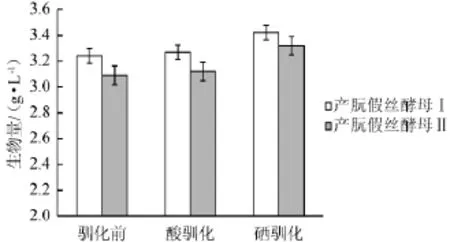
图3 驯化后菌株生物量比较Fig.3 Comparison of biomass of strains after domestication
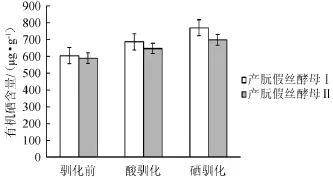
图4 驯化后菌株富硒能力比较Fig.4 Comparison of selenium-enriched ability of strains after domestication
从图3和图4可看出,与驯化前相比,在耐酸驯化后酵母菌的生物量没有明显的提高,而有机硒含量有提高,产朊假丝酵母Ⅰ提高了83.03 μg/g,产朊假丝酵母Ⅱ提高了58.81 μg/g,说明耐酸驯化对酵母富集有机硒有一定的促进作用。而经过耐硒驯化后,酵母对无机硒有了一定的耐受性,因此生物量都有增加,有机硒含量分别增加为769.88 μg/g和697.63 μg/g。其中产朊假丝酵母Ⅰ生物量和富硒量较Ⅱ来说,都较高一些,因此选用产朊假丝酵母Ⅰ做后续的诱变实验。
2.3 化学诱变筛选菌株
在诱变之前需要确定诱变剂DES的浓度和诱变的时间,出发菌株的致死率如图5和图6所示。
由图5可知,当DES含量为1.0%时,2个时间段的致死率变化不大,绘制致死曲线时效果不好;DES含量为2.0%时,2个时间段的致死率过高,突变较少。DES含量为1.5%时,2个时间段的致死率大约在50%~60%,诱变效果最好。
由图6可知,用1.5%的DES处理50 min时致死率在86.32%,处理60 min时致死率在95.31%,再增加诱变时间致死率可达100%,当致死率达到95%以上时突变率比较高,但大多数为负突变,活菌数太少导致正突变菌株太少,因此在选择诱变时间为50 min。
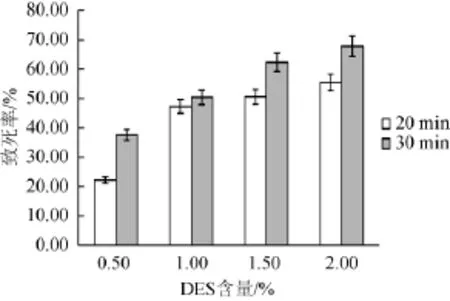
图5DES诱变剂和处理时间对菌株致死率的影响Fig.5 Effect of DES mutagenic agents and treatment time on strains mortality
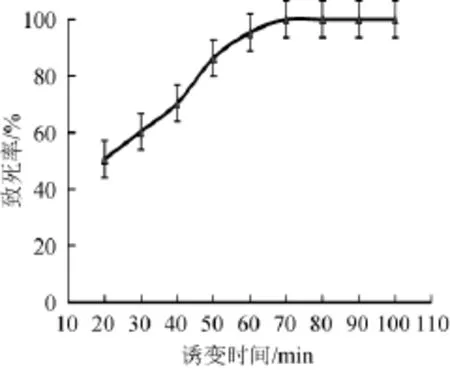
图61 .5%DES诱变不同时间的菌株致死率曲线Fig.6 Lethality curve of strains treated by 1.5%DES with different time
将在此条件下得到的诱变菌株在亚硒酸钠含量为60 μg/mL的抗性平板上进行筛选,挑选出了8株长势良好的菌株进行复筛,经过反复的初筛和复筛,最终筛选出1株富硒量和生物量都较高的菌株D-5,生物量为4.39 g/L,总硒量为1 201.92 μg/g,有机硒量为1 152.72 μg/g。生物量提高不明显,但是有机硒量比出发菌株提高了49.73%。
2.4 紫外诱变筛选菌株
菌株D-5经传代稳定培养后经过预处理后分别在紫外线下照射不同的时间,致死率曲线如图7所示。
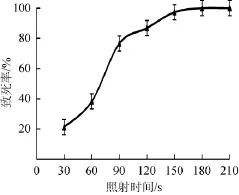
图7 紫外照射的致死率曲线Fig.7 Lethality curve of cell treated by UV
从图7可看出,随着照射时间的延长,致死率升高;当照射时间为150 s时,死亡率高达97.3%,致死率太高不利于菌株的筛选,因此选择照射时间120 s进行紫外诱变。
将紫外诱变后的菌株涂布于抗性平板上,挑选出了28株长势良好的菌株进行复筛,经过反复的初筛和复筛,最终筛选出1株富硒量和生物量都较高的菌株U-16,其生物量为5.86g/L,总硒量为1575.40μg/g,有机硒量为1 500.90 μg/g,有机硒比重为95.26%。与紫外诱变前的出发菌株D-5相比,有机硒量提高了30.2%,比出发菌株的生物量提高了67.90%,有机硒量增加了95.95%。
2.5 诱变菌株的遗传稳定性研究
将突变株U-16在斜面固体培养基上进行连续传代培养,测每一代的生物量和含硒量如表2所示。
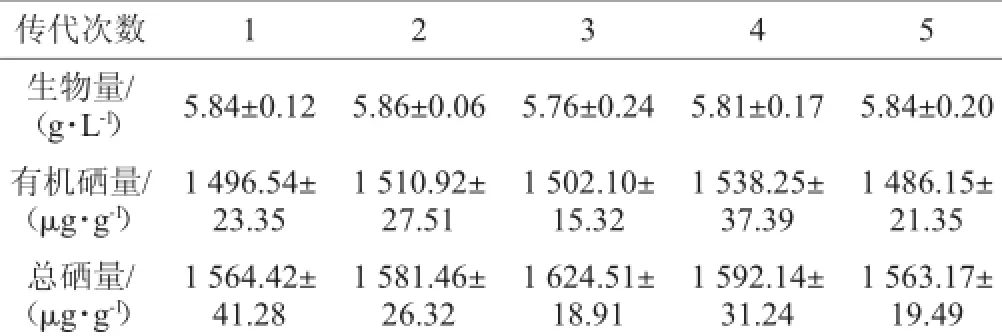
表2 菌株U-16的遗传稳定性Table 2 Genetic stability of strain U-16
由表2可知,突变株U-16的生物量、有机硒量、总硒量都没有明显的下降,说明此突变株遗传稳定。
3 结论
本研究通过比较产朊假丝酵母Ⅰ、Ⅱ和热带假丝酵母、鲁氏酵母、球拟酵母5株酵母菌的耐硒和富硒能力,筛选出了产朊假丝酵母Ⅰ和Ⅱ作为出发菌株,通过耐酸驯化和耐硒驯化提高菌株的抗性,同时发现产朊假丝酵母Ⅰ生物量和产硒量更高。
在确定好育种出发菌株后,进行化学-紫外复合诱变,得到的U-16菌株,其生物量提高到了5.86 g/L,总硒量为1 575.40 μg/g,有机硒量为1 500.90 μg/g,有机硒比重为95.26%。比出发菌株的生物量提高了67.90%,有机硒量增加了95.95%,且传代培养后菌株稳定性较好。可为富硒酵母的工业化生产提供优良菌种,后期经过发酵培养条件等生产工艺的优化,可进一步提高其生物量和富硒能力,以降低生产成本。作为一种优质有机硒源,在食品、饲料生产中将得到更广泛的应用。
[1]KIELISZEK M,BŁAZEJAK S,GIENTKA I,et al.Accumulation and metabolism of selenium by yeast cell[J].Appl Microbiol Biotechnol, 2015,99:5373-5382.
[2]DRUTEL A,ARCHAMBEAUD F,CARON P.Selenium and the thyroidgland:more good news for clinicians[J].Clin Endocrinol,2013,78(2): 155-164.
[3]KIELISZEK M,BŁAZ˙EJAK S,BZDUCHA-WRÓBEL A.Influence of selenium content in the culture medium on protein profile of yeast cells Candida utilis ATCC 9950[J].Oxidative Med Cell Longevity,2015, 659-750.
[4]屈兰竺,杨松杰,禚苏,等.微量必需元素硒的作用探析[J].中国农学学报,2010,26(7):94-97.
[5]PAPP L V,LU J,HOLMGREN A,et al.From selenium to selenoproteins: synthesis,identity,and their role in human health[J].Antioxidant Redox Signal,2007,9(7):775-806.
[6]张忠,周丽沂,张勤.硒的相态分析在环境地球化学监控网络研究中的应用[J].物探与化探,1998,22(3):170-174.
[7]SCHRAUZER G N.Nutritional selenium supplements:product types, quality,and safety[J].J Am Coll Nutr,2001,20(1):1-4.
[8]SUHAJDA A,HEGDCZKI J,JANZS B,et al.Preparation of selenium yeasts I.Preparation of selenium-enrichedSaccharomyces cerevisiae[J]. Trace Elements,2000,14(1):43-47.
[9]SCHRAUZER G N.Selenium in human and animal nutrition:resolved and unresolved issues.A partly historical treatise in commemoration of the fiftieth anniversary of the discovery of the biological essentiality of selenium,dedicated to the memory of Klaus Schwarz(1914-19)[J]. Crit Rev Biotechnol,2009,29(1):2-9.
[10]KIELISZEK M,BŁAZEJAK S.Current knowledge on the importance of selenium in food for living organisms:a review[J].Molecules,2016, 609(21):1-16.
[11]DRUTEL A,CARON P.Selenium and the thyroid gland:more good news for clinicians[J]. Clin Endocrinol,2013,78:155-164.
[12]GE X G,WANG D H,WEI G Y.Improvement of physiological characteristic of selenium-enrichedCandida utiliswith amino acids addition[J].Biotechnol Res Int,2010,10:1-7.
[13]SUHAJDA A,HEGDCZKI J,JANZS B,et al.Preparation of selenium yeasts I.Preparation of selenium-enrichedSaccharomyces cerevisiae[J]. Trace Elements,2000,14:43-47.
[14]韩瑞超,刘思喜.酵母在保健食品中的应用[J].山东食品发酵,2015(4):39-42.
[15]SEARS B B,SOKALSKI M B.TheOenothera plastomemutator:effect of UV irradiation and nitroso-methyl urea on mutation frequencies[J]. Mol Gen Genomic,1991,229(2):245-252.
[16]郭东起,廖凤菊.微波诱变结合DES诱变改良拮抗酵母菌[J].生物技术,2016(24):96-98.
[17]罗惠波,李光辉.耐酸酵母菌的筛选研究[J].四川理工学院学报,2004,17(3):151-154.
[18]曾礼华,马平美,李维.高富硒酵母菌诱变选育研究[J].食品与生物技术学报,2013,32(10):1085-1090.
[19]杨波.富硒产朊假丝酵母的制备及性能研究[D].苏州:苏州大学,2012.
[20]张帆,谢丽,邹晓阳,等.响应面法优化制备高富硒产朊假丝酵母[J].农业资源与环境学报,2014(6):575-582.
[21]葛晓光,卫功元,聂敏,等.富硒产朊假丝酵母的制备条件研究[J].粮食与饲料工业,2009(10):31-33.
[22]顾钢,朱万珥,孙林林.利用新的催化显色反应测定人发中痕量硒[J].分析化学,1988(6):84-86.
[23]张顺涛,李肖,左涛.高生物量富硒酵母菌的选育[J].中国酿造,2008,27(21):37-40.
[24]GUO J,LI J X,CHEN Y F,et al.Improving erythritol production ofAureobasidium pullulansfrom xylose by mutagenesis and medium optimization[J].Appl Biochem Biotechnol,2016,180:717-727.
[25]李忠英,肖杨娟,罗跃中,等.UV与DES复合诱变选育高产脂肪酶菌株[J].氨基酸和生物资源,2011,33(3):6-9.
Q93-331
0254-5071(2017)05-0085-05
10.11882/j.issn.0254-5071.2017.05.018
2017-01-22
“十二五”农村领域国家科技计划(2013BAD10B02-06);山东省科技计划项目(2014GSF121029)
邹艳(1992-),女,硕士研究生,研究方向为发酵工程。
*通讯作者:管斌(1957-),男,教授,博士,研究方向为发酵工程。

