11C-CFT PET/CT显像鉴别多系统萎缩与帕金森病的价值
杨 晖
沈智辉SHEN Zhihui
徐白萱XU Baixuan
11C-CFT PET/CT显像鉴别多系统萎缩与帕金森病的价值
杨 晖YANG Hui
沈智辉SHEN Zhihui
徐白萱XU Baixuan
目的探讨11C-CFT PET/CT多巴胺转运蛋白(DAT)显像在鉴别多系统萎缩(MSA)与帕金森病(PD)中的应用价值。资料与方法回顾性分析经临床确诊的21例MSA患者(MSA组)、24例PD患者(PD组)以及10例健康志愿者(正常对照组)的临床及11C-CFT PET/CT资料,采用感兴趣区(VOI)技术,计算纹状体不同区域(尾状核与壳核)DAT结合量指数与DAT结合不对称指数,分析3组纹状体DAT数量与分布对称性差异。结果与正常对照组相比,MSA组与PD组纹状体DAT结合量指数均显著减低,差异有统计学意义(P<0.05);MSA组与PD组纹状体DAT结合量指数差异均无统计学意义(P>0.05)。与正常对照组相比,PD组纹状体DAT结合不对称指数显著增加,差异有统计学意义(P<0.05),但MSA组纹状体DAT结合不对称指数与正常对照组差异无统计学意义(P>0.05);PD组的尾状核与壳核DAT结合不对称指数均高于MSA组,差异有统计学意义(P<0.05)。结论11C-CFT PET/CT 显像可显示纹状体多巴胺能神经元退变情况。MSA与PD患者均表现为纹状体DAT数量减低,PD患者纹状体DAT分布不对称程度高于MSA患者。11C-CFT PET/CT显像可用于鉴别MSA与PD。
多系统萎缩;帕金森病;正电子发射断层显像术;体层摄影术,X线计算机;多巴胺;载体蛋白质类;诊断,鉴别
帕金森综合征是严重的导致运动障碍的一类疾病,主要包括帕金森病(Parkinson's disease,PD)和多系统萎缩(multiple system atrophy,MSA),两者由于临床表现和体征具有一定的重叠,故鉴别诊断较困难(尤其在疾病早期),但两者的治疗方式、进展速度和预后有很大不同,疾病早期鉴别诊断显得尤为重要。国外临床病理研究显示,约25%的PD诊断错误[1]。MRI可以鉴别部分MSA患者,但其阳性率低,而且显示的壳核结构及信号的改变缺乏疾病特异性[2]。单光子发射型计算机断层扫描(SPECT)以及正电子发射型计算机断层扫描(PET)凭借特异性示踪剂在中枢神经系统疾病的诊断中具有重要作用。国外关于多巴胺转运蛋白(dopamine transporter,DAT)显像在鉴别PD与非PD的应用已有较多研究,但主要是基于SPECT显像技术,图像分辨率差,而且由于只能凭借SPECT图像进行人工感兴趣区(volume of interest, VOI)勾画,定量研究可靠性欠佳。正电子标记的11C-甲基-N-2β-甲基酯-3β-(4-氟苯基)托烷(11C-CFT)是一种可卡因衍生物,与突触前膜DAT具有很高的亲和力,可反映黑质纹状体通路多巴胺能神经元功能,是PD研究的特异性显像剂。该示踪剂在鉴别MSA与PD中的作用国内鲜有报道,本研究拟探讨DAT11C-CFT PET/CT显像在鉴别MSA与PD中的应用价值。
1 资料与方法
1.1 研究对象 回顾性分析2012年1月-2014年5月经解放军总医院神经内科确诊的MSA患者21例(MSA组)及PD患者24例(PD组),PD患者与MSA患者的病程及临床严重程度(Hoehn and Yahr评分)差异无统计学意义(P>0.05)。选择2010年1月-2011年1月招募的经专科体格检查未见运动功能障碍的健康志愿者10例(正常对照组)。患者组纳入标准:①临床信息完整,临床诊断结果明确;②接受过11C-CFT PET/CT检查;③PET/CT显像后具有可靠的至少1年的随访记录。PD诊断参照英国伦敦帕金森协会脑库诊断标准[3];MSA诊断参照2007年关于MSA诊断标准的声明[4]。本研究纳入对象均签署知情同意书,所有研究对象的一般资料见表1。
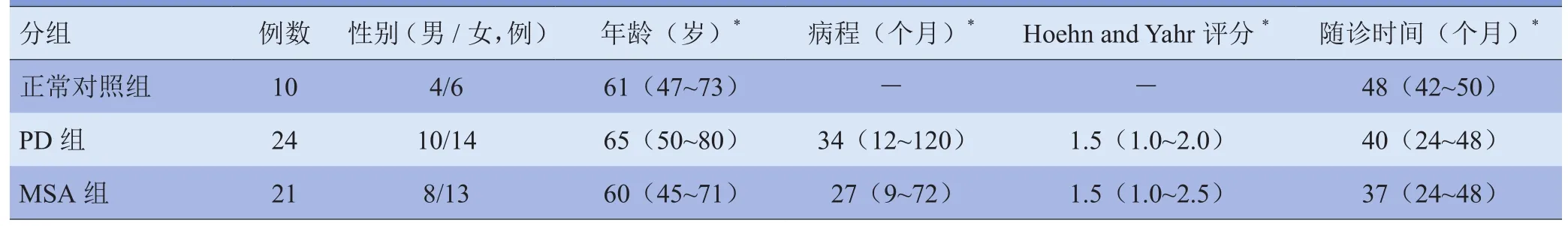
表1 研究对象基本资料
1.2 仪器与方法 采用Siemens Biograph 64 TruePoint PET/CT或GE Discovery 710显像设备,检查前患者安静休息约30 min,经肘静脉注射示踪剂11C-CFT 180~250 MBq(解放军总医院PET中心合成,放化纯度>90%),继续安静休息40~50 min后进行脑显像,头部采集1个床位,采集时间4 min。采用迭代重建算法,层厚为5 mm,图像经CT衰减矫正后获得横断面、矢状面、冠状面的PET/CT图像,并将其位置对齐至标准解剖位置。
1.3 图像分析 采用VOI方法,选取CT图像上显示纹状体最为清晰的3帧连续图像,在CT图像上逐层手动勾画以下VOI:双侧尾状核、双侧壳核、双侧小脑皮层(cerebellum,CB),计算机自动给出各区的平均标准化摄取值(SUVmean)。①计算各区DAT结合量指数:(VOI-CB)/CB,然后左右侧取均值来反映上述区域DAT的数量;②计算每个患者尾状核与壳核左右侧不对称指数:左右侧SUVmean的差值除以左右侧SUVmean的均值。为保证VOI的大小与位置在每一位患者及健康志愿者间的一致性,所有VOI均由1名核医学专业主治医师独立勾画,见图1。

图1 左右侧尾状核与壳核VOI勾画方法。PET 脑部最大密度投影图(A);PET基底节区横断面(B);CT基底节区横断面(C);PET与CT融合横断面(D)
1.4 统计学方法 采用SPSS 19.0软件,纹状体DAT结合量指数与不对称指数在MSA组、PD组、正常对照组间的比较采用方差分析,两两比较采用SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 纹状体DAT结合量指数 与正常对照组相比,MSA组与PD组纹状体DAT结合量指数均有不同程度减低,差异有统计学意义(P<0.05),MSA组与PD组纹状体DAT结合量指数差异无统计学意义(P>0.05)。见表2。
2.2 纹状体DAT结合不对称指数 相比于正常对照组,PD组纹状体DAT结合不对称指数均增加(P<0.05),MSA组纹状体DAT结合不对称指数与正常对照组差异无统计学意义(P>0.05)。PD组尾状核与壳核DAT结合不对称指数均高于MSA组(P<0.05)。见表2。
表2 MSA组、PD组与正常对照组纹状体核团显像结果比较(±s)
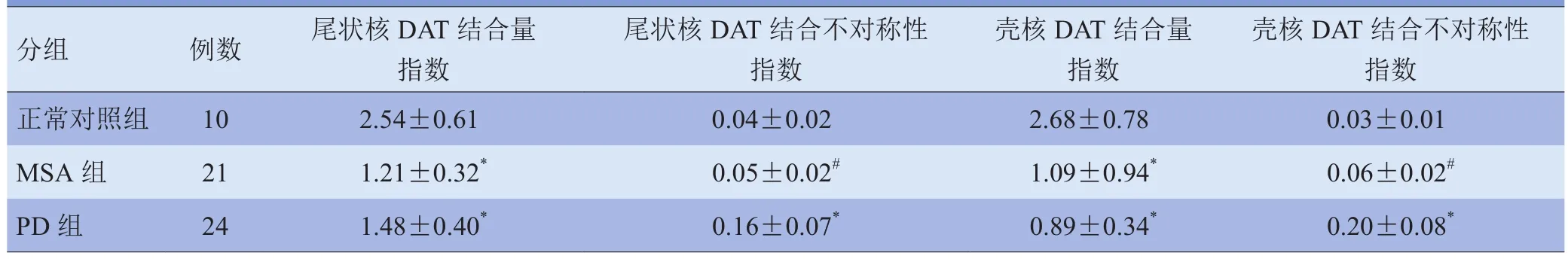
表2 MSA组、PD组与正常对照组纹状体核团显像结果比较(±s)
注:与正常对照组相比,*P<0.05;与PD组相比,#P<0.05
分组例数尾状核DAT结合量指数尾状核DAT结合不对称性指数壳核DAT结合量指数壳核DAT结合不对称性指数正常对照组10 2.54±0.61 0.04±0.02 2.68±0.78 0.03±0.01 MSA组211.21±0.32*0.05±0.02#1.09±0.94*0.06±0.02#PD组241.48±0.40*0.16±0.07*0.89±0.34*0.20±0.08*
2.3 DAT显像正常患者 PD组中1例患者(图2)尾状核与壳核DAT结合量指数与不对称指数均在正常范围内(正常范围定义为正常对照组均值±2倍标准差),该患者为56岁男性,病程6个月,临床表现为轻度左上肢体肌张力增高,伴静止性震颤,其尾状核与壳核DAT结合量指数分别为2.33、1.32,DAT结合不对称指数分别为0.07、0.05。该患者神经内科门诊随诊观察时间18个月,目前美多芭维持治疗,症状控制良好,专科检查未见认知功能及自主神经功能障碍。MSA组中3例患者尾状核与壳核放射性结合指数与不对称指数均在正常范围内,病程分别为24、9、72个月,随诊时间24、13、16个月,开始均表现为自主神经及泌尿系统功能障碍,合并小脑共济失调。随诊过程中,3例患者均出现轻至中度肌无力,同时合并肌张力增高。DAT显像正常的1例MSA患者的PET/CT表现见图3。显像正常的1例PD患者与3例MSA患者详细情况见表3。
3 讨论
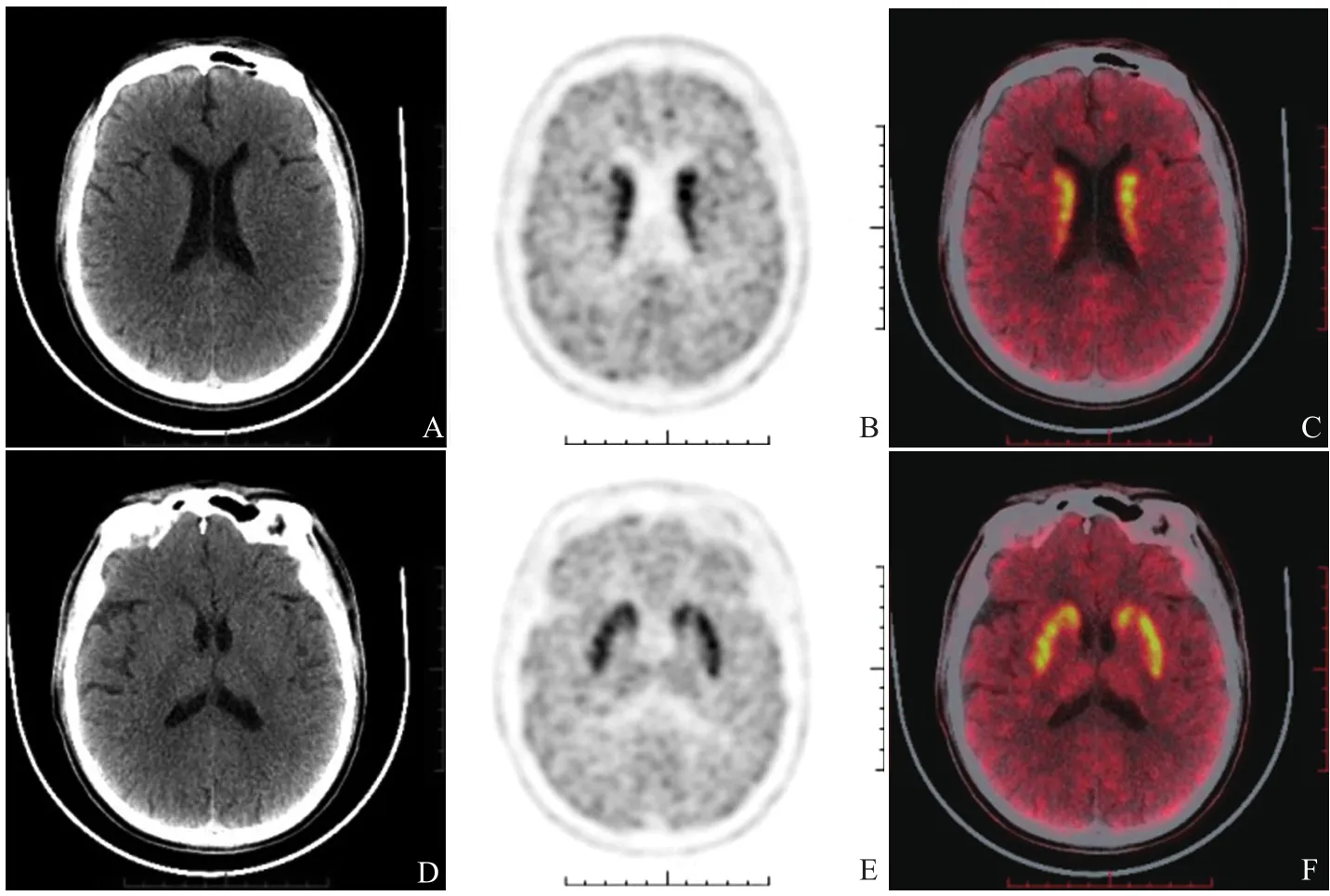
图2 DAT显像正常的1例 PD患者。男,56岁,PD患者,病程6个月。双侧尾状核DAT结合正常,依次为CT横断面、PET横断面、CT与PET融合图横断面(A、B、C);壳核DAT结合正常,依次为CT横断面、PET横断面、CT与PET融合图横断面(D、E、F)
既往研究显示,用DAT显像测量结合量指数反映纹状体内DAT数量和分布是可行的[5-6]。Van Dyck等[7]研究了126例18~88岁的健康志愿者的DAT显像结果,发现健康人群的纹状体核团DAT结合量随着年龄增大而逐渐减低(每10年平均减低约6.6%),而且左右侧尾状核与壳核DAT结合也呈轻度的不对称性。既往研究显示,PD患者DAT摄取量随着病程及临床症状严重程度的进展而逐渐减低[8-9]。因此在进行DAT定量研究时,必须将年龄、病程及临床症状严重程度考虑在内。本研究3组对象的平均年龄、病程和临床症状严重程度差异无统计学意义(P>0.05),故而结果可靠。本研究显示,PD与MSA均表现为纹状体DAT结合减低[10-11],与Brucke等[11]的研究结果一致,本研究发现单纯依据DAT减低程度并不能区别这两类疾病。本研究还发现,MSA患者尾状核与壳核DAT结合不对称程度与健康成人相似,但明显小于PD患者,此点具有鉴别诊断价值。根据既往研究,PD患者多表现为纹状体DAT不对称减低,且左右侧明显不对称,患肢对侧纹状体DAT减低程度更严重[8,11-13]。在PD的临床诊断标准中,起病时症状的不对称性十分重要,大多数早期PD患者表现为单侧发病,随着病程进展而逐渐扩展至另一侧。MSA的临床诊断标准中不包括单侧发病,且关于MSA的病理研究提示纹状体为弥漫少突胶质细胞包涵体分布表现[14]。因此,在临床DAT显像中,左右侧纹状体结合不对称性对于MSA与PD具有鉴别诊断价值。

图3 DAT显像正常的1例MSA患者。男,53岁,MSA患者,病程72个月。双侧尾状核DAT结合正常,依次为CT横断面、PET横断面、CT与PET融合图横断面(A、B、C);壳核DAT结合正常,依次为CT横断面、PET横断面、CT与PET融合图横断面(D、E、F)

表3 4例显像正常患者的基本资料
本研究24例PD患者中,1例DAT显像结果正常,其纹状体DAT结合指数与不对称指数均在正常范围内。既往研究也发现了少量(约10%)临床确诊的PD患者其DAT显像结果正常[15-16],可能的原因为:①该患者接受PET/CT检查时病程较短,症状较轻。根据既往研究,DAT结合量与病程及运动障碍严重程度成反比,这可能是导致该患者显像结果看似“正常”的原因。②多巴胺显像正常个体(subjects with scans without evidence of dopamine de fi ciency,SWEDDs)[17]。越来越多的临床随诊证据发现,在相同的临床症状评分标准下,这些DAT显像正常(或者轻微异常)的“患者”在临床随诊过程中病情稳定,而且多巴胺替代治疗效果差,他们可能并不是PD[16]。本例患者由神经内科门诊随诊观察18个月,目前美多芭维持治疗,症状控制良好,推测DAT显像结果正常更有可能是患者病程短、症状轻的原因,提示临床工作中对于早期PD,要防范11C-CFT PET/CT漏诊的可能,这时结合病史十分重要。Antonini等[18]关于突触后膜D2类受体显像研究提示其对于早期PD与MSA有鉴别诊断价值,但同样也存在一定的误诊率,原因是影响D2类受体显像结果的因素太多且无法控制,相关问题有待进一步研究。
本研究21例MSA患者中,3例DAT显像结果正常,病程分别为24、9、72个月,这3例患者在PET/CT显像时以及随访过程中均符合“很可能MSA”的诊断标准,而且病情均不同程度进展。MSA是一种散发并且进展迅速的神经系统退行性疾病,可表现为帕金森样症状、共济失调、自主神经系统功能障碍等不同形式。该病的病理基础是黑质纹状体以及橄榄核中脑小脑结构退变,常伴随广泛分布的神经胶质细胞包涵体形成。按临床表现,常分为P型(以帕金森症状为主)和C型(以小脑症状为主)[4]。Mckinley等[19]报道了1例病程10年且经病理确诊的MSA患者,但是患者DAT显像结果正常。该患者临床分型为C型,病理染色提示黑质大部分神经元依然保留。Jellinger等[20]关于MSA的临床病理研究发现,P型患者黑质病理学改变与临床帕金森症状严重程度(Hohen and Yahr评分)有相关性,但C型患者则无这种相关性,提示不同的临床分型对应的神经损害发生的部位不同。对比本研究中此3例MSA患者,其临床表现以小脑症状为主,故而推测其DAT显像结果正常可能与临床分型有关。
本研究的局限性:①本研究患者为神经内科门诊随访至少1年的样本,不能完全排除临床误诊的可能。②本研究PD组、MSA组均为早期患者,而且未涉及其他类型不典型帕金森综合征,故而对于临床不确定的帕金森综合征的鉴别诊断帮助有限。
总之,11C-CFT PET/CT显像可显示PD与MSA患者纹状体多巴胺能神经元退变情况,两者均表现为双侧尾状核、壳核放射性摄取减低,但左右侧核团受累的程度不同,具有一定的鉴别诊断价值。
[1] Tolosa E, Wenning G, Poewe W. The diagnosis of Parkinson's disease. Lancet Neurol, 2006, 5(1):75-86.
[2] Ghaemi M, Hilker R, Rudolf J, et al. Differentiating multiple system atrophy from Parkinson's disease: contribution of striatal and midbrain MRI volumetry and multi-tracer PET imaging. J Neurol Neurosurg Psychiatry, 2002, 73(5): 517-523.
[3] Gelb DJ, Oliver E, Gilman S. Diagnostic criteria for Parkinson disease. Arch Neurol, 1999, 56(1): 33-39.
[4] Gilman S, Wenning GK, Low PA, et al. Second consensus statement on the diagnosis of multiple system atrophy. Neurology, 2008, 71(9): 670-676.
[5] Laruelle M, Wallace E, Seibyl JP, et al. Graphical, kinetic, and equilibrium analyses of in vivo123I beta-CIT binding to dopamine transporters in healthy human subjects. J Cereb Blood Flow Metab, 1994, 14(6): 982-994.
[6] 何婷婷, 王瑞民, 陈英茂, 等. 多巴胺转运蛋白PET成像诊断帕金森病. 中国医学影像学杂志, 2008, 16(2): 94-97.
[7] Van Dyck CH, Seibyl JP, Malison RT, et al. Age-related decline in dopamine transporters: analysis of striatal subregions, nonlinear effects, and hemispheric asymmetries. Am J Geriatr Psychiatry, 2002, 10(1): 36-43.
[8] Benamer HT, Patterson J, Wyper DJ, et al. Correlation of Parkinson's disease severity and duration with123I-FP-CIT SPECT striatal uptake. Mov Disord, 2000, 15(4): 692-698.
[9] Cilia R, Rossi C, Frosini D, et al. Dopamine transporter SPECT imaging in corticobasal syndrome. PLoS One, 2011, 6(5): 10.
[10] Varrone A, Marek KL, Jennings D, et al.123I beta-CIT SPECT imaging demonstrates reduced density of striatal dopamine transporters in Parkinson's disease and multiple system atrophy. Mov Disord, 2001, 16(6): 1023-1032.
[11] Brucke T, Asenbaum S, Pirker W, et al. Measurement of the dopaminergic degeneration in Parkinson's disease with123I beta-CIT and SPECT. correlation with clinical findings and comparison with multiple system atrophy and progressive supranuclear palsy. J Neural Transm Suppl, 1997, 50: 9-24.
[12] Benítez-Rivero S, Marín-Oyaga VA, García-Solís D, et al. Clinical features and123I-FP-CIT SPECT imaging in vascular parkinsonism and Parkinson's disease. J Neurol Neurosurg Psychiatry, 2013, 84(2): 122-129.
[13] 焦方阳, 武猛, 王坚, 等. 帕金森病不同亚型患者的多巴胺转运体正电子发射断层显像研究. 中国临床神经科学, 2015, 23(3): 262-267.
[14] Jellinger KA, Wenning GK. Multiple system atrophy: pathogenic mechanisms and biomarkers. J Neural Transm, 2016, 123(6): 555-572.
[15] Marshall VL, Reininger CB, Marquardt M, et al. Parkinson's disease is overdiagnosed clinically at baseline in diagnostically uncertain cases: a 3-year European multicenter study with repeat123I FP-CIT SPECT. Mov Disord, 2009, 24(4): 500-508.
[16] Tatsch K, Poepperl G. Nigrostriatal dopamine terminal imaging with dopamine transporter SPECT: an update. J Nucl Med, 2013, 54(8): 1331-1338.
[17] Parkinson Study Group. Dopamine transporter brain imaging to assess the effects of pramipexole vs levodopa on Parkinson disease progression. JAMA, 2002, 287(13): 1653-1661.
[18] Antonini A, Schwarz J, Oertel WH, et al. Long-term changes of striatal dopamine D2 receptors in patients with Parkinson's disease: a study with positron emission tomography and11C raclopride. Mov Disord, 1997, 12(1): 33-38.
[19] Mckinley J, O'connell M, Farrell M, et al. Normal dopamine transporter imaging does not exclude multiple system atrophy. Parkinsonism Relat Disord, 2014, 20(8): 933-934.
[20] Jellinger KA, Seppi K, Wenning GK. Grading of neuropathology in multiple system atrophy: proposal for a novel scale. Mov Disord, 2005, 20 (Suppl 12): S29-S36.
(本文编辑 饶亚岚)
Differentiation of Multiple System Atrophy and Parkinson's Disease Using11C-CFT PET/CT
PurposeTo investigate the value of11C-CFT PET/CT dopamine transporter (DAT) imaging in differential diagnosis of multiple system atrophy (MSA) and Parkinson's disease (PD).Materials and MethodsThe11C-CFT PET/CT images of clinically con fi rmed MSA patients (21 cases), PD patients (24 cases) and healthy adults (10 cases as normal control) were analyzed retrospectively. The volume of interest (VOI) were drawn manually, and the DAT binding indexes and asymmetry indexes of different regions of striatum, including caudate and putamen, were calculated. The differences of DAT binding indexes and asymmetry indexes among the above three groups were analyzed.ResultsCompared with the normal control group, the striatal DAT binding indexes of MSA group or PD group were signi fi cantly reduced (P<0.05). There were no signi fi cant differences in DAT binding indexes between the MSA group and the PD group (P>0.05). Compared with the normal control group, the DAT binding asymmetry indexes were signi fi cantly increased in the PD group (P<0.05), but the indexes showed no signi fi cant differences in MSA group (P>0.05). The DAT asymmetry indexes of caudate and putamen in the PD group were higher than those in the MSA group (P<0.05).Conclusion11C-CFT PET/CT imaging can detect the degeneration of dopaminergic neurons in striatum. The number of striatal dopamine transporters declines in both MSA and PD patients, but the asymmetry of striatal dapamine transporter in PD patients is higher than that in MSA patients.11C-CFT PET/CT can differentiate MSA and PD.
Multiple system atrophy; Parkinson's disease; Positron-emission tomography; Tomography, X-ray computed; Dopamine; Carrier proteins; Diagnosis, differential
解放军总医院核医学科 北京 100853
徐白萱
Department of Nuclear Medicine, PLA General Hospital, Beijing 100853, China
Address Correspondence to:XU Baixuan
E-mail: xbx301@163.com
三亚市专项科研试制项目(2015KS12)。
R445.3;R742.5
2016-12-02
修回日期:2017-01-19
中国医学影像学杂志
2017年 第25卷 第5期:349-353
Chinese Journal of Medical Imaging
2017 Volume 25 (5): 349-353
10.3969/j.issn.1005-5185.2017.05.007
——初级保健中慢性病患者的治疗依从性及相关因素的横断面研究

