超声造影联合穿刺活检在肺周围型病变定性诊断中的应用
李 琪,聂 芳,杨 丹,汪延芳,李 静
(兰州大学第二医院超声科,甘肃 兰州 730030)
超声造影联合穿刺活检在肺周围型病变定性诊断中的应用
李 琪,聂 芳,杨 丹,汪延芳,李 静
(兰州大学第二医院超声科,甘肃 兰州 730030)
目的 探讨CEUS联合穿刺活检在肺周围型病变定性诊断中的应用价值。方法 对158例肺周围型病变患者行经皮穿刺活检术,其中97例术前行CEUS检查(试验组),61例术前仅行常规超声检查(对照组)。比较两组穿刺次数、诊断阳性率及并发症情况。绘制CEUS时间-强度曲线(TIC),比较试验组中良性与恶性病变TIC的上升时间(RT)、达峰时间(TTP)、曲线上升斜率(WIS)及峰值强度(PI)。观察并记录良恶性病变的增强特征。结果 试验组和对照组穿刺病理诊断阳性率分别为94.85%(92/97)和83.61%(51/61),差异有统计学意义(P=0.02);平均穿刺次数分别为 (2.11±0.48)次和(2.20±0.44)次,两组间差异无统计学意义(P=0.18);并发症发生率分别为2.06%(2/97)和4.92%(3/61),差异无统计学意义(P=0.32)。RT、WIS及PI在良恶性病变间差异有统计学意义(P均<0.05),TTP差异无统计学意义(P=0.08)。试验组良恶性病变均以不均匀增强为主,良性病变中占77.50%(31/40),恶性病变中占88.46%(46/52),其增强特征差异无统计学意义(P=0.16)。结论 CEUS在肺周围型病变的定性诊断中具有一定价值,对经皮肺穿刺活检具有指导意义。
超声检查;时间强度曲线;活组织检查;肺周围型病变
近年来肺癌发病率持续上升,目前已成为危害人类生命健康的主要元凶之一[1-2]。CEUS能够显示病灶微血管灌注,可有效识别病灶活性区域[3-4],已应用于多种占位性病变(尤其是肝占位)的诊断,但在肺周围型病灶中应用仍较少。本研究旨在探讨联合CEUS的经皮穿刺活检在肺周围型病灶定性诊断中的应用价值。
1 资料与方法
1.1 一般资料 选取2014年11月—2016年3月我院收治的经CT诊断为肺周围型病变的患者158例,男109例,女49例,年龄16~88岁,平均(60.7±13.1)岁。97例(试验组)于穿刺活检前接受常规超声及CEUS检查,其中男65例,女32例,年龄16~78岁,平均(60.0±12.5)岁;61例(对照组)于穿刺活检前仅接受常规超声检查,其中男44例,女17例,年龄20~88岁,平均(61.7±14.2)岁。CEUS检查前及超声引导下经皮肺穿刺活检前所有患者均签署知情同意书。
1.2 仪器与方法
1.2.1 超声检查 采用Philips iU22彩色多普勒诊断仪,C5-1探头,频率1~5 MHz。行常规超声检查,观察并记录病灶的位置、大小、内部回声。对试验组在选择合适的声窗后,调至造影模式,造影剂为声诺维(SonoVue),配制成微泡悬浮液,经肘浅静脉注入2 ml后,随即跟注5 ml生理盐水,连续观察病灶3~5 min,采集动态图像资料,绘制时间-强度曲线(time intensity curve, TIC),获取并分析病灶上升时间(rise time, RT)、达峰时间(time to peak, TTP)、曲线上升斜率(wash-in slope, WIS)及峰值强度(peak intensity, PI)。
1.2.2 穿刺活检 采用BARD自动活检枪(美国BARD公司)及18G穿刺活检针,活检枪射程15~22 mm。对试验组根据造影情况选取病灶中增强明显的区域进行穿刺。而对照组仅依据常规超声检查情况,选取最佳进针路径穿刺。穿刺所得标本均经5%福尔马林固定后,送病理学检查。穿刺结束后,对患者持续监测30 min,患者无明显不适且嘱相关注意事项后,送返病房。观察并记录术后并发症情况。
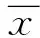
2 结果
试验组和对照组年龄、性别差异均无统计学意义(t=-0.93,P=0.35;χ2=0.46,P=0.50)。
2.1 诊断结果 试验组97例患者,平均穿刺(2.11±0.48)次。穿刺病理诊断为良性病变40例(图1),恶性病变52例(图2),余5例未能定性,见表1。对照组61例患者,平均穿刺(2.20±0.44)次。穿刺病理诊断为良性病变29例,恶性病变22例,余10例未能定性,见表1。试验组诊断阳性率为94.85%(92/97),明显高于对照组(51/61,83.61%),差异有统计学意义(χ2=5.51,P=0.02)。两组间穿刺次数差异无统计学意义(t=-1.35,P=0.18)。

表1 两组肺周围型病变穿刺病理最终诊断(例)

表2 两组肺周围型病变常规超声表现(例)
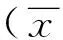
表3 试验组穿刺活检良性及恶性肺周围型病变TIC参数比较±s)
2.2 并发症 试验组1例、对照组3例术后即刻出现咯血,试验组1例术后1天出现气胸,均未经特殊治疗自行好转。试验组、对照组并发症发生率分别为2.06%(2/97)、4.92%(3/61),两组间并发症发生率差异无统计学意义(χ2=0.99,P=0.32)。
2.3 常规超声表现 158例患者均为单侧单发病变,两组病变部位、大小及回声差异均无统计学意义(P均>0.05),见表2。158例患者常规超声以低回声为主(111/158,70.25%),其次表现为极低回声(37/158,23.42%),混合回声少见(10/158,6.33%)。与病理结果对照,69例良性病变中,低回声43例(43/69,62.32%)、极低回声20例(20/69,28.99%)、混合回声6例(6/69,8.70%);74例恶性病变中,低回声57例(57/74,77.03%)、极低回声13例(13/74,17.57%)、混合回声4例(4/74,5.40%)。病灶回声在良恶性肺周围型病变间差异无统计学意义(χ2=2.53,P=0.28)。
2.4 CEUS表现 试验组97例中92例明确诊断;40例良性变中,9例表现为均匀增强,31例表现为不均匀
增强(31/40,77.50%);52例恶性病变中,6例表现为均匀增强,46例表现为不均匀增强(46/52,88.46%)。良恶性病变间CEUS增强模式差异无统计学意义 (χ2=1.99,P=0.16)。TIC分析显示,良恶性病变间RT、WIS及PI差异有统计学意义(P均<0.05),而TTP差异无统计学意义(P=0.08),见表3。
3 讨论
超声引导下肺周围型病变的穿刺活检技术已得到临床广泛认可,但穿刺活检的成功率取决于对病灶内活性组织的准确识别。CEUS可显示病灶内微血管灌注,反映病灶内的血供情况,不仅有助于鉴别病灶的良恶性,穿刺前进行CEUS检查还可提高穿刺活检的成功率。

图1 患者男,67岁,肺结核 A.CEUS示病灶呈均匀增强; B.常规超声示右肺上叶实性低回声占位; C.TIC图像; D.病理图(HE,×100) 图2 患者男,75岁,鳞状细胞癌 A.CEUS示病灶内大部区域坏死(箭); B.常规超声示右肺下叶不均匀实性低回声占位,局部可见极低回声(*); C.TIC图像; D.病理图(HE,×200)
正常肺组织由于充满气体,其声像图表现为强回声,当局部肺组织发生病变时,与周围组织声阻抗差别增大,超声表现为低回声或极低回声;如病灶内残有一定气体,则表现为混合回声[5]。本研究结果显示病灶回声在良恶性肺周围型病变间差异无统计学意义 (χ2=2.53,P=0.28),与陈霰等[6]的研究结果相似。
肺脏具有支气管动脉和肺动脉两套供血系统,由于血流动力学因素,当行CEUS检查时,肺动脉供血区域增强略早于支气管动脉供血区域。研究[7-9]表明,肺恶性病灶绝大多数由支气管动脉及其分支供血,而肺的良性病变(如炎症、结核等)主要为肺动脉供血。本研究TIC分析结果表明,恶性肺周围型病变RT小于良性病变,而WIS和PI均大于良性病变(P均<0.05)。分析原因可能为肺恶性病灶的增强一般始于支气管动脉期,肺炎性病变的增强则始于肺动脉期。虽然肺恶性病变的始增时间晚于良性病变,但由于恶性病变存在动—静脉瘘,同时伴有新生血管走行纡曲、排列紊乱,导致造影剂进入病灶后迅速弥散、达峰,因此与良性病变相比,TIC上升支较陡且曲线峰值高,即RT小,WIS和PI大,这与既往研究[10]报道一致。此外,试验组良恶性病变均以不均匀增强为主,良性病变中占77.50%(31/40),恶性病变中占88.46%(46/52),两者间差异无统计学意义(χ2=1.99,P=0.16)。其原因考虑与病灶内微血管分布情况有关。恶性病变内新生血管滋生,微血管密度和分布也随之增加,当营养供给无法满足时,其内可出现坏死,在CEUS增强模式上表现为不均匀增强。炎性病变由于血流动力学改变,血管通透性增加,可伴有组织坏死而同样表现为不均匀增强。
有研究[11]报道,穿刺活检取材不足以诊断的发生率达5~15%。且随着病灶的增大,其内出现坏死的可能性也随之增加。因此,如何对病灶内具有生物活性的组织进行有效显影并加以引导,成为提高诊断准确率的关键[12]。本研究探讨CEUS联合经皮穿刺活检在肺周围型病灶定性诊断中的应用价值,发现试验组(CEUS指导下肺穿刺活检)与对照组(二维超声指导下肺穿刺活检)比较,试验组诊断阳性率(92/97,94.85%)明显高于对照组(51/61,83.61%),两组间差异有统计学意义(P<0.05),表明通过CEUS可明确病灶内部供血情况,指导穿刺部位、路径[13],从而有效避免取材位置的偏差,提高诊断准确率。常规超声无法显示病灶内微循环灌注情况,不利于对病灶内坏死范围进行准确判别。穿刺活检的诊断准确率还与病灶大小及其内坏死范围有关,本研究中试验组5例穿刺活检未能定性,而对照组10例未能定性。
综上所述,CEUS指导下进行穿刺活检能够较好地区分病灶的活性部位和坏死区域,从而提高穿刺阳性率。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA Cancer J Clin, 2015,65(2):87-108.
[2] 陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡.中国肿瘤,2014,23(1):1-10.
[3] 王淞,杨薇,张晖,等.超声造影在肺周围占位穿刺活检的应用价值.介入放射学杂志,2014,23(6):482-486.
[4] 魏炜,艾红,阮骊韬.超声引导下经皮肺穿刺活检术诊断边缘性肺病变.中国介入影像与治疗学,2011,8(2):129-131.
[5] 耿祥亮,聂芳,贾英英,等.超声造影在肺周围型局灶病变中的应用价值.中国超声医学杂志,2015,31(8):687-689.
[6] 陈霰,徐丽伟,邢恩芳,等.超声造影及介入在周围型肺部病变诊断中的价值.中国超声医学杂志,2015,31(12):1080-1082.
[7] Görg C. Transcutaneous contrast-enhanced sonography of pleural-based pulmonary lesions. Eur J Radiol, 2007,64(2):213-221.
[8] Caremani M, Benci A, Lapini L, et al. Contrast enhanced ultrasonography (CEUS) in peripheral lung lesions: A study of 60 cases. J Ultrasound, 2008,11(3):89-96.
[9] Sartori S, Postorivo S, Vece FD, et al. Contrast-enhanced ultrasonography in peripheral lung consolidations: What’s its actual role? World J Radiol, 2013,5(10):372-380.
[10] 吴霞玲,孟娜,黄星月,等.超声造影时间-强度曲线在肺周围型病变及胸膜肿瘤诊断中的应用价值.武汉大学学报(医学版),2015,36(3):416-420,431.
[11] 曹成,刘利平,张炎晶,等.超声造影评价兔肝VX2移植瘤血流灌注及其血管生成的相关性.中国医学影像技术,2013,29(2):177-180.
[12] 黄伟俊,邱懿德,黄婷,等.超声造影在经皮肺穿刺活检肺周围型病变中的临床研究.中华肺部疾病杂志(电子版),2014,7(1):37-40.
[13] 朱贤胜,王莎莎,程琦,等.超声造影在肺周围病变穿刺活检中的应用.中国介入影像与治疗学,2011,8(6):489-491.
Application of contrast enhanced ultrasound combined biopsy in qualitative diagnosis of peripheral pulmonary lesions
LIQi,NIEFang,YANGDan,WANGYanfang,LIJing
(DepartmentofUltrasound,LanzhouUniversitySecondHospital,Lanzhou730030,China)
Objective To investigate the application value of CEUS combined with biopsy in qualitative diagnosis of peripheral pulmonary lesions. Methods A total of 158 patients with peripheral pulmonary lesions underwent percutaneous puncture biopsy. Among them, 97 cases underwent CEUS before biopsy (experiment group), and 61 cases underwent conventional ultrasound (control group). Puncture times, positive rate of samples pathological diagnosis and occurrence rate of complications were compared between the two groups. The time intensity curve (TIC) was used to obtain the rise time (RT), time to peak (TTP), wash-in slope (WIS) and peak intensity (PI). The parameters of TIC between the two groups were compared. The enhanced morphology of lesions was also observed and recorded. Results The positive rate of samples pathological diagnosis was 94.85% (92/97) in experiment group and 83.61% (51/61) in control group. The difference of the positive rate was significant between the two groups (P=0.02). In experiment and control group, the average puncture times were 2.11±0.48 and 2.20±0.44; While the occurrence rate of complications were 2.06% (2/97) and 4.91% (3/61). No significant difference was found of the average puncture times and the occurrence rate of complications between the two groups (bothP>0.05). While the statistical differences of RT, PI and WIS were found between benign and malignant lesions (allP<0.05) in experiment group. And no statistical difference of TTP was found (P=0.08). Totally 77.50% (31/40) of the benign lesions showed inhomogeneous enhancement, while the proportion was 88.46% (46/52) in malignant lesions. There was no statistical difference of enhanced morphology between benign and malignant lesions (P=0.16). Conclusion CEUS is helpful in distinguishing benign and malignant peripheral pulmonary lesions. And it has great value in guiding percutaneous biopsy in peripheral pulmonary lesions.
Ultrasonography; Time intensity curve; Biopsy; Pulmonary disease
李琪(1991—),女,甘肃陇西人,在读硕士。研究方向:介入超声。E-mail: lycheeqi@163.com
聂芳,兰州大学第二医院超声科,730030。E-mail: fang-nie@163.com
2016-09-25
2017-03-08
R655.3; R445.1
A
1672-8475(2017)05-0274-04
10.13929/j.1672-8475.201609035

