3种黑籽南瓜对枯萎病菌胁迫的响应
杨正安 周丽英 付忠 高婷 赵凯 张杰 丁玉梅
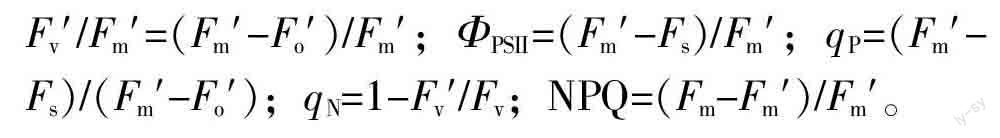
摘 要 为探究白皮、绿皮、花皮3种黑籽南瓜对枯萎病菌抗病能力差异,本研究测定枯萎病菌胁迫下3种黑籽南瓜的气体交换参数、叶绿素荧光参数、抗氧化系统、丙二醛(MDA)的变化。结果表明:当受到枯萎病菌侵染后,3种黑籽南瓜的气体交换参数均出现不同程度的降低,白皮黑籽南瓜呈现大幅下降;花皮黑籽南瓜的Fv′/Fm′和绿皮黑籽南瓜ΦPSII、qP上升,而白皮黑籽南瓜均表现下降,同时白皮黑籽南瓜qN和NPQ显著下降,绿皮黑籽南瓜下降幅度最小;在抗氧化系统中白皮黑籽南瓜过氧化物酶(POD)活性增大,花皮黑籽南瓜减小,但花皮黑籽南瓜超氧化物歧化酶(SOD)活性显著增大;绿皮和白皮黑籽南瓜MDA含量升高,而花皮黑籽南瓜显著下降。研究发现:正常生长的白皮黑籽南瓜具有较高的光合能力,但其对枯萎病菌的抵抗力较弱,绿皮和花皮黑籽南瓜的抗病性强于白皮黑籽南瓜。
关键词 枯萎病;黑籽南瓜;光合参数;抗氧化酶活性;MDA
中图分类号 S642.1 文献标识码 A
Response of Three Cultivated Varieties of Cucurbita
ficifotia to Fusarium Wilt
YANG Zhengan1, ZHOU Liying1, FU Zhong2, GAO Ting1,
ZHAO Kai1, ZHANG Jie1, DING Yumei3,4 *
1 College of Landscape and Horticulture, Yunnan Agriculture University, Kunming, Yunnan 650201, China
2 Kingenta Ecological Engineering Group Co. Ltd., Linyi, Shandong 276700, China
3 Biotechnology and Germlasm Institue, Yunnan Academy of Agriculture Science, Kunming, Yunnan 650223, China
4 School of Horticulture and Landscape Architecture, Southwest University, Chongqing 400715, China
Abstract The disease resistance of the Fusarium wilt in three cultivated varieties of Cucurbita ficifolia Bouche named‘WhitePpeel,‘Green Peel,‘Green Peel with Whitewas studied. This study measured the gas exchange parameters, chlorophyll fluorescence parameters and antioxidant system, malondialdehyde(MDA)of the three varieties by inoculating the pathogen of the Fusarium wilt. The results showed that the gas exchange parameters of the three varieties reduced with varying degrees, and‘White Peelfell sharply. Fv′/Fm′ of‘Green Peelwith‘White Peeland ΦPSII, qP of‘Green Peelincreased, but‘White Peeldecreased. qN and NPQ of‘White Peeldropped significantly, while‘Green Peelreduced least. Peroxidase(POD)activity of‘White Peelincreased, while that of‘Green Peel with Whitedecreased, but the superoxide dismutase(SOD)activity of‘Green Peel with Whiteincreased significantly. MDA of‘Green Peeland‘White Peelincreased, while that of‘Green Peel with Whitedropped significantly. The study revealed that the normal growth of‘White Peelhad a high photosynthetic capacity, but its resistance to Fusarium wilt was weak, and the resistance to Fusarium wilt of ‘Green Peeland‘Green Peel with Whitewere stronger than‘White peel.
Key words Fusarium wilt; Cucurbita ficifotia; photosynthetic parameters; antioxidant enzyme activity; MDA
doi 10.3969/j.issn.1000-2561.2017.01.025
我國是黄瓜、西瓜和甜瓜等葫芦科瓜类生产和消费大国,在世界瓜类种植中占有十分重要地位[1]。瓜类枯萎病是由镰孢属尖孢镰刀菌(Fusarium oxysporum)寄生引起的一种真菌性土传病害,病原菌从根部侵染植物,通过堵塞导管和分泌有毒物质为害寄主,造成叶片萎蔫和全株枯萎死亡。一般减产20%~30%,严重时可达50%~60%,甚至绝收[2]。枯萎病已成为影响全球瓜类品质和产量的重要病害且被国际社会所关注[3-4]。对于枯萎病的防治措施有轮作、嫁接及药剂防治等。由于土地资源限制轮作方法实施不易;化学药剂防治产生农药污染、抗药性及残留等,因此,选择优良的嫁接砧木,是目前最行之有效的方法之一[5-7]。黑籽南瓜(Cucurbita ficifolia)是南瓜属的一年或多年生草本藤蔓性植物,其对低温、干旱、贫瘠土壤尤其是瓜类枯萎病等逆境有较强的抗性,是嫁接黄瓜、西瓜等的良好砧木[8]。近年来,种用黑籽南瓜总产量达万余吨,总产值也达3.2亿元,生产上的用种也从野生状态变为了人工栽培,由于不注意提纯复壮,致使黑籽南瓜品种退化,降低或失去原有的抗性[9-10]。
黑籽南瓜田间有3种表现类型,即“绿皮”、“白皮”、“绿皮花纹”3种(以下简称:绿皮南瓜、白皮南瓜、花皮南瓜),并且通过调查发现田间表现抗病能力不同。目前关于黑籽南瓜的研究很少,本实验首次系统比较了枯萎病菌胁迫下3种不同抗性的黑籽南瓜气体交换参数、叶绿素荧光参数、抗氧化系统、丙二醛(MDA)等生理生化的变化,为高抗材料的筛选和利用提供参考,同时为开发和利用黑籽南瓜中优异的基因资源提供前期研究基础。
1 材料与方法
1.1 材料
1.1.1 供试黑籽南瓜品种 绿皮南瓜、白皮南瓜、花皮南瓜3种黑籽南瓜种子来自云南省昆明市呈贡区王家营村,对枯萎病抗性由强至弱依次是:花皮南瓜、绿皮南瓜>白皮南瓜。
1.1.2 供试基质 实验营养土,广州市生升农业有限公司。
1.1.3 供试营养液 采用日本园试通用配方[11]。
1.2 方法
1.2.1 试验方法
(1)病原菌孢子悬浮液配制。實验供试菌株从蒙自市黄瓜主生产区枯萎病株上得到,由本实验室分离纯化保存。将枯萎病菌种接种到含50 mg/L链霉素的PDA培养基上培养,7 d后取出已培养好的平板菌种,加无菌水配置孢子悬浮液,浓度为1×l06个/mL[12-14]。
(2)接种。供试幼苗准备:将黑籽南瓜种子,浸泡在10%的过氧化氢中处理2 h,然后栽入装有灭菌营养土的塑料营养钵中种植,放置于28 ℃温箱中,待出芽后移入温室大棚中[13-15]。浸根法接种:当3种黑籽南瓜长到两叶一心时,挑选长势一致的幼苗,用配制好的尖孢镰刀菌孢子悬浮液浸根处理30 min,对照组用等量灭菌水浸根处理30 min,然后栽回营养钵中继续培养,每处理重复10次。黑籽南瓜植株用自来水与营养液浇灌。
1.2.2 测定方法
(1)气体交换参数的测定。选择晴天上午外界环境相对稳定的9 : 00~11 : 30,采用Li-6400XT(Li-cor, Lincoln, USA)便携式光合测量系统测定叶片气体交换参数。测定前,利用仪器自带的光源设定PFD为1 000 μmol/(m2·s),控制参比室CO2浓度为(400±0.5)μmol/mol,叶温(25±1)℃;测定时,先将叶片夹入叶室,在所设置条件下稳定10 min,而后记录所测叶片的净光合速率(Pn),同时记录对应气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr),为消除时间上的误差,每个处理测量7株,且每次重复测定时各处理间采取随机测定方法,测定后将测量的叶片做好标记。
(2)叶绿素a荧光参数的测定。叶绿素a荧光参数用Li-6400XT(Li-cor, Lincoln, USA)便携式光合荧光测量系统进行测定。为使叶片充分暗适应,在天气晴朗的凌晨4 : 00~6 : 00,测量所做标记叶片的PSⅡ暗适应最小荧光(Fo)、暗适应最大荧光(Fm)和最大光化学效率(Fv/Fm)。随后,在当天上午9 : 00~11 : 30,仪器设置与气体交换参数相同的条件,记录所做标记叶片的光适应最小荧光(Fo′)、光适应最大荧光(Fm′)、稳态荧光(Fs),参照Demmig-Adams[16-17]的方法计算荧光动力学参数:
(3)POD、SOD、MDA的测定。过氧化物酶(POD)活性的测定参照Chen等[18]的方法,超氧化物歧化酶(SOD)活性的测定参照Giannopolitis等[19]的方法, 丙二醛(MDA)含量测定参照Hodges等[20]的方法。
1.3 数据分析
数据通过Microsoft Excel 2003软件处理;用SPSS 19.0(SPSS, Chicago, USA)做统计分析,同一品种不同处理间采用独立样本t检验进行差异显著性分析,对照组的不同品种间采用单因素方差分析进行差异显著性分析,当p<0.05时视为差异显著。
2 结果与分析
2.1 枯萎病菌胁迫对黑籽南瓜气体交换参数的影响
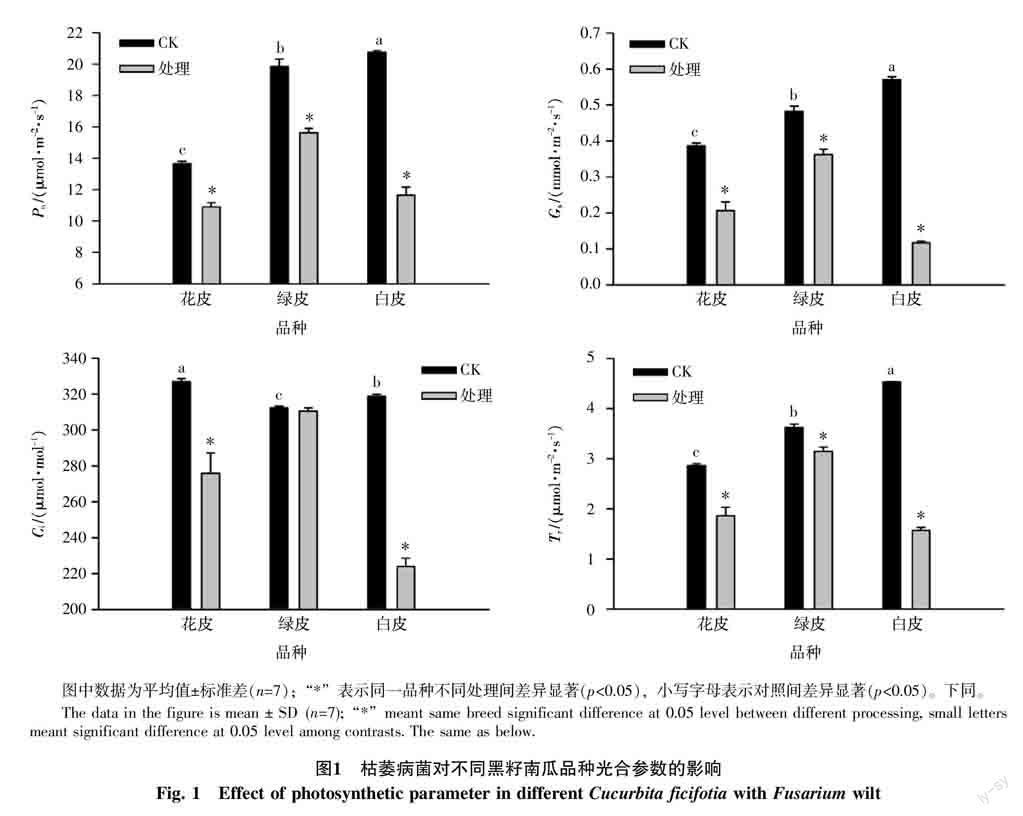
受到枯萎病菌处理的3种黑籽南瓜品种在气体交换参数上表现出明显的下降趋势(图1,p<0.05),除绿皮南瓜的Ci外均表现为显著下降(p<0.05)。处理后的绿皮南瓜的气体交换参数较其他品种下降幅度相对较小,其Pn、Gs、Ci和Tr的降幅分别为21.29%、24.95%、0.59%和13.09%;而白皮南瓜在处理后其Pn、Gs、Ci和Tr均下降幅度最高,分别达到了43.89%、79.53%、29.75%和65.41%,降幅较大。
2.2 枯萎病菌胁迫对黑籽南瓜叶绿素a荧光参数的影响
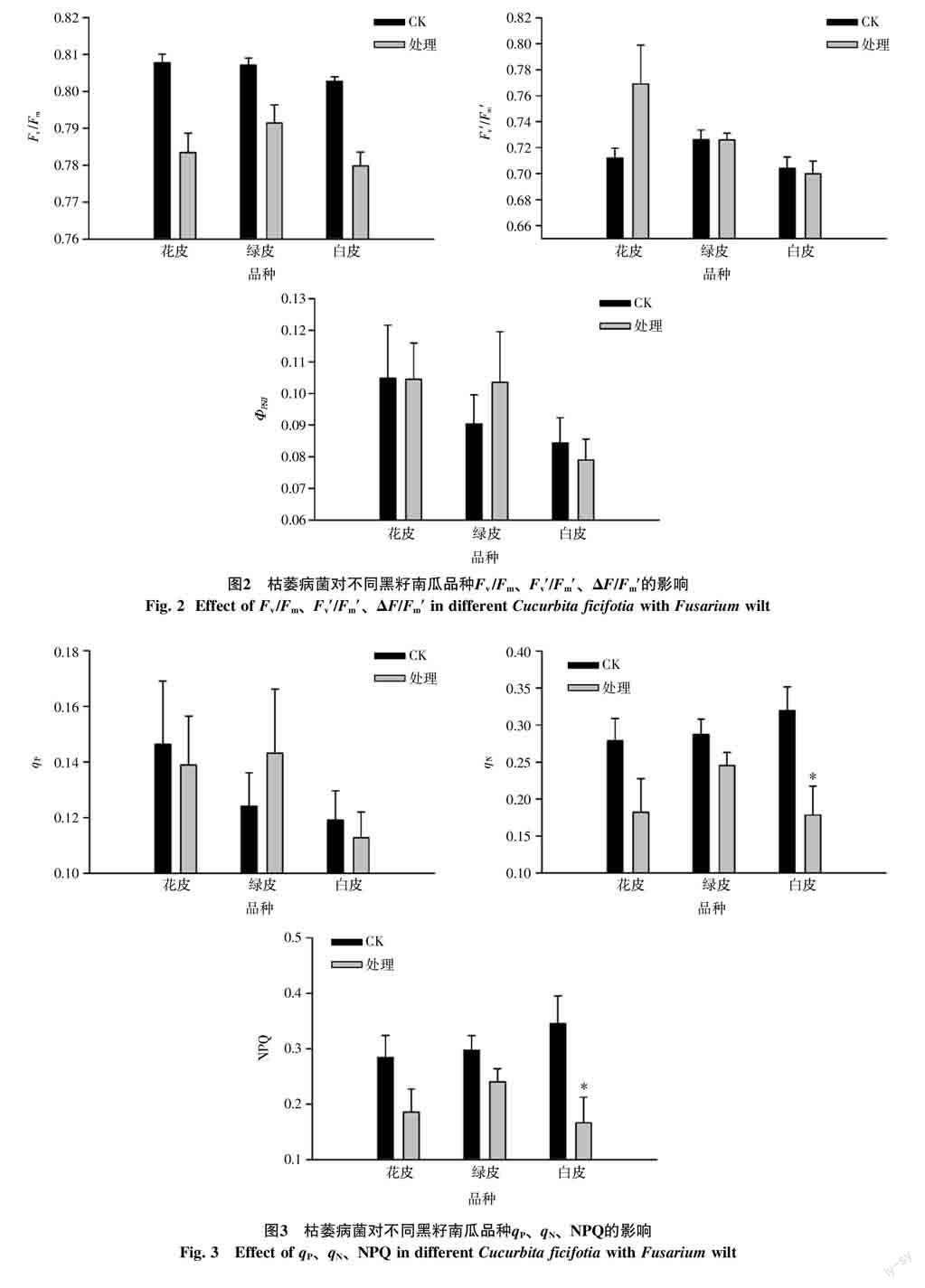
2.2.1 PSⅡ光化学效率参数 枯萎病菌对3种黑籽南瓜的光化学效率参数有明显影响(图2)。比较不同品种的Fv/Fm发现,在未经枯萎病菌处理前,3种黑籽南瓜品种均处于0.80以上;当处理后都表现出显著下降(p<0.05),均降至0.80以下,且绿皮黑籽南瓜降至0.79,降幅相对较小,而白皮降至0.78,降幅较大。3种黑籽南瓜处理后其Fv′/Fm′和ΦPSII上没有显著差异,但在数值上,经过处理后花皮南瓜的Fv′/Fm′和绿皮南瓜ΦPSII上升。
2.2.2 荧光淬灭参数 经过枯萎病菌处理的黑籽南瓜在荧光淬灭参数上的规律明显(图3)。当受到枯萎病菌感染后,绿皮南瓜的qP上升,花皮和白皮南瓜小幅下降;3种黑籽南瓜在受到处理后qN和NPQ都出现大幅下降,且白皮南瓜显著下降,绿皮南瓜下降幅度最小。
2.3 枯萎病菌胁迫对黑籽南瓜POD、SOD和MDA的影响
2.3.1 抗氧化酶 不同黑籽南瓜品种的POD和SOD活性在受枯萎病到菌侵染后有着不同的响应(图4,p<0.05)。在经过枯萎病菌侵染后3种黑籽南瓜的POD活性增大,且白皮南瓜增大幅度最大,增幅达到26.49%,花皮南瓜POD活性增大幅度较小,增幅为6.88%;3种黑籽南瓜的SOD活性变化并不一致,花皮南瓜显著增大,绿皮和白皮南瓜显著减小,且处理后花皮南瓜的SOD活性最高。
2.3.2 氧化伤害物质 当不同品种黑籽南瓜受到枯萎病菌侵染后,其氧化伤害物质MDA含量有着显著变化(图5,p<0.05)。处理后绿皮和白皮南瓜的MDA升高,增幅分别为12.56%和15.60%,但花皮南瓜的MDA显著下降,降幅为12.96%。
3 讨论
光合作用作为植物最重要的生命活动之一,其变化程度能够反映植物的抗性[21]。本研究表明,当受到枯萎病菌侵染后,3种黑籽南瓜的气体交换参数均出现不同程度的降低,而白皮南瓜的下降程度最大,这说明绿皮和花皮南瓜对枯萎病菌具有一定的抵抗能力,白皮南瓜的抵抗力更弱。植物光合能力受到气孔限制和非气孔限制的影响,前人研究发现,当Pn、Gs、Ci和Tr同时降低那么植物光合能力的下降由气孔限制造成,若Pn下降而Ci升高,说明非气孔因素限制了光合能力[22]。在本研究中,受到侵染的3种黑籽南瓜的Pn、Gs、Ci和Tr均下降,表明枯萎病菌侵入植株体内是通过降低气孔的导度来限制植物光合能力,这与李海莲等[23]对黄瓜枯萎病菌侵染茄子的研究结果一致。本研究结果说明,黑籽南瓜的气孔导度易于受到枯萎病菌的破坏,而白皮南瓜对病菌的抵抗力更弱。
叶绿素a荧光的变化可以从光合作用内部变化的角度反映环境因子对植物造成的影响[24]。一般认为,Fv /Fm下降可以作为植物受到环境胁迫的指标[25-26],在本研究中,病菌处理后3种黑籽南瓜Fv /Fm均大幅下降,这表明枯萎病菌对植物产生严重的环境胁迫。Fv′/Fm′表示PSⅡ反应中心对激发态叶绿素的亲和力[27]。ΦPSII反映了PSⅡ反应中心的实际光化学效率[28],qP表示PSⅡ开放反应中心的比例[29],本研究中,受到枯萎病菌侵染的花皮南瓜Fv′/Fm′增大,绿皮南瓜的ΦPSII和qP上升,表明病菌侵染促进了花皮和绿皮南瓜光系统对激发能的捕获和利用能力,这与前人[30-31]对病菌侵染植物的研究结果相反,可能是因为逆境激发了这两种黑籽南瓜光合机构的光能利用潜能。qN和NPQ均能够反映植物热耗散的能力[28],在本研究中,病菌侵染破坏了植株的耗散能力,但白皮南瓜被破坏的更为严重,这进一步削弱了植株自身的抗性。
MDA是膜脂过氧化过程的最终产物,它的含量能够反映细胞膜受损程度[32]。试验结果中,受到侵染后花皮南瓜的MDA含量下降而绿皮和白皮南瓜含量上升,并且花皮南瓜有着较低的MDA含量。王建明等[33]在研究枯萎病菌侵染西瓜幼苗时发现抗病品种MDA含量低于感病品种,这说明花皮南瓜有作为抗病品种的潜能。POD和SOD是植物体内抗氧化酶系统中非常重要的两种酶,它们能够清除植物体内有害的超氧阴离子自由基进而保护细胞受到破坏[34],在本试验中,当黑籽南瓜受到侵染后POD活性均上升,但仅花皮南瓜的SOD活性上升。这些结果说明,遭受侵染的花皮南瓜其POD和SOD的协同作用有效降低了植株体内细胞膜脂的破坏程度。
综上可知,正常生长的白皮南瓜具有较高的光合能力,但其对枯萎病菌的抵抗力较弱;病菌侵害能够激发绿皮和花皮南瓜光合机构对光的捕获和利用潜能;在光保护上,绿皮南瓜通过热耗散途径消耗过剩光能,而花皮南瓜更依赖抗氧化酶系统消除氧自由基的方式保护自身光合机构。因此,绿皮和花皮南瓜的抗病性强于白皮南瓜。
参考文献
[1] 刘君璞, 许 勇, 孙小武, 等. 我国西瓜甜瓜产业 “十一五” 的展望及建议[J]. 中国瓜菜, 2006(1): 1-3.
[2] 吕桂云, 张海英, 郭绍贵, 等. 寄主植物与枯萎病菌互作机理的研究进展[J]. 中国蔬菜, 2010(4): 1-7.
[3] 乔燕春, 林锦英, 谢伟平, 等. 瓜类枯萎病研究进展(综述)[J]. 亚热带植物科学, 2013, 42(3): 272-278.
[4] Wang M, Ling N, Dong X, et al. Thermographic visualization of leaf response in cucumber plants infected with the soil-borne pathogen Fusarium oxysporum f. sp. Cucumerinum[J]. Plant Physiol Biochem, 2012(61): 153-161.
[5] 蒋 荷, 曹 莎, 王丽君, 等. 黄瓜枯萎病研究进展及其综合防治[J]. 中国植保导刊, 2012(11): 13-17.
[6] 高 军, 高增贵, 赵世波, 等. 瓜类枯萎病及其防治研究进展[J]. 长江蔬菜, 2006(1): 35-38.
[7] 孙玉宝, 张国桥, 杜念华, 等. 甜瓜抗枯萎病的遗传与育种[J]. 长江蔬菜, 2000, 2(2): 1-3.
[8] 尹 梅, 楊明挚, 陈善娜, 等. 黑子南瓜的抗逆性初探[J]. 云南大学学报(自然科学版), 2003(S1): 131-134.
[9] 李耀光, 吕继康, 蔺合华, 等. 晋南地区黄瓜、黑籽南瓜死秧的病原菌鉴定及品种抗性研究[J]. 植物保护, 2007, 33(4): 64-67.
[10] 杨正安, 孟平红, 代 贤, 等. 云南黑籽南瓜种质遗传多样性的RAPD和ISSR分析[J]. 植物遗传资源学报, 2011(6): 860-864.
[11] 郭世荣. 无土栽培[M]. 北京: 中国农业出版社, 2003: 368-369.
[12] 翁祖信, 蒋兴祥, 肖小文. 黄瓜枯萎病抗病性鉴定方法研究-胚根接种法[J]. 中国蔬菜, 1985(2): 30-33.
[13] 仲 莎, 姜守阳, 刘桂花, 等. 化学药剂处理对黑籽南瓜种子发芽率的影响[J]. 北方园艺, 2013(14): 34-35.
[14] 吴学宏, 郝京京, 王红梅. 西瓜枯萎病菌几种接种方法比较试验[J]. 长江蔬菜, 2003(3): 38-39.
[15] 陆家云. 植物病原真菌学[M]. 北京: 中国农业出版社, 2001.
[16] Demmig-Adams B, Adams W W Ⅲ, Logan B A, et al. Xanthophyll cycle-dependent energy dissipation and flexible PSⅡ efficiency in plants acclimated to light stress[J]. Australian Journal of Plant Physiology, 1995(22), 261-276.
[17] Demmig-Adams B, Adams Ⅲ W W, Barker D H, et al. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation[J]. Physiologia Plantarum, 1996, 98(2), 253-264.
[18] Chen J W, Cao K F. Changes in activities of antioxidative system and monoterpene and photochemical efficiency during seasonal leaf senescence in Hevea brasiliensis trees[J]. Acta Physiologiae Plantarum, 2008(30): 1-9.
[19] Giannopolitis G N, Reis S K. Superoxide dismutase occurrence in higher plants[J]. Plant Physiology, 1977(59): 309-315.
[20] Hodges D M, Delong J M, Forney C F. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J]. Planta, 1999(207): 604-611.
[21] 王惠哲, 李淑菊, 霍振荣, 等. 黄瓜感染白粉病菌后的生理变化[J]. 华北农学报, 2006(1): 105-109.
[22] Farquar G D, Sharkey T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology, 1982, 33(1): 317-345.
[23] 李海莲, 侯喜林, 易金鑫, 等. 黄萎病菌粗毒素接种对感病和抗病茄子品种的一些酶类活性和光合特性的影响[J]. 植物生理学通讯, 2005(4): 453-456.
[24] Jiang C D, Gao H Y, Zou Q. Changes of donor and accepter side in photosystem Ⅱ complex induced by iron deficiency in attached soybean and maize leaves[J]. Photosynthetica, 2003, 41: 267-271.
[25] 钱永强, 周晓星, 韩 蕾, 等. Ca2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响[J]. 生态学报, 2011(31): 6 134-6 142.
[26] 刘柿良, 马明东, 潘远智, 等. 不同光强对两种桤木幼苗光合特性和抗氧化系统的影响[J]. 植物生态学报, 2012(36): 1 062-1 074.
[27] Harbinson J, Genty B, Baker N R. Relationship between the quantum efficiency of photosystem Ⅰ and Ⅱ in pea leaves[J]. Plant Physiol, 1989(90): 1 029-1 034.
[28] 许大全. 光合作用效率[M]. 上海: 上海科学技术出版社, 2002: 15-17, 120
[29] Aaxwell D P, Falk S, Trick C G, et al. Growth at low temperature mimics high-light acclimation in Chlorella vulgaris[J]. Plant Physiol, 1991(105): 535-543.
[30] 张国良, 戴其根, 霍中洋, 等. 外源硅对纹枯病菌(Rhizoctonia solani)侵染下水稻叶片光合功能的改善[J]. 生态学报, 2008(10): 4 881-4 890.
[31] Guidi L, Mori S, Deg Innocenti E, et al. Effects of ozone exposure or fungal pathogen on while lupin leaves as determined by imaging of chlorophyll a fluorescence[J]. Plant Physiology and Biochemistry, 2007, 45(10-11): 851-857.
[32] 惠竹梅, 王智真, 胡 勇, 等. 2,4-表油菜素內酯对低温胁迫下葡萄幼苗抗氧化系统及渗透调节物质的影响[J]. 中国农业科学, 2013, 46(5): 1 005-1 013.
[33] 王建明, 张作刚, 郭春绒, 等. 枯萎病菌对西瓜不同抗感品种丙二醛含量及某些保护酶活性的影响[J]. 植物病理学报, 2001, 31(2): 152-156.
[34] 安 娜, 朱 颜, 崔秀明, 等. 三七种子后熟期生理生化的动态研究Ⅲ不同贮藏条件下种子酶活性分析[J]. 西南农业学报, 2010, 23(5): 1 477-1 480.

