不同地区荷花腐败病菌生物学特性及IGS序列分析
曾莉莎 吕顺 郑芝波 梁少丽 周建坤 庄华才 杜彩娴 麦进培 莫秀文

摘 要 荷花腐敗病发生普遍,对荷花生产危害巨大,已成为制约中国荷花产业持续发展的重要障碍。为明确中国荷花腐败病菌(Fusarium commune)的生物学特性及遗传分化情况,本文采用藕块接种法对采自广东、湖南、湖北3个不同地区的病原菌进行致病性测定,研究了不同温度、pH、碳氮源对病原菌菌丝生长的影响,同时利用rDNA IGS基因序列对采自不同地区的荷花腐败病菌株进行了系统发育分析。结果表明,荷花腐败病菌对温度、pH等适应范围广,温度在15~35 ℃,pH4~9均能生长,最适生长温度为25 ℃,最佳pH值为7,且能利用多种碳氮源。不同的碳源中,蔗糖和葡萄糖较适合该菌的生长;在供试氮源中,菌丝在蛋白胨的基础培养基上生长最快,在尿素的基础培养基上生长最慢;当温度为15、20、30或35 ℃时,湖北的菌株平均菌落直径最大;当pH值为4.0~5.0时,广东菌株的平均菌落直径较大,当pH值为7.0~9.0时,来自湖北的菌株菌落直径最大。不同地区的病原菌间致病力存在一定差异,基于rDNA IGS的系统发育分析表明,不同地区的病原菌株间存在一定的遗传分化,其中广东菌株与湖南菌株亲缘关系较近(同源性高达99.7%),遗传距离为0.003;而广东菌株与湖北菌株的亲缘关系较远(同源性为97.3%),遗传距离为0.027。
关键词 荷花腐败病;病原菌;生物学特性;rDNA-IGS序列
中图分类号 S682 文献标识码 A
Biological Characteristics and IGS Sequence Analysis of Pathogen
Strains Causing Lotus Rhizome Rot(Fusarium commune)
from Different Regions
ZENG Lisha1, Lü Shun1, ZHENG Zhibo2 *, LIANG Shaoli1, ZHOU Jiankun1,
ZHUANG Huacai1, DU Caixian1, MAI Jinpei2, MO Xiuwen3
1 Dongguan Banana and Vegetable Institute, Dongguan, Guangdong 523061, China
2 The Agriculture Research Center of Dongguan, Dongguan, Guangdong 523086, China
3 Dongguan Agricultural Technique Extension Management Office, Dongguan, Guangdong 523010, China
Abstract Rhizome rot disease of lotus, which had occurred widely, not only caused severe damage to lotus production, but also became one of the major obstacles to the sustaining development of lotus industry in China. To clarity the biological characteristics and genetic differentiation of Fusarium commune, the causal agent of lotus rhizome rot, pathogenicity test, biological factors(temperature, pH value, carbon and nitrogen sources)and phylogenetic analysis based on rDNA IGS gene were studied. The results showed that F. commune could grow from 15 to 35 ℃, and the optimal temperature was 25 ℃. It grew well from pH 4 to 9, and the optimal pH was 7. It could also utilize many substances as carbon and nitrogen sources. Among tested sucrose, saccharose and glucose were the best carbon sources for the growth of F. commune, peptone was the most suitable nitrogen source while ureal was the worst. When the cultivation temperature was 15,20,30 or 35 ℃, Hubei isolates had the largest colony diameter. Guangdong isolates had the largest colony diameter from pH 4 to 5, and Hubei isolates had the largest colony diameter from pH 7 to 9. Pathogenicity differentiation was existed between pathogen strains from different regions. Phylogenetic analysis showed that there was obvious genetic differentiation between these isolates from different provinces. Guangdong isolates has the similarity of 99.7% to Hunan isolates and the genetic distance between two provinces was 0.003. Whereas, Guangdong isolates presented 97.3% similarity to Hubei isolates and the genetic distance between two provinces was 0.027.
Key words lotus rhizome rot disease; pathogen; biological characteristics; rDNA IGS sequence
doi 10.3969/j.issn.1000-2561.2017.01.024
荷花(Nelumbo nucifera)又称莲藕、莲花,是莲科莲属多年生草本挺水植物,也是中国十大名花中唯一的水生花卉[1-2]。中国栽培荷花历史悠久,已成为世界荷花的栽培中心[3]。近年来,珠三角荷花栽培集中区,如三水荷花世界、番禺莲花山、东莞桥头等湿地,大范围发生腐败病,影响了正常的生产与旅游观光产业[4]。荷花腐败病是荷花种植区发生最普遍、为害严重的病害之一,主要为害荷花(莲藕)地下茎部,也能为害叶片和叶柄[5-6]。荷花腐败病在荷花生长期和莲藕贮藏期均可发病,分布广阔,全国各荷花产区均有发生[6]。因此,荷花腐败病能否得到有效控制,已经成为中国荷花栽培及荷花产业持续发展急需解决的重大问题。在过去,由于Fusarium commune这个种群尚未发现以及从尖孢镰孢菌复合种(FOSC)中细分出来[7-8],人们根据传统的镰孢菌分类系统将莲藕(荷花)腐败病鉴定为尖孢镰孢菌莲专化型(Fusarium oxysporum.f. sp. nelumbicola)[5,9]。镰孢菌分类发展快,2016年,曾莉莎等[4]通过病原菌形态鉴定及致病力测定,分子特异检测,以及基于TEF-1α、IGS、mtSSU等镰孢菌分类鉴定中常用基因片段的系统发育分析,对中国广东、广西、福建、江西、湖南、湖北等地的荷花(莲藕)腐败病菌进行再鉴定表明,分离自这些地区的荷花腐败病病原菌为Fusarium commune。但是目前关于镰孢菌F. commune的生物学特性及遗传发育情况仍少有报道。
明确荷花腐败病菌的生物学特性对于生产上指导该病害的有效防控意义重大,2015年,周小军等[10]对浙江地区的莲腐败病菌的生物学特性进行了研究,但周小军等[10]的研究均只限于某一个省内某地区的荷花腐败病菌的生物学特性,对其他省荷花腐败病菌仍缺乏一个系统的生物学研究。另外,现有关于莲腐败病菌的報道多数也是针对籽莲或者莲藕品种的病原菌,目前还没针对珠三角或其它地区观赏荷花品种(花莲品种)的腐败病菌进行生物学特性研究的报道。
rDNA基因间隔区IGS(Intergenic spacer)被认为是rDNA中变异最快的区域,被广泛用于同属真菌不同种间和种内不同群体间的比较[11-12],也常用于镰孢菌属种间及种内菌株的鉴定及系统发育关系研究[13-16]。O'Donnell等[17]采用IGS基因片段对来源于植物和人类的病原镰孢菌进行了系统分析,认为IGS是适用于Fusarium群体遗传多样性分析的基因片段。
本研究对采自广东省、湖南省和湖北省不同地理环境及不同荷花品种类型的8株荷花腐败病菌(Fusarium commune)菌株进行生物学基本特性研究,分析不同地区及不同品种来源的病菌间生物学特性的差异,同时利用rDNA基因间隔区IGS序列分析进行不同地区菌株的系统发育研究,初步了解种内菌株的亲缘关系,为因地制宜地防治荷花腐败病奠定理论基础。
1 材料与方法
1.1 材料
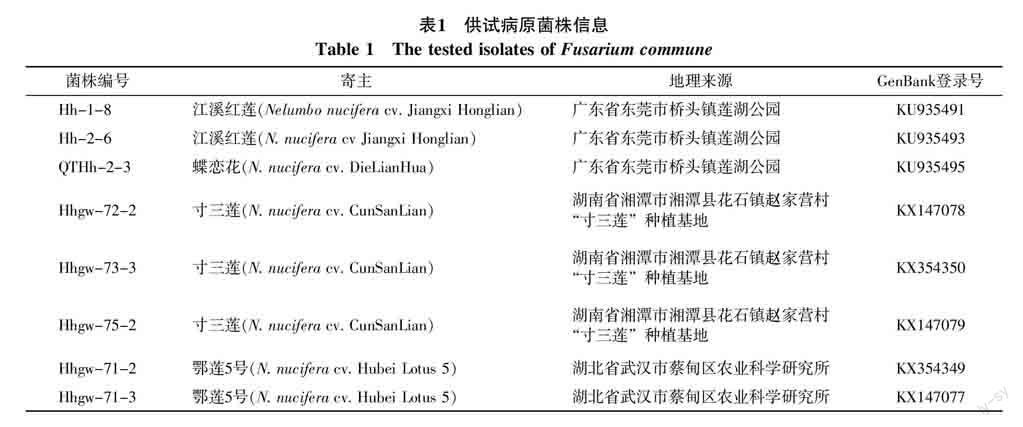
供试病原菌为采自广东、湖南及湖北3省不同地区具有代表性的8个荷花腐败病(Fusarium commune)菌株,其来源及编号如表1。其中广东的病原菌株分离自江溪红莲和蝶恋花(花莲品种);湖南的病原菌株分离自湘莲“寸三莲”(籽莲品种);湖北的病原菌株分离自鄂莲5号(藕莲品种)。
1.2 方法
1.2.1 病原菌分离与纯化 从病株地下茎(藕)、须根、莲鞭或叶柄的病健交界处切取5 mm×5 mm组织,采用常规组织分离法进行病菌分离[18],于25 ℃在PDA上培养2~3 d,待长出菌落后,挑菌落边缘菌丝培养,经单孢分离后保存备用。取经单孢分离获得的典型菌株作为本研究供试菌株。
1.2.2 病原菌致病性测定 采用病原菌菌丝块接种藕块的方法[19]进行致病性测定:在无菌的条件下,将在PDA平板上培养7 d的各供试病原菌用打孔器自菌落边缘切取直径6 mm的菌饼,将菌饼接种于藕块的中央,菌丝面朝下,每个藕块接种1个菌饼,接种后将藕块放置在垫有湿纸巾的碟子上,置于(25±1)℃的培养箱中保湿培养。每个测试菌株接种藕块12片,做3次重复。参考魏林等[19]的“接种藕块病级分级标准”进行病情指数调查,统计不同地区菌株的发病率及病情指数差异。
1.2.3 PDA培养基形态比较 在PDA培养基上对分离出来的不同地区病菌进行形态比较及描述,每个测试菌株培养并观察记录6皿。
1.2.4 温度对不同菌株生长的影响 将活化的荷花腐败病菌在PDA平板上培养4 d后,用打孔器从菌落边缘打取直径为6 mm的菌饼,将菌饼移接到PDA培养基上,分别放置于5、10、15、20、25、30、35、40 ℃共8个温度梯度中进行恒温培养[20],每个处理5次重复,培养4 d后用十字交叉法测量菌落直径。
1.2.5 pH值、氮源、碳源对不同菌株生长的影响
参照唐琦等[20]及杨秀娟等[21]的方法,测定pH值、碳氮源对不同地区荷花腐败病菌菌株生长的影响。
1.2.6 IGS区序列测定 (1)基因组DNA制备。供试菌株基因组DNA的提取方法参见SDS裂解法[22],并略作改进。
(2)IGS序列扩增。扩增引物序列为CNS1(5′-GAGACAAGCATATGACTACTG-3′)及CNL12(5′-CTGAACGCCTCTAAGTCAG-3′)PCR反应体系参照Zhu等[16]的描述。扩增程序为:94 ℃预变性2 min;94 ℃变性1 min,60 ℃退火1.5 min,72 ℃延伸2 min,35个循环;72 ℃延伸10 min,4 ℃保存.
(3)序列测定和分析。PCR产物经琼脂糖电泳回收后交由赛默飞生命科学有限公司(Thermo Fisher)进行测序,采用软件Clustal X(http://inn-prot.weizmann.ac.il/software/ClustalX.html)进行对位排列,手动校正错读漏读碱基,用Sequin软件将基因序列登录到GenBank(NCBI)中。排列好的序列用Mega5.0软件Neighbour-Joining法构建系统进化树,采用靴带(bootstrap)分析法进行检验,共重复1 000次[23-24]。
2 结果与分析
2.1 分离菌株菌落形态
分离自各地区的菌株在PDA培养基上生长5 d后,菌落存在一定差异。来自湖南及湖北两地的菌株菌落形状较圆,边缘整齐,菌丝较粗壮,菌落颜色偏白,菌丝较长;广东的菌株菌落大小偏小,颜色明显偏红紫色,边缘不齐,菌落较薄,菌丝较短(图1)。
2.2 病原菌致病性测定结果
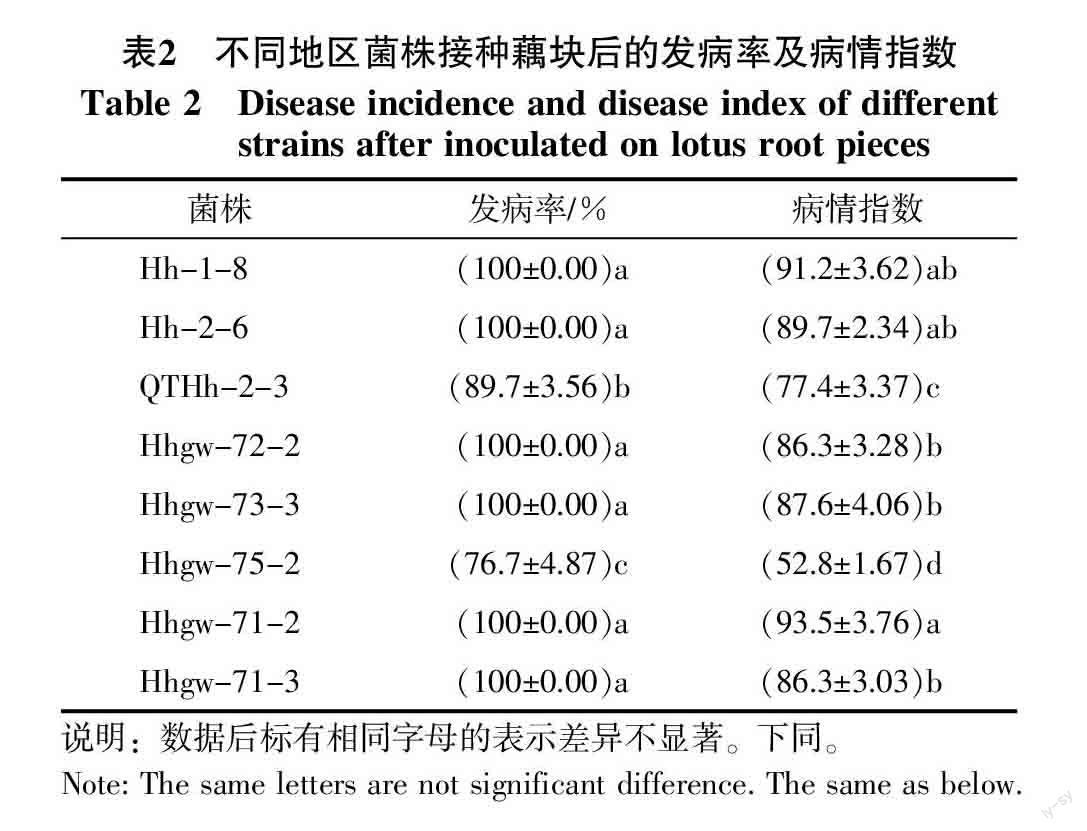
供试菌株接种藕块后发病情况见表2,其中广东菌株接种后发病率及病情指数较高,其次是湖北菌株,湖南菌株发病率及病情指数较低。广东及湖北的菌株接种藕块后,藕块维管束变褐明显(维管束呈深褐色),变色部分面积较大;湖南菌株接种藕块后,菌丝块在藕块上生长速度较慢,藕块变色面积较小(图2)。
2.3 温度对不同菌株生长的影响
温度对不同菌株生长的影响如表3所示。结果表明,在15~35 ℃范围内来源于各地区的荷花腐败病菌均能生长,当温度低于10 ℃或高于40 ℃时菌丝停止生长。当温度为25 ℃时,各地区菌株的菌落直径都达到最大值,表明25 ℃为最适合荷花腐败病菌菌丝生长的温度。当温度为15、20、30、35 ℃时,分离自湖北的菌株菌落直径最大,与分离自湖南的菌株差异显著,这可能与该地区的菌株对温度的适应范围较广有关。
2.4 pH值对不同菌株生长的影响
pH值对不同菌株生长的影响试验表明(表4),pH值对荷花腐败病菌生长的影响较大。病原菌在pH值4.0~9.0范围内均能生长,各地区菌株生长的较适宜pH值均为6.0~7.0;其中pH7.0最适合菌丝生长。当pH值为4.0或5.0时分离自广东菌株的菌落直徑较大;当pH值为7.0~9.0时,湖北菌株的平均菌落直径最大,与分离自其它地区的菌株菌落直径差异显著,说明了广东菌株对酸性环境的适应性较好,而湖北菌株对碱性环境的适应性较好。
2.5 碳源对不同菌株生长的影响
碳源对不同荷花腐败病菌株生长的影响试验表明(表5),菌株对不同碳源的利用程度不同,以蔗糖为碳源时菌落直径最大,其次为葡萄糖、果糖、麦芽糖和乳糖。其中,以果糖和乳糖为碳源时,分离自湖北的菌株菌落直径较大,与分离自其它地区的菌株差异显著。
2.6 氮源对不同菌株生长的影响
氮源对不同菌株生长的影响试验表明(表6),不同的氮源对病原菌生长均有影响,其中蛋白胨的利用率最好,其次是硝酸铵和甘氨酸,尿素的利用率最差。其中以甘氨酸、硝酸铵、硫酸铵等为氮源时,不同地区菌株的菌落直径差异较显著。
2.7 IGS序列的系统发育分析
2.7.1 碱基序列大小 所得测序结果经过拼接后,得到8个供试菌株的IGS序列,大小约为2 500 bp,将8个菌株的IGS基因序列登录到GenBank(NCBI)中,每个菌株的GenBank登录号如表1所示。其中广东3个菌株G+C的含量相同为54.5%,湖南3个菌株中Hhgw-73-3的G+C含量为54.6%,其它2个菌株的G+C含量相同(为54.7%),湖北2个菌株G+C的含量也相同(为54.4%)。
2.7.2 分子系统树的比较与分析 以发表于GeneBank上的棉花枯萎病菌FOV14(NCBI Accession Number: DQ831885)为外类群,构建NJ系统进化树,结果见图4。来自广东、湖南、湖北3个不同地区的8个菌株形成3个独立的系统进化枝(Clade)。其中,来自湖南的菌株3个菌株聚为一组,可以分成2个小的亚分枝(Subclade);分离自广东省的3个菌株聚为一组,与来自湖南的菌株亲缘关系较近(2省菌株的同源性高达99.7%),平均遗传距离为0.003;分离自湖北省的2个菌株聚为一组,广东菌株与来自湖北的2个菌株的亲缘关系较远,同源性为97.3%,遗传距离为0.027。
3 讨论
荷花腐败病又称“莲瘟”,是由镰孢菌Fusarium commune引起的重要土传病害[4]。目前荷花腐败病已成为阻碍荷花产业持续发展的一个重要因素[25],明确荷花腐败病菌的生物学特性对于生产上指导该病害的有效防控意义重大。
本文通过对广东、湖南、湖北3省的荷花腐败病菌生物学特性研究表明,荷花腐败病菌对温度、pH等适应范围广,温度在15~35 ℃,pH4~9均能生长,最适生长温度为25 ℃,最佳pH值为7.0,且能利用多种碳氮源。以上研究与周小军等[10]的报道基本一致,但是周小军等[10]对浙江荷花腐败病菌生物学特性的研究表明,莲腐败病病原菌菌丝35 ℃停止生长,而本研究表明病原菌在35 ℃时仍然能生长,只是菌落生长速度较慢,这可能与不同地区的病菌对温度的适应范围不同有关系。不同的碳源中,蔗糖、葡萄糖和果糖较适合该菌的生长;在供试氮源中,菌丝在蛋白胨的基础培养基上生长最快,在尿素的基础培养基上生长最慢。以上结果为从农艺措施上防治荷花腐败病提供了参考依据,当气候温度接近25 ℃时,要加强对该病害的防控,防治该病害时要注意对荷塘水土酸碱度的调节,通过创造不利于病菌生长繁殖的环境条件来控制病害[26]。
试验发现,当温度为15、20、30、35 ℃时,湖北的菌株菌落直径最大,这可能与该地区的菌株对温度的适应范围较广有关;当pH值为4.0或5.0时广东的菌株菌落直径较大,当pH值为7.0~9.0时,来自湖北菌株的平均菌落直径最大,说明了广东菌株对酸性环境的适应性较好,湖北菌株对碱性环境的适应性较好。以上结果表明了不同地区的病菌在生物学特性上也是有一定差异的,生产上应该因地制宜地指导不同荷花栽培区进行腐败病的科学防控。
从荷花腐败病菌接种藕块后的发病率及病情指數来看,不同地区的病原菌间致病力存在一定差异,其中广东及湖北的菌株接种藕块后,藕块维管束变褐明显,变色部分面积较大;湖南的菌株接种后,菌丝块在藕块上生长速度较慢,藕块变色面积较小。这说明了地理环境可能会影响菌株的分化,广东与湖南、湖北3省在纬度、经度等地理环境方面存在较大差异,且3个地区的菌株分离自不同的荷花品种类型,因此不同菌株间存在一定的致病力分化,但是由于本文收集的菌株量有限,而且采用的是藕块接种法[19],关于不同荷花主栽区及来源于不同荷花品种的腐败病致病菌致病力分化情况,还需要大量收集不同地区的病菌,通过盆栽接种法及田间小区试验作进一步深入研究。
本文通过基于rDNA IGS的系统发育分析表明,各菌株间存在一定的遗传多态性,来自广东、湖南、湖北3个不同地区的8个菌株形成3个独立的分支,其中分离自广东省的3个菌株与来自湖南的菌株同源性高达99.7%,广东菌株与来自湖北的菌株的亲缘关系较远,遗传距离为0.027,以上结果表明了中国的荷花腐败病菌存在丰富的遗传多样性,不同地区的致病菌株间存在一定的遗传分化。其中广东的病原菌株分离自江溪红莲和蝶恋花(花莲品种);湖南的菌株分离自湘莲“寸三莲” (籽莲品种);湖北的菌株分离自鄂莲5号(藕莲品种)。因此,通过本文的研究也表明不同品种来源的病原菌株存在丰富的遗传多样性,但是目前关于不同品种来源的莲腐败病菌的遗传差异的研究较少,中国的荷花(莲)品种众多,而且荷花是一种水生植物,在品种的收集、病原菌的接种及品种的抗病性鉴定等方面都存在较大的难度。因此,接下来还需要开展大量的工作,进一步研究荷花腐败病菌是否存在生理小种的分化及进行强致病性生理小种的筛选鉴定[27],以期为病害的有效防治及抗病品种选育提供参考。
致 谢 本研究在采集病害样品时得到湖南省植物保护研究所魏林研究员、武汉市蔬菜科学研究所水生蔬菜研究室李峰主任及武汉市蔡甸区农业科学研究所朱志坤的帮助,谨致谢意!
参考文献
[1] 任全伟. 荷花的栽培繁殖[J]. 中国花卉园艺, 2008(12): 12-15.
[2] 刘仁林. 莲(荷花)Nelumbo nucifera Gaertn[J]. 江西林业科技,2010(6): 3.
[3] 王其超, 张行言. 荷花发展前景--从中国视角展望[J]. 中国园林, 2011(1): 50-53.
[4] 曾莉莎, 郑芝波, 吕 顺, 等.荷花腐败病病原菌的形态学与多基因分子系统学鉴定[EB/OL]. [2016-11-01].http: //www.cnki.net/kcms/detail/11.2184.S.20161101.0936.001.html.
[5] 胡长志, 孙晓棠, 谢克强, 等. 白莲腐败病病原菌的分离鉴定[J]. 长江蔬菜, 2013(18): 92-94.
[6] 魏 林, 梁志怀, 成燕清, 等. 莲腐败病的识别与综合防治[J]. 长江蔬菜, 2014(19): 46-47.
[7] Skovgaard K, Rosendahl S, O'Donnell K, et al. Fusarium commune is a new species identified by morphological and molecular phylogenetic data[J]. Mycologia, 2003, 95(4): 630-636.
[8] Ellis M L, Arias M D, Jimenez D C, et al. First report of Fusarium commune causing damping-off, seed rot, and seedling root rot on soybean (Glycine max) in the United States[J]. Plant Disease, 2013, 97(2): 284.
[9] 刘安国, 汪金莲, 刘光亮, 等. 莲腐败病病原镰刀菌的分离和鉴定[J]. 江西农业大学学报, 1990, 12(2): 1-4.
[10]周小军, 何晓婵, 郑寨生, 等. 莲藕腐败病病原菌生物学特性研究[J]. 浙江农业学报, 2015, 27(2): 211-214.
[11] 梁 宏, 彭友良, 张国珍, 等. 腥黑粉菌属3种检疫性真菌rDNA-IGS区的扩增及其序列分析[J]. 植物病理学报, 2006, 36(5): 407-412.
[12] 曾莉莎, 吕 顺, 刘文清, 等. 基于多基因序列分析对尖孢镰孢菌古巴专化型(香蕉枯萎病菌)生理小种的鉴定[J]. 菌物学报, 2014, 33(4): 867-882.
[13] Fourie G, Steenkamp E T, Gordon T R, et al. Evolutionary relationships among the Fusarium oxysporum f. sp. cubense vegetative compatibility groups[J]. Applied and Environmental Microbiology, 2009, 75(14): 4 770-4 781.
[14] Dita M A, Waalwijk C, Buddenhagen I W, et al. A molecular diagnostic for tropical race 4 of the banana Fusarium wilt pathogen[J]. Plant Pathology, 2011, 60(2): 384.
[15] Skovgaard K, Rosendahl S, O'Donnell K, et al. Fusarium commune is a new species identified by morphological and molecular phylogenetic data[J]. Mycologia, 2003, 95(4): 630-636.
[16] Zhu Z X, Zheng L, Pan L, et al. Identification and characterization of Fusarium species associated with wilt of Eleocharis dulcis (Chinese water chestnut) in China[J]. Plant Disease, 2014, 98(7): 977-987.
[17] O'Donnell K, Gueidan C, Sink S, et al. A two-locus DNA sequence database for typing plant and human pathogens within the Fusarium oxysporum species complex[J]. Fungal Genetics and Biology, 2009, 46: 936-948.
[18] 方中達. 植病研究方法[M]. 北京: 中国农业出版社, 1998.
[19] 魏 林, 曹福祥, 梁志怀, 等. 莲藕腐败病病原菌人工接种致病性测定方法的研究[J]. 湖南农业科学, 2009(7): 74-76.
[20] 唐 琦, 纪春艳, 李云锋, 等. 不同地区香蕉枯萎病菌4号生理小种生物学特性及ITS序列分析[J]. 广东农业科学, 2012(1): 1-5.
[21] 杨秀娟, 陈福如, 何玉仙. 枇杷拟盘多毛孢菌的生物学特性及杀菌剂的药效研究[J]. 福建农业学报, 2003, 18(2): 89-92.
[22] Lee S B, Taylor J W. Isolation of DNA from fungal mycelial and single spores.In: PCR protocols: a guide to methods and applications[M]. San Diego: Academic Press, 1990: 283-287.
[23] Thompson J D, Gibson T J, Plewniak F, et al. The Clustal X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Rescarch, 1997, 25(24): 4 876-4 882.
[24] 胡松年, 薜庆中. 基因组数据分析手册[M]. 浙江: 浙江大学出版社, 2004.
[25] 张丽春. 建莲腐败病的识别与防治[J]. 长江蔬菜, 2013(18): 105-107.
[26] 林兰稳, 李兆雄, 何熊威. 粉葛根腐病菌的生物学特性及防治研究[J]. 生态环境, 2004, 13(3): 382-384.
[27] 梁志怀, 魏 林, 安哲宇. 莲藕腐败病病原菌致病性及遗传差异性的研究[J]. 长江蔬菜, 2010(14): 103-105.

