饱和CO2对亚心形扁藻生长及碳酸酐酶活性的影响
刘清钰 莫华 杨海波

摘要[目的]研究饱和CO2对亚心形扁藻生长及细胞内、外碳酸酐酶活性的影响。[方法]在每个光周期的光照阶段开始时通入CO2至饱和,在每个光周期的黑暗阶段结束时取样测定亚心形扁藻细胞的生物量、叶绿素含量及碳酸酐酶比活性。[结果]与未通入CO2的对照组相比,通入CO2至饱和时亚心形扁藻的适应期缩短,进入生长期后生物量增加明显,至培养结束时的生物量、叶绿素a和叶绿素b含量、细胞内外碳酸酐酶、总碳酸酐酶比活性分别是对照组的1.19、1.75、1.66、1.32、1.26、1.43倍。[结论]在培养体系中通入CO2至饱和时,亚心形扁藻通过提高细胞内、外碳酸酐酶的活性来保持高光合作用效率,促进自身生长繁殖。
关键词CO2 ;亚心形扁藻;生长;碳酸酐酶
中图分类号S963.21文献标识码A文章编号0517-6611(2017)31-0061-04
Abstract[Objective] To study the effects of saturated CO2 on the growth of Platymonus subcordiformis and the activities of intracellular and extracellular carbonic anhydrases. [Method] CO2 was bubbled to saturate at the beginning of light phase of every light cycle, and then, the biomass, the chlorophyll content and the carbonic anhydrase specific activity of P.subcordiformis were determined at the end of dark phase of every light cycle. [Result] Compared with the control group without bubbling CO2, the lag phase of growth shortened, and the biomass increased obviously during the fast growing period in the medium with bubbling CO2. meanwhile, the biomass of P. subcordiformis, the contents of chlorophyll a and b, and the activities of intracellular, extracellular and total carbonic anhydrases were 1.19, 1.75, 1.66, 1.32, 1.26 and 1.43 times of those in the medium without bubbling CO2, respectively. [Conclusion]When the medium was saturated by CO2, P.subcordiformis kept high photosynthetic efficiency to grow fast by increasing the activities of intracellular and extracellular carbonic anhydrases.
Key wordsCarbon dioxide;Platymonus subcordiformis;Growth;Carbonic anhydrase
化石燃料的大量使用不仅导致能源资源日渐枯竭,而且产生的大量温室气体导致全球气候变暖、生态环境恶化,在我国,这种影响尤其严重。由于CO2占整个大气温室效应气体排放的 68%以上,对温室效应贡献最大,因此,控制和降低CO2排放成为应对全球气候变暖的重要举措,是当前世界各国政府、企业界、学术界关注的焦点之一[1-2]。
海洋微藻光合效率高、生长速度快、环境适应性强,直接利用光合作用捕捉和固定CO2形成自身有机物质,同时产出高附加值的蛋白质、淀粉、糖类和脂类等[3-4]。碳酸酐酶是一种含Zn的金属酶,能够促进CO2和HCO3-的相互转化,在藻类光合固碳中起着重要作用。一方面,利用转运子通过质膜主动转运HCO-3进入胞液,再通过细胞内碳酸酐酶将HCO-3 转变为CO2;另一方面胞外碳酸酐酶催化细胞表面的HCO-3 转变为CO2, CO2以自由扩散方式进入细胞内。 经过胞内和胞外碳酸酐酶的共同作用保持细胞内有稳定浓度的CO2供给核酮糖-1,5-二磷酸羧化/氧化酶活性位点, 以维持较高的光合作用效率[5-6]。
亚心型扁藻(Platymonus subcordiformis)是一種海产光合自养浮游微藻,对环境适应性强,光合效率高,生长繁殖快,富含蛋白质、脂肪、碳水化合物等营养物质,是水产动物育苗过程中广泛使用的优质饵料,并在医药保健和生物能源等方面有广阔的开发潜力[7-8]。笔者研究饱和CO2对亚心形扁藻生长及细胞内外碳酸酐酶活性的影响,分析亚心形扁藻对饱和CO2的吸收转化能力,旨在为开发利用亚心形扁藻吸收转化工业排放CO2的研究提供理论参考。
1材料与方法
1.1藻种来源
亚心型扁藻(Platymonus subcordiformis)藻种为大连大学环境与化学工程学院海洋微藻课题组保存。
1.2仪器和药品
EL204电子天平[梅特勒-托利多仪器(上海)有限公司],80-2离心沉淀机(上海荣泰生化工程有限公司),LD5-2A台式离心机(北京医用离心机厂),UV-5200型紫外可见分光光度计(上海元析仪器有限公司),HH-S恒温水浴锅(江苏金坛市医疗仪器厂),pHS-2C型精密酸度计(上海精密科学仪器有限公司);无水乙醇(天津市科密欧化学试剂有限公司),巴比妥(上海笃玛生物科技有限公司),巴比妥钠(上海笃玛生物科技有限公司),均为分析纯。
1.3试验方法
1.3.1微藻培养及CO2通入。
取5 L锥形瓶,分别加入2 700 mL灭菌海水(pH=8.12)和900 mL处在对数生长期的亚心形扁藻藻液(A650 nm=0.117),按1‰的比例加入2.7 mL康维方营养液[9]。在25 ℃、2 100 lx、光暗比为12∶12的条件下培养亚心形扁藻。每天光照阶段开始和光照阶段结束时各摇瓶1次。
根据亨利定律,常压下25 ℃时CO2在纯水中的溶解度为1.24×10-5 mol/L,pH=5.67[10]。为研究海水中CO2溶解量最大(CO2饱和)时亚心形扁藻生长及碳酸酐酶活性的变化,以此为依据向亚心形扁藻培养体系中通入CO2至pH恒定不变时(说明CO2饱和,此时pH= 6.02),停止通入。
每天在光照阶段开始时向亚心形扁藻培养液中通入CO2至pH不变,开始12 h光照,再继续12 h黑暗,如此反复,直至培养结束。以未通CO2的灭菌海水中接种的亚心形扁藻培养液为对照。每组试验3个平行样。
1.3.2测定指标。
为探究饱和CO2对亚心形扁藻生长和碳酸酐酶活性的影响,自亚心形扁藻接种培养开始,每24 h取培养液500 mL,用于测定生物量、pH、细胞叶绿素含量和细胞内外的碳酸酐酶活性。
1.3.2.1生物量测定。预试验中,用UV-5200型紫外可见分光光度计进行全波长扫描,确定亚心形扁藻培养液的最大吸收波长为650 nm。试验过程中,从每次在所取的500 mL培养液中再取10 mL,于650 nm波长处测定藻液的吸光值,以间接反映亚心形扁藻细胞的生长情况,测完后的藻液放回所取的培养液中。平行测定3次。
1.3.2.2pH测定。从每次取的500 mL培养液中取出30 mL,用pHS-2C型精密酸度计测定pH,测完后的藻液仍放回所取的培养液中。平行3次。
1.3.2.3叶绿素含量的测定。参照文献[8]的方法,将测完吸光度和pH的培养液(495 mL),于3 000 r/min离心3 min,弃上清液,收集藻泥,分成3份,1份用于测定叶绿素,另外2份用于测定细胞内、外的碳酸酐酶活性。将用于测定叶绿素的藻泥用去离子水清洗3次后按质量平均分成3份,用85%乙醇提取叶绿素,并测定提取液在波长649和665 nm处的吸光度值。按照公式(1)、(2)分别计算待测液中叶绿素a和叶绿素b的质量浓度,按照公式(3)计算亚心形扁藻细胞内的叶绿素含量。
Ca=13.95A665 nm=6.88A649 nm (1)
Cb=24.96A649 nm=7.32A665 nm (2)
式中,Ca、Cb分别为待测液中叶绿素a、叶绿素b的质量浓度(mg/L);A649、A665 nm分别为649、665 nm处的吸光度值。
叶绿素含量(湿质量)(mg/g)=CV/m (3)
式中,C为叶绿素a或b的质量浓度(mg/L);V为提取液体积(L);m为湿藻泥质量(g)。
1.3.2.4细胞内、外碳酸酐酶活性的测定。参照wilbur-Anderson法[11]测定碳酸酐酶活性。取上述操作中获得的另外2份藻泥,首先将其中的1份按质量平均分成3份,立即悬浮于pH为8.30的12 mL巴比妥-巴比妥钠缓冲溶液中,再加入6 mL在4 ℃冷藏的CO2饱和蒸馏水,用pH计测量反应体系的pH变化,记录pH从8.30降至7.30时所需的时间t1,测定细胞外碳酸酐酶活性,取平均值。将另外一份藻泥冻融4次破碎细胞后,再按质量平均分成3份,重复胞外碳酸酐酶活性的测定过程,用于测定细胞总的碳酸酐酶活性,取平均值。按照下式计算碳酸酐酶活性:
碳酸酐酶活性(湿质量)(EU/g)=10×(t0/t1-1)/m (4)
式中,t0为反应体系未加藻泥时pH下降所用的时间(min);t1是反应体系中加入藻泥后pH下降所用的时间(min);m为湿藻泥质量(g)。
细胞内碳酸酐酶比活性(湿质量)(EU/g)=细胞总碳酸酐酶比活性-细胞外碳酸酐酶比活性 (5)
1.4数据统计与方法
试验数据用Excel进行统计及处理。在采用SPSS 18.0软件进行单因素方差分析的基础上进行Duncan多重比较,显著水平为P<0.05。
2结果与分析
2.1饱和CO2对亚心形扁藻培养液pH的影响
按照上述方法,在灭菌海水(pH=8.12)中接种处于对数生长期的亚心形扁藻藻液(A650 nm=0.117),从培养开始时计时每隔24 h測定培养液的pH,并与未通入CO2的对照组进行比较,结果见表1。
由表1可知,培养时间为0~144 h时,未通入CO2的亚心形扁藻培养液pH从8.12上升到8.26。自开始培养至24 h时pH有显著差异(P<0.05),自培养24 h至试验结束,pH差异不显著(P>0.05),说明亚心形扁藻通过光合作用吸收的CO2和通过呼吸作用释放的CO2基本处于平衡状态;而在每日光照开始时通入CO2至饱和(pH=6.02)的亚心形扁藻培养液,自培养开始至结束,pH逐日升高,每日差异显著(P<0.05),且显著低于未通入CO2的亚心形扁藻培养液(P<0.05)。通入CO2至饱和的亚心形扁藻培养液,pH自开始时的6.02上升至结束时的7.65,明显低于未通CO2的对照组(8.12~8.26)。这一方面说明通入CO2能降低培养体系的pH,另一方面说明适宜亚心形扁藻生长的pH范围较宽。
光合作用包括光反应和暗反应2个过程。亚心形扁藻通过光反应将光能转化为生物能(ATP)和还原势能(NADPH),再通过暗反应利用所转化的生物能(ATP)及还原势能(NADPH)将已被固定的CO2最终转化为碳水化合物等细胞组成物质[12]。
在开始培养的24 h内,亚心形扁藻的生物量增加少,光反应弱,转化的生物能和还原势能少,导致暗反应对CO2的利用少,进而培养液的pH上升缓慢。随着培养时间的延长,生物量明显增多,光反应增强,为暗反应提供了更多的生物能和还原势能,使其对CO2的利用增强,导致pH明显增加。
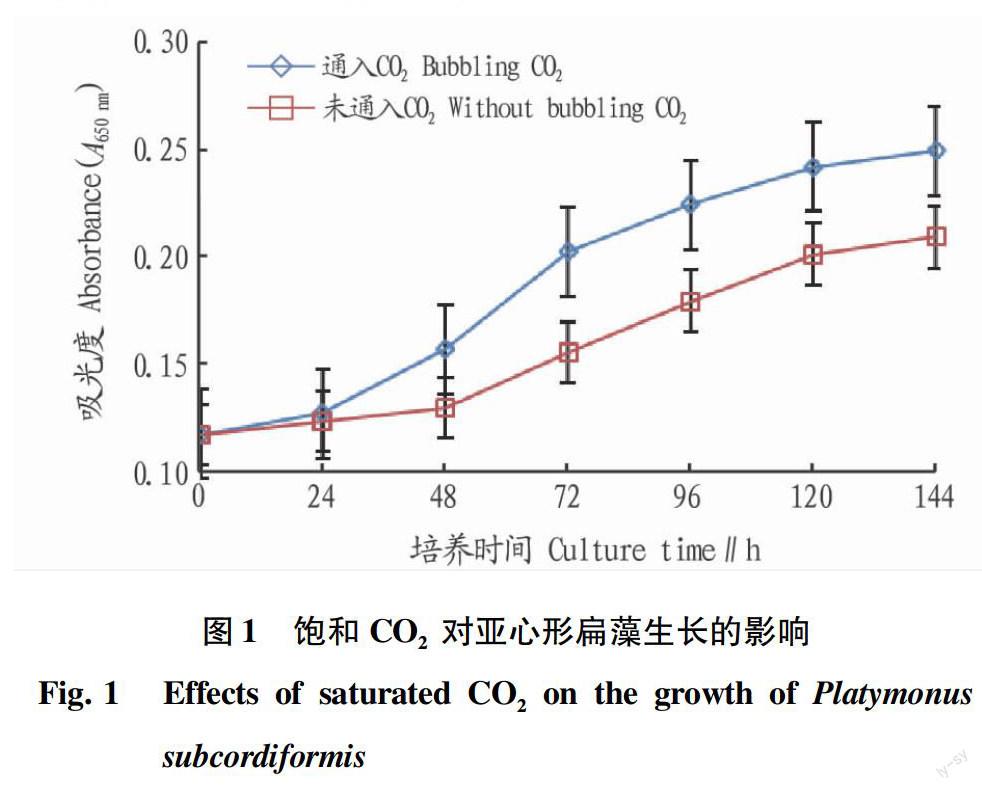
2.2饱和CO2对亚心形扁藻生长的影响
碳是构成细胞骨架的重要元素,该试验中所用的康维方营养盐中不含碳元素,亚心形扁藻通过光合作用的暗反应过程将外环境提供的CO2转化为碳水化合物等细胞组成物质,促进生长繁殖。以培养液吸光度A650 nm间接反映亚心形扁藻的生物量,图1显示了外加CO2至饱和时亚心形扁藻培养液的吸光度值随培养时间的变化趋势。由图1可见,通入饱和CO2的亚心形扁藻培养液,在开始培养的24 h内,培养液的吸光度值基本没变,表明亚心形扁藻细胞处于生长的适应期;从24~120 h,培养液的吸光度明显增加,表明亚心形扁藻进入快速生长期;在培养最后的24 h,培养液的吸光度变化不大,表明生长进入静止期。未通入CO2亚心形扁藻培养液的吸光度除适应期延长24 h外,其他2个时期基本呈现与通入CO2相似的变化趋势,但吸光度明显低于通入CO2的亚心形扁藻培养液。至培养结束时,通入饱和CO2的亚心形扁藻培养液的吸光度是未通入CO2的1.19倍。
表1和图1的结果显示,通入饱和CO2后,降低了亚心形扁藻培养液的pH,但经过24 h的适应期后,亚心形扁藻进入了快速生长期。这说明亚心形扁藻能够将培养液中的饱和CO2转化为细胞组分,促进细胞分裂和繁殖,增加生物量。
2.3饱和CO2对亚心形扁藻叶绿素含量的影响
叶绿素是光合作用的主要色素,在光合作用的光吸收中起着核心作用,其含量高低反映微藻光合作用能力的强弱。试验测定了亚心形扁藻中叶绿素含量随培养时间的变化,结果见图2。
亚心形扁藻中主要含有叶绿素a和叶绿素b[8]。从图2可见,随着培养时间的延长,通入CO2和未通入CO2的培养液中,亚心形扁藻细胞的叶绿素含量均逐渐增加,但通入CO2后的藻细胞中叶绿素a和叶绿素b含量分别显著高于未通入CO2的藻细胞中叶绿素a、b的含量,与图1中吸光度的变化趋势一致。这说明CO2的通入能够促进亚心形扁藻细胞产生更多的叶绿素进行光合作用转化CO2,加速细胞生长。培养结束时通入饱和CO2的亚心形扁藻叶绿素a和叶绿素b的含量分别是未通入CO2的1.75和1.66倍。
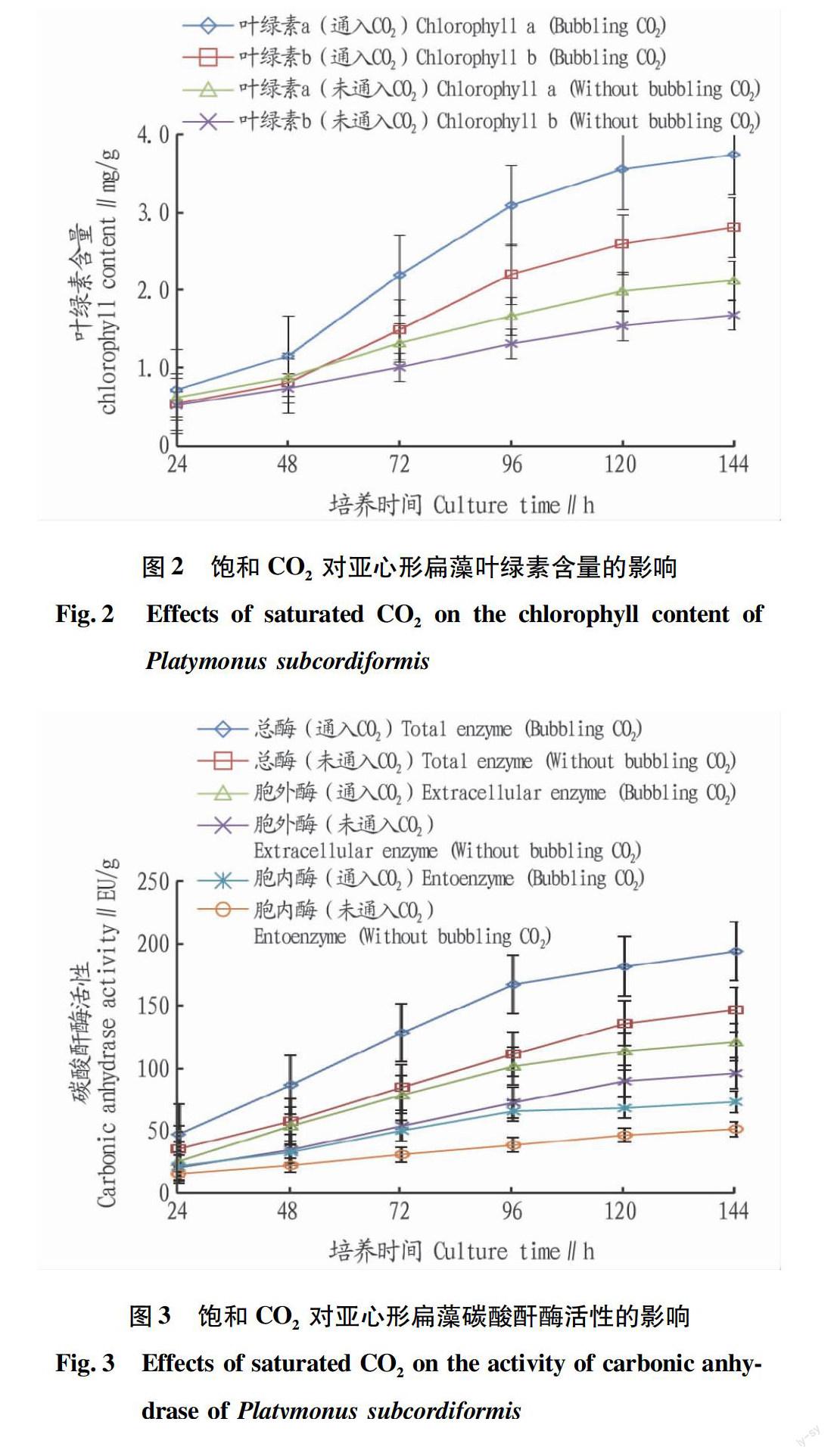
2.4饱和CO2对亚心形扁藻碳酸酐酶活性的影响
天然海水中CO2浓度低,为了适应海水中低CO2环境并保持较高的光合作用效率,大多数藻类通过自身的CO2浓缩机制提高所需CO2浓度[6]。碳酸酐酶作为CO2浓缩机制的关键酶之一,对藻类的光合作用起重要作用[5]。图3显示了通入饱和CO2对亚心形扁藻细胞内、外碳酸酐酶活性的影响。图3显示,除未通入CO2的胞内碳酸酐酶活性在培养过程中缓慢增加外,其他5组碳酸酐酶活性均随培养时间的延长呈逐渐增大至最后基本不变的趋势。但同一培养时间,通入饱和CO2后的细胞内、外及总碳酸酐酶活性均明显高于未通入CO2的相对应的碳酸酐酶活性,而且2个体系的胞外碳酸酐酶活性均高于各自的胞内碳酸酐酶活性。培养结束时通入饱和CO2的亚心形扁藻细胞内、外碳酸酐酶和总碳酸酐酶比活性分别是未通入CO2的1.32、1.26和1.43倍。
碳酸酐酶是一种诱导酶, 在 CO2和 HCO-3 相互转化的可逆反应中起催化作用。其活性受多种环境因素的调控, 如 CO2浓度、光照、pH、温度及金属元素等[5]。CO2通入水后,一部分是溶解性的CO2气体,一部分与水发生反应,生成HCO-3和H+,各组分所占的比例与溶液的pH有关[13]。通入CO2至饱和的亚心形扁藻培养液中,CO2供应量多,培养液的pH由初始的6.02上升至结束时的7.65。根据式(6)[13]可计算出HCO-3所占比例相应地由0.310上升至0953,与亚心形扁藻的生物量、叶绿素含量、细胞内外碳酸酐酶比活性的变化趋势一致。这说明当体系中CO2过量时,藻细胞将产生更多的细胞内、外碳酸酐酶调节HCO-3 和CO2之间的转化,以保证光合作用的正常进行,进而促進细胞生长和叶绿素的形成。
δHCO-3=[HCO-3]C总=[H+]Ka1[H+]2+[H+]Ka1+Ka1Ka2(6)
式中,Ka1=4.5×10-7,Ka2=4.7×10-11。
未通入CO2的对照组培养液的pH在8.12~8.26,此时HCO-3分布系数在0.98左右,少数HCO-3通过主动转运进入细胞内,再经过胞内碳酸酐酶转化为CO2,多数HCO-3 通过胞外碳酸酐酶转化为CO2进入细胞内,确保维持稳定的CO2流汇聚在核酮糖-1,5-二磷酸羧化酶/氧化酶的羧化位点。随着培养时间的延长,细胞生物量增多,更多的细胞内外碳酸酐酶参与到HCO-3 和CO2的转化中。
3讨论
CO2是微藻光合自养的唯一碳源,但不同微藻所需的最适CO2含量不同,改变其含量会影响微藻生长和细胞组分的变化[3]。 范金凤等[14]研究表明,二形栅藻(S.dimorphus)在CO2含量为10%时生长最好,此时pH为6.0~7.0。该试验中外加CO2至饱和时,培养液的pH从最初的6.02上升至培养结束时的7.65,与其pH接近,所得结果也一致,说明亚心形扁藻也能够利用高浓度的CO2。
该试验中通入CO2至饱和时亚心形扁藻生物量、叶绿素含量、细胞内外碳酸酐酶及总碳酸酐酶活性均比未通入CO2时的高,且胞外碳酸酐酶活性比胞内碳酸酐酶活性高,这与刘洪霞[15]和夏建荣等[16]的试验结果一致。在亚心形扁藻培养液中通入CO2至饱和时,部分CO2通过自由扩散方式进入细胞内,部分CO2与水发生质子交换反应生成HCO-3,其中少部分HCO-3 通过质膜主动转运进入胞液,在胞内碳酸酐酶的作用下转变为CO2,大部分HCO-3 通过胞外碳酸酐酶催化转变为CO2,CO2再通过扩散作用进入细胞内。姜加伟等[17]研究认为,HCO-3 通过主动转运以及碳酸酐酶参与CO2和HCO-3 的转化都需要消耗能量。该试验中通入饱和CO2时,亚心形扁藻细胞可能以消耗自身部分能量的方式调节细胞内、外碳酸酐酶活性以保证有稳定的CO2流供给核酮糖-1,5-二磷酸羧化/氧化酶的活性位点,维持光合作用的高效进行,进而促进生物量和叶绿素含量的增加。因为这些能量的“意外消耗”,导致生物量和叶绿素并未成倍数增长,这可能也是亚心形扁藻适应饱和CO2环境的一种机制。对此,是否可通过调整光照强度和光照时间来补偿这些“意外消耗”的能量以促进生物量和叶绿素含量的成倍增长,需要进一步探究。
火电厂烟道气中的CO2一般在10%~20%[18],若能进一步明确亚心形扁藻对饱和CO2的转化吸收能力,将烟道气应用到亚心型扁藻的培养工艺中,不仅会为降低大气中CO2的含量提供有效的利用途径,而且能产生更多的亚心形扁藻生物量用于水产饵料、医疗保健、食品添加剂、精细化工品和液体燃料等领域。
参考文献
[1]
周文广,阮榕生.微藻生物固碳技术进展和发展趋势[J].中国科学(化学),2014,44(1):63-78.
[2] 宋成军,董保成,赵立欣,等.纯二氧化碳条件下小球藻固定CO2[J]. 环境工程学报,2012,6(12):4566-4572.
[3] 李林,王帅,郑立.海洋微藻固碳及其培养技术的研究进展[J].海洋科学,2015,39(3):135-140.
[4] 张芯,张云明,何晨柳,等. 微藻生物能源的产业化进程及其在CO2减排中的应用进展[J].生物产业技术,2013(5):45-51.
[5] 黄瑾,夏建荣,邹定辉.微藻碳酸酐酶的特性及其环境调控[J].植物生理学通讯,2010,46(7):631-636.
[6] 夏建荣, 余锦兰.高浓度 CO2 对小新月菱形藻胞外碳酸酐酶活性和光合作用的影响[J].广州大学学报 (自然科学版),2009,8(3):49-53.
[7] 陈晓娟,廖利民,赵昕宇,等.一株饵料微藻:亚心形扁藻的生长条件优化[J].福建水产,2015,37(4):287-292.
[8] 白飞妮,穆富香,杨代宇,等.亚心形扁藻中叶绿素优化提取条件[J].安徽农业科学,2017,45(3): 108-110.
[9] 王友利.氮磷交互作用对两种海洋微藻生长及细胞组分的影响[D].大连:大连大学,2015:13-14.
[10] 戴树桂.环境化学[M].北京:高等教育出版社,2002:102-105.
[11] WILBUR K M,ANDERSON N G.Electronic and colorimetric determination of carbonic anhydrase[J]. Journal of biological chemistry, 1948, 176(1):147-154.
[12] 楊春虹.关于光合机器的合成生物学研究的几点思考[J].生物产业技术,2012(4):20-22.
[13] 李发美.分析化学[M].7版.北京:人民卫生出版社,2014:39-42.
[14] 范金凤,张姗姗,于红,等.CO2对产油微藻Scenedesmus dimorphus生长和产油特性的影响[J].太阳能学报,2013,34(6):1103-1108.
[15] 刘洪霞.环境因子对球等鞭金藻胞外碳酸酐酶活性的影响[D].烟台:烟台大学,2007.
[16] 夏建荣,黄瑾.氮、磷对小新月菱形藻无机碳利用与碳酸酐酶活性的影响[J].生态学报,2010,30(15):4085-4092.
[17] 姜加伟,程丽华,徐新华,等.微藻固定转化烟气 CO2强化技术[J].化工进展,2014,33(7):1884-1894.
[18] 刘玉环,阮榕生,孔庆学,等.利用市政废水和火电厂烟道气大规模培养高油微藻[J].生物加工过程,2008,6(3):29-33.

