油棕草茎点霉叶斑病病原菌的生物学特性和毒力测定
郑丽 张海鹏 林江 曾宪海 李静

摘 要 对油棕草茎点霉叶斑病病原菌(Phoma herbarum)的生物学特性展开研究。结果表明:菌丝最适生长温度为20~25 ℃,pH为6~8,在PDA和PSA培养基中菌丝生长最快,光照对菌丝生长无影响,菌丝可利用多种碳源、氮源,其中以葡萄糖、半乳糖、木糖和蔗糖为碳源生长最好,对氮源的利用效率以胰蛋白胨最高。采用菌丝生长速率法测定13种杀菌剂的室内毒力,结果表明:甲基硫菌灵和咪鲜胺毒力最强,EC50分别为1.100 7、1.451 6 mg/L,效果最好。
关键词 油棕叶斑病;草茎点霉;生物学特性;毒力测定
中图分类号 S184 文献标识码 A
Biological Characteristics and Toxic Test of the Pathogen
(Phoma herbarum)of Oil Palm Leaf Spot
in the Seedling Stage
ZHENG Li1,2,3, ZHANG Haipeng3, LIN Jiang4, ZENG Xianhai2,
LI Jing2, SHEN Huifang6, XIE Changping5 *, QIN Xindao2 *
1 Guangzhou Experimental Station, Chinese Academy of Tropical Agricultural Sciences, Guangzhou, Guangdong 510140, China
2 Opening Project Fund of Key Laboratory of Rubber Biology and Genetic Resource Utilization, Ministry of Agriculture / State
Key Laboratory Breeding Base of Cultivation & Physiology for Tropical Crops / Danzhou Investigation & Experiment Station
of Tropical Crops, Ministry of Agriculture, Danzhou, Hainan 571737, China
3 College of Agriculturure, South China Agricultural University, Guangzhou, Guangdong 510642, China
4 Institute of Tropical Agriculture and Forestry, Hainan University, Danzhou,Hainan 571737,China
5 College of Environment and Plant Protection, Hainan University, Haikou, Hainan 570228, China
6 Institute of Plant Protection, Guangdong Academy of Agricultural Sciences, Guangzhou, Guangdong 510640, China
Abstract The biological characteristics of Phoma herbarum, which causes leaf spot on oil palm, were as follows: the optimum temperature and pH for the mycelia growth was 20~25 ℃ and pH 6.0~8.0, respectively. The hyphae of this strain could grow faster on PDA and PSA medium and there was no significance between the light or dark treatments. Besides, the carbon sources such as glucose, galactose, xylose and sucrose were suitable for the hyphae to grow and tryptone could be efficiently used by this strain. Lastly, the inhibition activity of 13 common fungicides against P. herbarum was also carried out by the mycelium growth rate method. According to the tested results, the fungicides with best inhibition activity were 70% Thiophanate-Methyl(WP)and 45% Prochloraz(SC)and the values of their EC50 was1.100 7 and 1.451 6 mg/L, respectively.
Key words Leaf spot of Oil palm; Phoma herbarum; biological characteristics; screening of fungicides
doi 10.3969/j.issn.1000-2561.2017.09.019
油棕(Elaeis guineensis Jacq),別名油椰子、非洲油棕,是热带地区重要的木本油料作物,有“世界油王”之称[1]。油棕的综合利用价值比较高,除食用外,也可用于工业和生物柴油的生产[2-5]。因此,油棕作为“绿色能源”、“可再生能源”及高产油效率作物,具有很好的发展前景[6]。
随着种植面积的增大、植株的调运及试种引种新环境,植株面临新病害的威胁。据报道,为害油棕叶片的病原菌主要有拟盘多毛孢属(Pestalotiopsis spp.)、长蠕孢属(Helminthosporium spp.)、灵芝属(Genoderma spp.)等[7-12],新老叶皆可发病,初期出现黄色小斑点,扩大成椭圆形至圆形,后期叶片焦枯、死亡、脱落[7],而油棕苗期草茎点霉叶斑病症状特点为:在叶片上出现形状不规则和大小不一的褐色病斑,叶面稍有突起,叶背向下凹陷,随着病情发展,病斑相连扩大,中央呈灰白色,其上散生许多黑色小点,边缘暗褐色,外围常有黄色晕圈,严重影响叶片光合作用,降低景观效益,制约油棕的发展[13]。目前主要依靠化学药剂防治病害,代森锰锌、甲霜灵与福美双复配能有效控制叶斑病的流行[9]。杨炳安[14]报道,苯菌灵可防治叶斑病,且有很好的防治效果。据报道,杀虫剂通过减少虫子对油棕带来伤口来降低叶斑病病原菌侵入几率,从而达到较好控制叶斑病发生[15]。
本研究针对热科院广州实验站在广东江门地区引种试种引起的油棕苗期草茎点霉叶斑病病原菌的生物学特性和室内杀菌剂毒力进行基础数据库的研究,以期为下一步温室和大田防控实施提供理论指导。
1 材料与方法
1.1 材料
1.1.1 供试病原菌 本研究室前期分离、保存、鉴定的病原菌草茎点霉(Phoma herbarum),命名为YZ-8[16]。
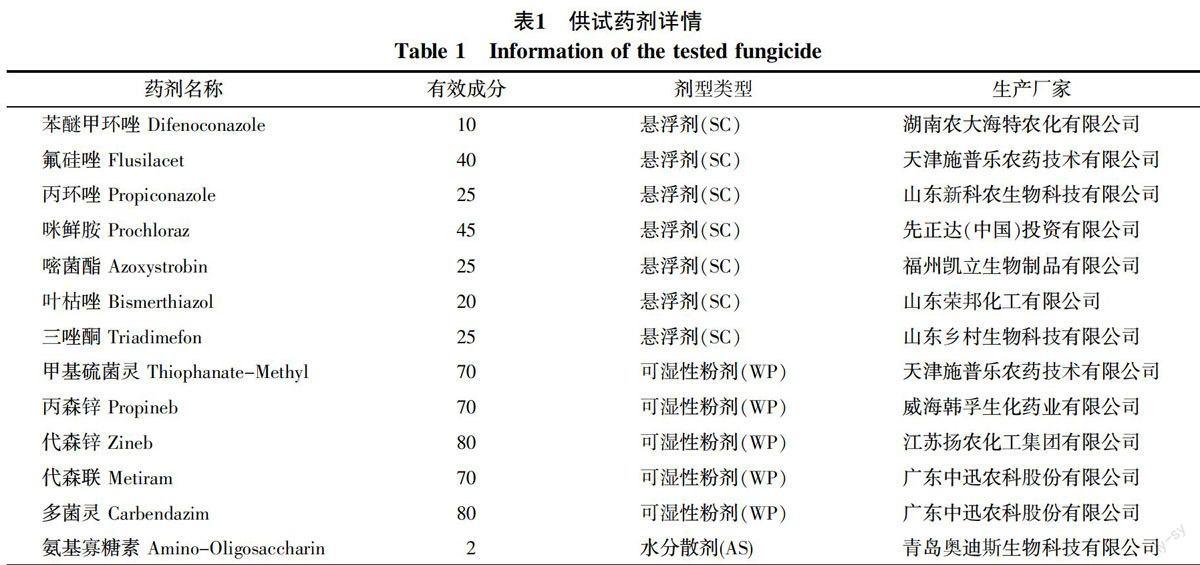
1.1.2 供试药剂 室内化学药剂毒力测定所用13种杀菌剂均为市售品种,具体信息如表1所示。
1.2 方法
1.2.1 病原菌生物学特性的测定 温度对病原菌菌丝生长的影响:将纯化的病原菌制成直径为5 mm的菌饼,接种于PDA培养基上,然后分别置于5、10、15、20、25、30和35 ℃的全光照(3 000 lx)恒温培养箱中培养,观察菌丝生长情况。7 d后用十字交叉法测量菌落直径,每处理5个重复,详情参考范昆等[17]方法。
pH值对病原菌菌丝生长的影响:用HCl和NaOH将PDA培养基的pH值分别调至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0。然后采用上述接种、测量的方法。每处理5个重复,详情参考范昆等[17]方法。
碳源对病原菌菌丝生长的影响:以Czapek培养基作为基础培养基,往其中加入等量乳糖、麦芽糖、半乳糖、木糖、葡萄糖、甘露糖和可溶性淀粉替换蔗糖配制不同碳源的培养基,以不添加碳源的Czapek培养基为对照。然后采用上述接种、测量的方法。每处理5个重复,请参考范昆等[17]方法。
氮源对病原菌菌丝生长的影响:将Czapek培养基作为基础培养基,分别往其中加入等量Ca(NO3)2、NaNO3、氯化铵、酵母浸膏、胰蛋白胨、尿素和KNO3替换蔗糖配制不同氮源培养基,以不添加氮源的Czapek培養基为对照,再采用上述接种、测量的方法。每处理5个重复,详情参考范昆等[17]方法。
光照对病原菌菌丝生长的影响:从菌落边缘取直径5 mm菌饼接种于PDA培养基上,然后分别置于24 h黑暗、24 h光照和光暗交替(12 h/12 h),培养7 d,测量菌落直径。每处理5个重复。
培养基类型对病原菌菌丝生长的影响:从纯化的菌落边缘取直径5 mm的菌饼分别接种到PDA培养基、PSA培养基、OMA培养基、CMA培养基、Czapek培养基、WA培养基和LB培养基平板上,在25 ℃恒温条件下培养7 d,测量菌落直径。每处理5个重复,详情参考范昆等[17]方法。
1.2.2 病原菌室内药剂筛选 采用菌丝生长速率法进行抑菌效果的测定[18]。具体方法为:每种供试药剂按一定量加入到一定体积的PDA培养基中,根据所选杀菌剂的推荐剂量配制7个浓度梯度的杀菌剂培养基平板,然后从纯化的菌落边缘打取直径0.5 cm(Ф0=0.5 cm)的菌饼分别接种,以不加杀菌剂的处理作为对照,25 ℃恒温培养7 d,测量菌落直径,并计算抑菌率。每个处理5个重复。
根据测量的数据计算出浓度对数(X)和抑制菌落生长百分率的几率值(Y),并利用最小二乘法求得各药剂对该病原菌的毒力回归方程(Y=a+bX)、半抑制浓度EC50值和相关系数(r2)。
1.3 数据分析
在Microsoft Excel中对菌丝菌落大小、药剂平板抑菌圈等数据处理,实验结果为平均值±SD。显著水平(p<0.05)由DPS version 7.05获得。
2 结果与分析
2.1 病原菌的生物学特性分析
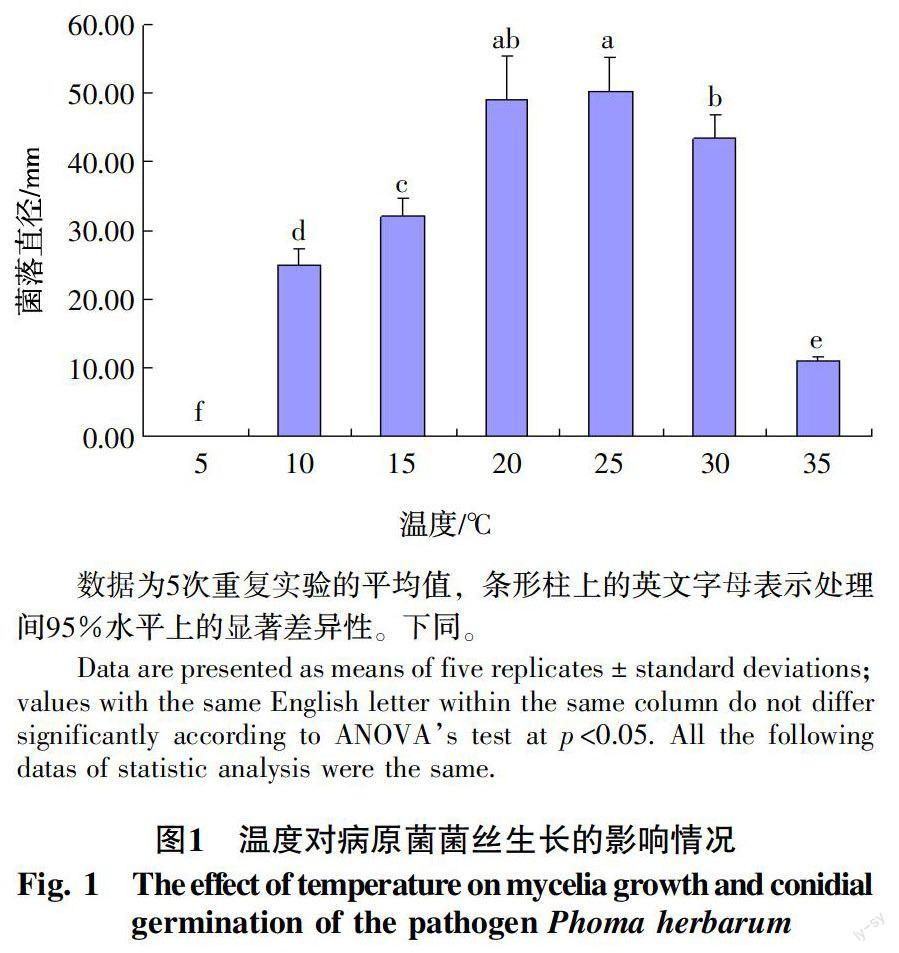
2.1.1 温度对病原菌菌丝生长的影响 试验结果表明,在10~35 ℃范围内,病原菌的菌丝均能生长,当温度低于5 ℃时,菌丝停止生长,在20~25 ℃生长最快,25 ℃时菌落直径达50.20 mm,表明该病原的菌落最适生长温度为20~25 ℃(图1)。
2.1.2 pH值对病原菌菌丝生长的影响 不同pH值对菌丝生长具有不同影响。病原菌在pH值为3~11的范围内,其菌丝生长存在差异。其中pH值在6~9范围内,菌丝生长较快,但差异不显著,连续培养7 d,菌落直径范围为52.90~55.70 mm;pH值为4或11的环境中,菌丝虽能正常生长,但生长很缓慢,且二者差异不显著;pH值为3时,菌丝生长最慢,直径仅为14.50 mm。其中,pH值为7和8时,最适合菌株生长,直径达到56.60 mm和55.70 mm。适宜菌丝生长的pH值范围5~10,最适pH值为6~8(图2)。
2.1.3 碳源对病原菌菌丝生长的影响 分别以单糖、双糖和多糖作为菌丝生长碳源,结果显示,病原菌仅在以乳糖为碳源的培养基上不生长,在其他碳源上,菌丝生长趋势均显著优于空白处理。其中,病原菌利用葡萄糖、半乳糖、木糖和蔗糖效率最高,四者间的利用率无显著差异(图3)。对可溶性淀粉、甘露醇及麦芽糖等碳源,其利用效果一般,其中以利用可溶性淀粉效率最差。由此可见,不同碳源对菌丝生长存在差异,病原菌对碳源的需求不严格。
2.1.4 氮源对病原菌菌丝生长的影响 数据显示,病原菌对不同氮源利用的差异显著,其中胰蛋白胨最适合菌丝生长,其次为硝酸钾。在硝酸钠和尿素中生长良好,硝酸钙和谷氨酸利用效率差异不显著,氯化铵的利用率最低(图4)。由此可见,不同氮源对菌丝生长影响不同。
2.1.5 光照对病原菌菌丝生长的影响 光照处理7 d后,发现不同光照条件对病原菌菌丝生长无显著差异(图5)。在连续黑暗、光暗交替或连续光照下,菌丝的菌落生长速率基本一致,菌落直径在51.00~52.40 mm之间。
2.1.6 培养基对病原菌菌丝生长的影响 结果表明,菌丝在PDA和PSA培养基中生长最好,但差異不显著,培养7 d菌落直径为55.00 mm;但在OMA和Czapek培养基上生长较慢(图6)。可见,不同培养基对菌丝生长存在影响。
2.2 毒力测定结果
13种杀菌剂的毒力测定结果显示,不同杀菌剂对病原物的毒力水平存在差异。其中甲基硫菌灵的毒力最强,EC50值为1.1007 mg/L,其次为咪酰胺,EC50值为1.4516 mg/L,而氨基寡糖素和多菌灵基本无效,EC50分别为442.089 1和 2 577.070 3 mg/L。EC50低于10 mg/L的药剂有甲基硫菌灵、咪酰胺、丙环唑、氟硅唑和苯醚甲环唑;EC50为10~100 mg/L的药剂有丙森锌、三唑酮、代森联、嘧菌酯和代森锌(表2)。
3 讨论
本文对油棕草茎点霉叶斑病病原菌(Phoma herbarum)进行生物学特性测定。结果表明,草茎点霉菌菌丝最适生长温度为20~25 ℃,最适pH值为6~8;在PDA和PSA培养基中菌丝生长最快;光照对菌丝生长无影响;其菌丝能利用多种碳源、氮源,其中以葡萄糖、半乳糖、木糖和蔗糖为碳源生长最好,对氮源的利用效率以胰蛋白胨最高,该结果与谷祖敏[19]的报道基本一致。由此推测,从不同寄主植物上分离到的草茎点霉菌,其生物学特性差异较小;这为后期实验病原菌选择最优化发酵培养方案提供较好的参考意义。
通过对草茎点霉病原菌的室内药剂筛选实验,发现甲基硫菌灵和咪鲜胺毒力最强,其EC50分别为1.100 7、1.451 6 mg/L,氨基寡糖素效果不明显。谷祖敏等[20]对草茎点霉也进行了化学药剂的筛选,结果表明,多菌灵、三唑铜和代森锰锌都具有较好的抑菌效果。本研究除了使用该3种杀菌剂以外还进行了其他10种药剂的筛选,并最终获得了抑制效果较好的杀菌剂,为农业生产实践提供理论指导,从而达到防治该病害,避免造成经济损失,为油棕推广和种植提供积极意义。
相关研究报道,草茎点霉菌既可以作为植物致病菌,危害作物有地黄[21]、鸭跖草[22]、豌豆[24]、针叶树种子[24]、Tedera等[25],也可以作为某些作物如田间鸭跖草的寄生菌而成为一种较好的生物源材料[22,26]。不同种类农药对草茎点霉菌丝抑制效果存在差异的原因可能在于靶标生物作用机理存在差异。本文只对菌丝的毒力效果进行评估,缺乏相关化学药剂对其分生孢子萌发的毒力测定实验。此外,本试验涉及的杀菌剂毒力测定试验均为室内平板试验,由于大田的生态环境和人为因素具有不确定性,因此筛选出药剂有待选择几种优化品种,进一步测定其田间防效。
参考文献
[1] 雷新涛, 曹红星, 冯美利, 等. 热带木本生物质能源树种——油棕[J]. 中国农业大学学报, 2012, 06: 185-190.
[2] Cao H X, Sun C X, Shao H B, et al. Effects of low temperature and drought on the physiological and growth changes in oil palm seedlings[J]. African Journal of Biotechnology, 2011, 10(14): 2 630-2 637.
[3] Corley R H V, Tinker P B. The oil palm (Fourth Edition)[M]. John Wiley & Sons, Hoboken, NJ, 2003.
[4] 林位夫. 中国油棕种植利用现状及其发展前景分析[M]. 北京: 中国农业科学技术出版社, 2010.
[5] 曹建华, 林位夫, 张以山. 中国油棕发展战略研究[M]. 北京: 中国农业出版社, 2011.
[6] 李 艳, 王必尊, 刘立云, 等. 我国油棕研究现状与发展对策[J]. 现代农业科技, 2007, 23: 216-217.
[7] 牛晓庆, 唐庆华, 余凤玉, 等. 油棕叶斑病的病原鉴定及其生物学特性[J]. 江西农业学报, 2011, 23(11): 103-105.
[8] Nakarin S, Kanaporn S, Jaturong K, et al. First report of leaf spot disease on oil palm caused by Pestalotiopsis theaein in Thailand[J]. J Gen Plant Pathol, 2013, 79: 277-279.
[9] Aderungboye F O, 张开明. 油棕的病害[J]. 世界热带农业信息, 1979( 4) : 31-42, 50.
[10] Chinchilla C, Escobar R. Red ring and other diseases of the oil palm in central and south America[J]. ASD Oil Palm, 2007, 30: 1-27.
[11] 巴 希, 吴恭恒. 油棕的虫害与动物害[J]. 世界热带农业信息, 1963(3): 64-66.
[12] 谢龙莲. 沙捞越州发现油棕新病害[J]. 世界热带农业信息, 2006(9): 23-24.
[13] 郑 丽, 杨兴玉, 谢昌平, 等. 油棕苗期叶斑病的病原鉴定及其生物学特性研究[J]. 中国油料作物学报, 2014(6): 794-801.
[14] 杨炳安. 国外油棕生产和科研近况[J]. 热带作物译丛, 1978(5): 25-27.
[15] J C Vessy, 黄循精. 用杀虫剂防治油棕叶病[J]. 热带作物译丛, 1984(2): 39-41.
[16] Zheng L, Xi P G., Si-tu J J, et al. First Report of Phoma herbarum Causing Leaf Spot of Oil Palm (Elaeis guineensis) in China[J]. Plant disease, 2017, 101(4): 629.
[17] 范 昆, 張雪丹, 余贤美, 等. 无花果炭疽病菌的生物学特性及8种杀菌剂对其抑制作用[J]. 植物病理学报, 2013, 43(01): 75-81.
[18] 徐汉虹. 植物化学保护实验指导(第二版)[M]. 北京: 中国农业出版社, 2012: 48-49.
[19] 谷祖敏. 草茎点霉作为生物除草剂防除鸭跖草的潜力及环境生物安全评价[D]. 沈阳: 沈阳农业大学, 2008, 26(9): 1-182.
[20] 谷祖敏, 纪明山, 杨春喜, 等. 草茎点霉SYAU-06菌株与农田常用农药的相容性研究[J]. 江西农业大学学报, 2009, 03: 504-507.
[21] 王 飞. 地黄轮纹病病原学及防治研究[D]. 武汉: 华中农业大学, 2012, 16-23.
[22] 谷祖敏, 纪明山, 魏松红, 等. 11株草茎点霉培养特征、 致病力及RAPD分析[J]. 吉林农业大学学报, 2010, 32(2): 140-144.
[23] Li Y P, You M P, Khan T N, et al. First Report of Phoma herbarum on Field Pea (Pisum sativum) in Australia[J]. Plant Disease, 2011, 95(12): 1 590.
[24] James R L. Characteristics of Phoma herbarum isolates from diseased forest tree seedlings[J]. USDA Forest Service, Northern Region, 1985(7): 22.
[25] Real D, Oldham C M, Nelson M N, et al. First Report of Phoma herbarum on Tedera (Bituminaria bituminosa var. albomarginata) in Australia[J]. Crop and Pasture Science, 2014, 65(7): 1 114-1 119.
[26] Aveskamp M M, De Gruyter J, Crous P W. Biology and recent developments in the systematics of Phoma, a complex genus of major quarantine significance[J]. Fungal Diversity, 2008, 31: 1-18.

