7个木薯细菌性萎蔫病菌致病性相关突变体的鉴定及插入位点基因的分子分析
时涛 蔡吉苗 李超萍 陈奕鹏 李博勋 黄贵修


摘 要 由地毯草黄单胞木薯萎蔫致病变种(Xanthomonas axonopodis pv.manihotis)侵染引起的细菌性萎蔫病是世界范围内木薯种植中的重要病害,也是为害中国木薯最严重的病害。目前,国内外有关该病病原菌致病分子机理方面的研究还很少,制约了相关防控工作的开展。本项目组在前期构建国内菌株XamGX11的转化子库的基础上,开展了7个致病相关突变体的分子鉴定、表型变异评价、插入位点侧翼序列的分离和相关基因的分子分析等研究,发现氨基转移酶、葡萄糖-果糖氧化还原酶等基因可能参与病原菌的致病过程。
关键词 木薯细菌性萎蔫病菌;突变体;基因分析
中图分类号 S533.24 文献标识码 A
Identification and Molecular Analysis of Integration Flanking Genes
from Seven Xanthomonas axonopodis pv. manihotis
Pathogenicity-related Mutants
SHI Tao, CAI Jimiao, LI Chaoping, CHEN Yipeng, LI Boxun, HUANG Guixiu*
Environment and Plant Protection Institute, CATAS / Key Laboratory of Integrated Pest Management on Tropical Crops, Ministry of Agriculture / Hainan Key Laboratory for Monitoring and Control of Tropical Agricultural Pests, Haikou, Hainan, 571101, China
Abstract Cassava bacterial blight caused by Xanthomonas axonopodis pv. manihotis is one kind of important disease worldwide, and it is the most serious disease in the cassava plantations of China too. A few reports were focused on the molecular pathogenic mechanism of X. axonopodis pv. manihotis in the world. As a result, the prevention and control work related of cassava bacterial blight was seriously affected. The transposon library of X. axonopodis pv. manihotis strain XamGX11 was constructed, and 7 mutants were screened. The identification, variation evaluation of physiology and biochemistry characteristics, separation of flanking sequences and molecular analysis of related genes of these mutants were finished. All the results showed the aminotransferase, glucose-fructose oxidoreductase and some other genes may play an important role in the infection process of X. axonopodis pv. manihotis.
Key words Xanthomonas axonopodis pv. manihotis; mutants; gene analysis
doi 10.3969/j.issn.1000-2561.2017.09.018
木薯(Manihot esculenta Crantz)為大戟科(Euphorbiaceae)木薯属灌木状多年生作物,是和马铃薯、甘薯并称的三大薯类作物之一。木薯具有高产、高淀粉、耐旱耐贫瘠等优点,起源于热带美洲地区,后传入非洲和亚洲,目前种植范围遍及100多个国家和地区[1]。1820年前后,木薯自东南亚传入中国,目前在广西、海南、广东、江西等地区普遍种植,近年来栽培面积一直在40万hm2左右,已形成比较成熟的木薯产业链[2],产量不能自给,是世界上最大的进口国[3],每年约80%的鲜薯及干片需要进口。
由地毯草黄单胞木薯萎蔫致病变种(Xanthomonas axonopodis pv. manihotis,Xam)引起的细菌性萎蔫病,也称细菌性枯萎病,是一种世界性病害,广泛发生于亚洲、非洲和美洲的木薯产区[4-6]。项目组前期调查表明,该病在广西、海南、广东、江西等地普遍发生,主栽品种均不具抗性,是为害中国木薯最严重的病害[7-8]。有关Xam的致病机理,国内外研究还很少。国外完成了67个菌株的基因组序列测定,并证明TALE1基因和致病性相关[9-11]。中国热带农业科学院也完成了菌株XamGX11的基因组测序并证明hrpG基因和致病性相关[12]。在前期利用EZ::TN转座体构建病原菌转化子库的基础上[13],本研究开展了7个致病相关突变体的分子鉴定、表型变异评价及相关基因的分子分析等方面研究,以期为后续研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 木薯品种、供试菌株和培养基 木薯品种‘新选048,由中国热带农业科学院热带作物品种与资源研究所提供,中国热带农业科学院环境与植物保护研究所已证明其感细菌性萎蔫病[8]。木薯细菌性萎蔫病菌菌株XamGX11及各转化子由中国热带农业科学院环境与植物保护研究所提供。菌株培养选用YPG、NA、M210、NYGB等培养基,配方参见方中达主编的《植病研究方法》[14]。
1.1.2 生物试剂、引物、菌株 DNA片段胶回收试剂盒和pMD18-T载体购买自宝生物工程(大连)有限公司;Taq酶、dNTPs和大肠杆菌Top10感受态细胞购买自天根生化科技(北京)有限公司;引物TMK1(5′-CCTCTTCCGACCATCAAGCA-3′)、TKM2(5′-ACTCACCGAGGCAGTTCCAT-3′)、SP1(5′-GA
TAGATTGTCGCACCTGATTG-3′)、SP2(5′-ACTCA
CCGAGGCAGTTCCAT-3′)、SP3(5′- GCAATGTAA
CATCAGAGATTTTGAG-3′)、SPF1(5′-ATCAGATC
ACGCATCTTCCC-3′)、SPF2(5′-ACCTACAACAAA
GCTCTCATCAACC-3′)、SPF3(5′-AGATGTGTATA
AGAGACAG-3′)、AD5[5′-AG(A/T)GNAG(A/T)AN
CA(A/T)AGG-3′]、AD6[5′-CA(A/T)CGICNGAIA(G/C)GAA-3′]和AD8[5′-(G/C)TTGNTA(G/C)TNCT
NTGC-3′]由北京六合华大基因科技股份有限公司合成。其它试剂均为国产分析纯。
1.2 方法
1.2.1 突变体鉴定 各突变体的致病力和遗传稳定性评价、PCR鉴定和southern杂交分析等参照陈江莎等[13]的方法进行。
1.2.2 突变体的表型变异评价 菌落生长速率测定参照时涛等[14]的方法进行。突变体的游动性,胞外多糖分泌、纤维素酶分泌、淀粉酶活性、生物膜形成能力等参照黄贵修[15]、许景升[16]等的方法进行评价,分别重复3次,相关数据采用SAS9.0软件进行差异显著性分析[17]。
1.2.3 突变体侧翼序列的分离及相关基因的分子分析
参照陈江莎等[13]的方法进行。
2 结果与分析
2.1 7个突变体鉴定
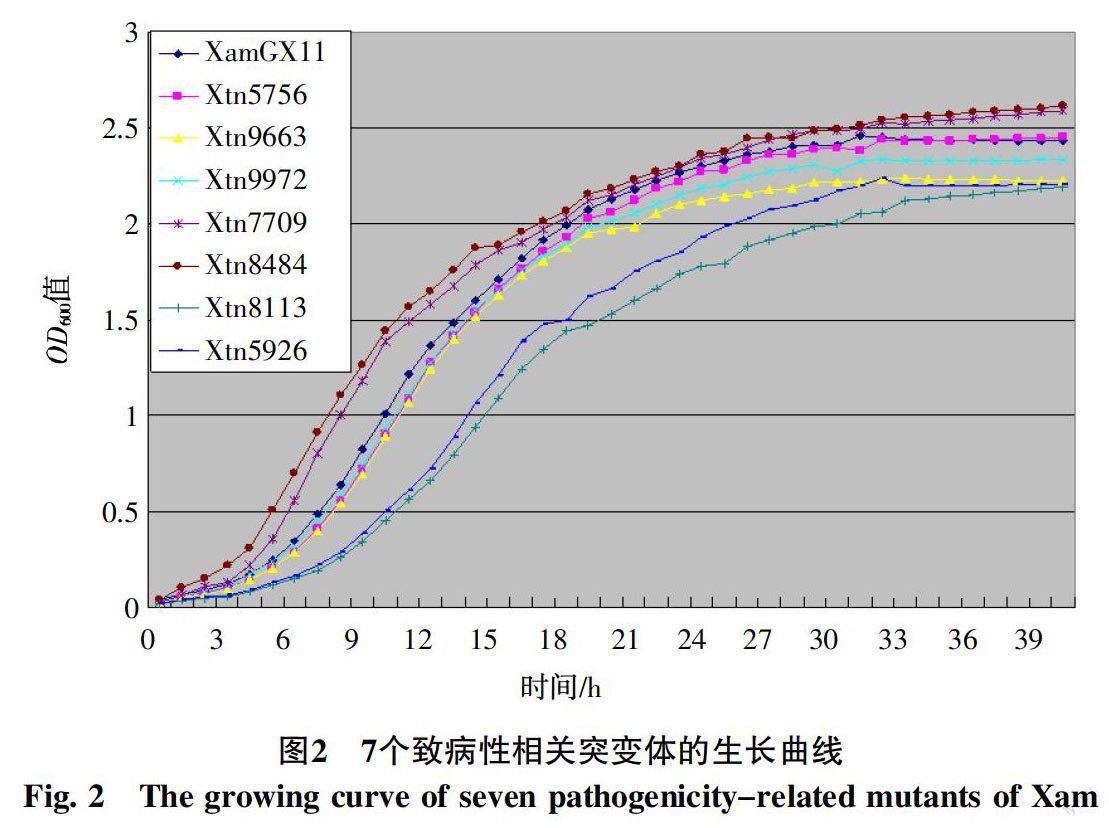
2.1.1 7个突变体的筛选及致病力评价 在前期构建病原菌转化子库的基础上,随机选取960个转化子,采用剪叶法评价各转化子致病力变异情况。结果表明,野生型菌株XamGX11接种7 d后,叶片上形成大片水浸状、边缘枯黄色病斑,Xtn5756、Xtn9663、Xtn9972、Xtn7709等4个突变体形成面积较小的病斑,而Xtn8484、Xtn8113、Xtn5926等3个突变体不能形成水浸状病斑,表明这7个突变体的致病力均严重减弱(图1、2)。
2.1.2 7个突变体的分子鉴定 提取各突变体的基因组DNA后,根据外源插入片段所携带的卡那霉素抗性基因编码区序列设计引物对TMK1和TMK2,进行PCR扩增,结果7个突变体均获得大小约0.5 kb的扩增产物,而野生型菌株XamGX11无任何扩增产物。随机选取Xtn5756、Xtn9663、Xtn8484、Xtn8113等4个突变体的扩增产物,回收、克隆测序后,比对发现所获序列和外源插入片段卡那霉素抗性基因编码区完全一致。
用外源片段上无切点的EcoRⅠ对各突变体基因组DNA进行酶切处理,以前述引物对TMK1和TMK2扩增突变体Xtn5756所获产物为探针,进行杂交处理,结果7个突变体均只有一条杂交条带,而XamGX11无任何条带(图3),分析各突变体均为单位点插入。
2.1.3 7个突变体的遗传稳定性评价 7个突变体在YGP平板上培养2 d后,均能形成和野生型一致的淡黄色、粘稠状菌落。各突变體在不含卡那霉素的YGP平板上转接20次后,接种到含有50 μg/mL卡那霉素的YGP平板上后正常生长,而野生型菌株XamGX11不能在含卡那霉素的平板上生长,表明转化子所携带的外源片段能够稳定遗传。
2.2 7个突变体的表型变异评价
2.2.1 7个突变体的生长速度评价 制作了各突变体的生长曲线,结果表明突变体Xtn8113和Xtn5926进入对数生长期时间显著晚于野生型菌株XamGX11,表明这2个突变体的生长速度下降。Xtn7709和Xtn8484早于XamGX11进入对数生长期,表明其生长速度显著提高,其他3个突变体的生长曲线基本和XamGX11一致,表明其生长速度和野生型无差异。
2.2.2 7个突变体的游动性评价 测量了各突变体在含0.3%、0.6%和0.9%琼脂的半固体NA培养基平板上形成的菌落直径,统计分析结果表明仅有Xtn7709菌落显著变小,表明其游动性显著降低。
2.2.3 7个突变体的生化特性评价 在NYGB培养基中分别加入2%脱脂奶粉、0.5%羧甲基纤维素和0.1%可溶性淀粉,接种各突变体以评价其胞外蛋白酶、纤维素酶分泌和淀粉酶活性。Xtn5756、Xtn9663和Xtn5926在3种检测平板上形成和XamGX11类似的反应圈,表明这3种酶活性和XamGX11一致。Xtn9972的纤维素酶和淀粉酶活性下降,而Xtn8484的纤维素酶活性下降。Xtn7709的蛋白酶和纤维素酶活性下降,而Xtn8113的淀粉酶和纤维素酶活性严重下降(表1、2)。
2.2.4 7个突变体的胞外多糖分泌和生物膜形成能力评价 在M210液体培养基中培养各个突变体,菌液离心取上清并用乙醇处理后对所获多糖进行称重,发现Xtn5926分泌的多糖显著减少,表明其分泌胞外多糖能力下降。各突变体菌液用结晶紫染色、PBS润洗和无水乙醇洗脱后,测量 OD490值发现Xtn8484生物膜形成能力提高,而Xtn9663和Xtn8113的形成能力减弱(表3)。
2.3 7個突变体的侧翼序列分离和目的基因分子分析
2.3.1 7个突变体的侧翼序列分离 以各突变体基因组DNA为模版,分别用简并引物和嵌套引物配对进行Tail-PCR扩增。Xtn5756、Xtn9663和Xtn7709等3个突变体用左边界嵌套引物和简并引物AD8配对获得了扩增产物,克隆、测序比对后得到长度在487~505 nt之间的侧翼序列。Xtn9972和Xtn5926用右边界嵌套引物和AD8配对获得了长度分别为441和731 nt的侧翼序列,AD6分别和左右边界嵌套引物配对获得了Xtn8484和Xtn8113的侧翼序列,长度分别为679和1138 nt(表4)。
2.3.2 7个突变体的目的基因预测和功能分析
将各突变体侧翼序列片段和菌株XamGX11基因组比对后,确认外源片段的插入位点,发现Xtn7709、Xtn8113和Xtn5926的插入位点位于Scaffold1,其它4个分别位于Scaffold2、Scaffold3、Scaffold15和Scaffold16。提取插入位点上下游各约3.0 kb序列后进行目的基因预测,7个预测基因编码区长度在597~1794 nt之间,其中Xtn9663、Xtn9972和Xtn8484的外源片段插入预测基因编码区的5′端,Xtn5756、Xtn7709和Xtn5926的外源片段插入预测基因编码区的3′端,而Xtn8113插入目的预测基因编码区上游0.1 kb。Xtn5756、Xtn9663、Xtn9972、Xtn7709和Xtn5926等突变体预测基因的蛋白产物分别和黄单胞类病原细菌的氨基转移酶、乙酰鸟氨酸氨甲酰转移酶、克拉维胺合成酶、钾转运ATP酶A亚基、蛋白酶和葡萄糖-果糖氧化还原酶等预测基因有较高的同源性,分析其分别参与相关的代谢过程,外源片段的插入破坏了目的基因的功能而导致致病力下降。突变体Xtn8484的预测基因编码产物和辣椒疮痂病菌IV型系统成员蛋白酶TraF同源性较高,该基因缺失后可能影响了蛋白质等生物大分子的转运,因此对侵染过程造成了不利影响。Xtn5926预测基因的编码蛋白产物和地毯草黄单胞柑橘致病变种保守基因有很高的同源性,但其功能未知。各突变体测序片段扩增所用引物对、插入位点及分析结果见表4。
3 讨论
本研究对所获的7个致病相关突变体开展了相关研究,发现外源片段均为单位点插入,除致病力减弱外,分别在生长速度、游动性、胞外蛋白酶、纤维素酶分泌、淀粉酶、胞外多糖和生物膜形成能力等方面存在着变异情况。各突变体侧翼序列的分离和目的基因的预测结果表明氨基转移酶、乙酰鸟氨酸氨甲酰转移酶、克拉维胺合成酶等蛋白参与Xam与木薯之间的互作反应,功能受影响后产生表型的变异和致病力减弱现象。
通常认为,胞外酶在植物病原细菌的致病过程中发挥重要作用。岑贞陆等[18]研究发现胞外淀粉酶在Xam病菌的致病反应中起重要作用,其活性和叶片上病斑面积密切相关。本研究发现和野生型菌株XamGX11相比,突变体Xtn9972的淀粉酶活性下降并形成较小的病斑,而Xtn8113的活性严重下降并且不能形成病斑,这一点和岑贞陆等的研究结果是一致的,分析克拉维胺合成酶和葡萄糖-果糖氧化还原酶可能参与Xam病菌的淀粉酶合成和分泌反应。胞外多糖的合成能力和植物病原细菌的致病力之间是正相关的[19]。胞外多糖(EPS)是黄单胞病原菌的重要毒力因子,水稻白叶枯病菌缺失EPS合成必须的gumM基因后,失去合成EPS的能力,同时毒性丧失[20]。Xtn5926的预测基因和黄单胞类病原菌的一个保守预测蛋白具较高的同源性,分析该类蛋白可能参与黄单胞病菌的EPS合成,被破坏后降低了致病力。
革兰氏阴性细菌的Ⅳ型分泌系统能够介导DNA的水平转移以及蛋白质等大分子物质的转移,参与致病过程。Xtn8484的预测基因和辣椒疮痂病菌IV型分泌系统的蛋白酶TraF具有较高的同源性,分析该基因功能的丧失可能影响了该分泌系统的功能,从而降低了病原菌的致病力。
利用外源片段在病原菌染色体上的随机插入,构建转化子库,从中筛选出致病力变异突变体,以插入片段为标记进行目的基因的功能研究,是病原菌致病相关基因克隆的常用技术。蔡志英等[21]、裴月令等[22]、黄贵修等[15]分别采用T-DNA插入技术构建了橡胶树胶孢炭疽病菌、西瓜枯萎病菌和水稻白叶枯病菌的转化子库并筛选到一批变异突变体。曾申艳等[23]、韦珂等[24]在筛选出致病力变异突变体的基础上,开展了相关基因的功能鉴定工作。本研究同样在前期研究基础上开展了相关突变体的鉴定和插入位点基因的分析研究,后续将进行各个预测基因的缺失和互补等方面研究,进一步验证其功能。
参考文献
[1] 贾晶霞, 李雷霞. 世界及中国木薯生产概况[J]. 农业工程, 2015, 5(5): 124-126.
[2] 陈丽珍, 叶剑秋. 我国木薯加工业的发展现状与展望[J]. 园艺与种苗, 2011, 3: 87-90.
[3] 盘 欢. 亚洲11国木薯生产概况[J]. 广西热带农业, 2009, 5: 29-31.
[4] Lozano J C, Booth R H. Disease of cassava(Manihot esculenta Crantz)[J]. Pans, 1974, 20: 30-54.
[5] Wydra K. The concept of resistance, tolerance and latency in bacterial diseases: examples from cassava and cowpea[J]. Beitr Zu¨ chtungsforschung BAZ, 2002, 8(3): 36-43.
[6] Zinsou V, Wydra K, Ahohuendo B, et al. Genotype environment interactions in symptom development and yield of cassava genotypes in reaction to cassava bacterial blight[J]. Eur J Plant Pathol, 2004, 1(11): 217-233.
[7] 李超萍, 时 涛, 刘先宝, 等. 国内木薯病害普查及细菌性枯萎病安全性评估[J]. 热带作物学报, 2011, 32(1): 116-121.
[8] 卢 昕, 李超萍, 时 涛, 等. 国内603 份木薯种质对细菌性枯萎病抗性评价[J]. 热带农业科学, 2013, 33(4): 67-70, 90.
[9] Bart R, Cohn M, Kassen A, et al. High-throughput genomic sequencing of cassava bacterial blight strains identifies conserved effectors to target for durable resistance[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(28): E1972-9.doi: 10.1073/pnas.1208003109.
[10] Arrieta-Ortiz M L, Rodríguez-R L M, Pérez-Quintero A, et al. Genomic survey of pathogenicity determinants and VNTR markers in the cassava bacterial pathogen Xanthomonas axonopodis pv. manihotis strain CIO151[J]. Plos One, 2013, 8(11): e79704. doi: 10.1371/journal.pone.007 9704.
[11] Bolot S, Munoz Bodnar A, Cunnac S, et al. Draft genome sequence of the Xanthomonas cassavae type strain CFBP 4642[J]. Genome, 2013, 1(4): pii: e00679-13. doi: 10.1128/genomeA.00679-13.
[12] 时 涛, 李超萍, 刘先宝, 等. 木薯细菌性枯萎病菌hrpG基因突变体的获得[J]. 热带作物学报, 2013, 34(6): 1 139-1 143.
[13] 陈江莎, 祝天成, 李超萍, 等. 木薯细菌性枯萎病菌转化子库的构建及其质量评价[J]. 热带作物学报, 2013, 34(6): 1 144-1 148.
[14] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998.
[15] 黄贵修. 水稻白叶枯病菌致病性功能基因组学分析[D]. 海口: 华南热带农业大学, 2005.
[16] 许景升. 水稻白叶枯病菌Tdrxoo/GacAxoo调控系统的鉴定及其对运动性和毒性调控功能的分析[D]. 北京: 中国农业科学院, 2007.
[17] 阮 敬. SAS统计分析从入门到精通[M]. 北京: 人民邮电出版社, 2009.
[18] 岑贞陆, 何 忠, 郑露露. 木薯细菌性枯萎病病原菌致病力差异及其胞外酶活性的研究[J]. 西南农业学报, 2011, 24(6): 2 213-2 216.
[19] Tang J L, Feng J X, Li Q Q. Cloning and charaeterization of the rpfC gene of Xanthomonas oryzae pv. oryzae: involvement in exopolysaccharide production and virulence to rice[J]. Molecular Plant-microbe Interaetions, 1996, 9(7): 664-666.
[20] Rajeshwari R, Sonti R V. Stationary-phase variation due to transposition of novrl insertion elements in Xanthomonas oryzae pv. oryzae[J]. J Bacteriol, 2000, 182: 4 797-4 802.
[21] 蔡志英, 林春花, 時 涛, 等. 橡胶树胶孢炭疽菌T-DNA插入突变体库构建及其致病缺陷转化子筛选[J]. 微生物学通报, 2012, 39(6): 773-780.
[22] 裴月令, 曾凡云, 彭 军, 等. 西瓜枯萎病菌T-DNA插入转化子库的构建及其质量评价[J]. 热带作物学报, 2015, 36(1): 76-82.
[23] 曾申艳, 胡 军, 黄贵修, 等. 水稻黄单胞菌hrp基因簇中致病相关基因hpaB的鉴定[J]. 微生物学报, 2007, 47(3): 402-406.
[24] 韦 珂.野油菜黄单胞菌野油菜致病变种致病相关基因的鉴定及分析[D]. 杭州: 浙江大学, 2005.

