咖啡驼孢锈菌PCR分子检测体系的建立
汪涵 吴伟怀 李乐 梁艳琼 郑金龙 习金根 李锐 黄兴 贺春萍 易克贤

摘 要 由专性寄生菌咖啡驼孢锈菌(Hemileia vastatrix)引起的咖啡叶锈病是影响咖啡产量的最主要真菌病害。为建立对咖啡驼孢锈菌具有高特异性、高灵敏度、易操作的分子检测方法,本研究通过对咖啡驼孢锈菌DNA核糖体转录间隔区ITS1~ITS4序列与其近源序列作多重比较分析,获得其特异性区域,并于特异性区域设计了1对引物Hv-ITS-F/R。利用该特异引物,通过对咖啡驼孢锈菌、咖啡褐斑病菌、咖啡锈菌重寄生菌、咖啡炭疽菌以及不同属其它真菌基因组DNA进行PCR扩增。结果表明:此引物对仅能从咖啡驼孢锈菌基因组DNA中扩增出396 bp的特异条带,对其它相似或相近的病原真菌则无扩增条带。灵敏度试验结果表明,在DNA水平上检测浓度可达10 pg/μL。进一步通过田间健康与疑似发病植株的检测,结果呈现出很好的应用前景。由此表明,该引物对能有效地用于咖啡组织中驼孢锈菌的检测。
关键词 咖啡;咖啡驼孢锈菌;PCR;分子检测
中图分类号 S763.15 文献标识码 A
PCR-Based Molecular Detection of Hemileia vastatrix in Coffee
WANG Han1,2, WU Weihuai2 *, LI Le1,2, LIANG Yanqiong2, ZHENG Jinlong2, XI Jingen2,
LI Rui2, HUANG Xing2, HE Chunping2 **, YI Kexian2 **
1 Institute of Tropical Agriculture and Forestry, Hainan University, Haikou, Hainan 570228, China
2 Environment and Plant Protection Institute, CATAS / Ministry of Agriculture Key Laboratory for Monitoring and Control of
Tropical Agricultural and Forest Invasive Alien Pests / Hainan Key Laboratory for Detection and Control of Tropical
Agricultural Pests, Haikou, Hainan 571101, China
Abstract Coffee leaf rust caused by Hemileia vastatrix(Hv)is a serious fungal disease worldwide and has great impact on the coffee yield. The study was aimed to establish a rapid molecular biological way with the characteristics of high specificity, high sensitivity and simple operation. Based on the differences in the sequences of internal transcribed spacer(ITS)ITS1-ITS4 sequence ribosomal DNA of Hv in coffee and the other closely related species, a pair of primers Hv-ITS-F/R were designed and a PCR assay was developed in the study. Among Hv, Cerospora coffeicola Berket Cooke, hyperparasites fungi of Hv, Colletotrichum kahawae and other fungi species, only a single PCR band of 396 bp amplified with DNA extracted from all isolates of Hv in coffee, while other tested isolates had no corresponding band. The detection sensitivity could be up to 10 pg/μL genomic DNA. The results showed that the PCR-based assay would provide a rapid and sensitive method for the Hv detection of naturally infected coffee tissues. It has great significance for early diagnosis and rapid detection of coffee leaf rust early disease, and the research of growth and decline trends and disease epidemiology.
Key words Coffee; Hemileia vastatrix; polymerase chain reaction; molecular detection
doi 10.3969/j.issn.1000-2561.2017.09.016
咖啡為茜草科(Rubiaceae)咖啡属(Coffea)植物[1]。 在世界三大饮料作物(咖啡、茶叶、可可)中,咖啡其产量、产值及消费量均居三大饮料作物之首。咖啡叶锈病是阿拉比卡小粒种咖啡(Coffea arabica L.)的主要病害。该病由咖啡驼孢锈菌(Hemileia vastatrix Berkeley and Broome)引起,主要侵染咖啡叶片,浆果和枝条很少发病,感病后叶背面最初出现浅黄色水渍状小病斑,周围有浅绿色晕圈[2]。当病斑扩大到5~8 cm时叶背就产生橙黄色粉状孢子堆。随着病斑的扩大,几个病斑连成不规则形的大斑,晚期干枯成深褐色病斑在叶片两面均可见。严重时,引起咖啡树大量落叶枝条干枯,甚至整株枯死[3-4]。在适宜的气候条件下,该病可以导致叶片损失最多可达50%,浆果损失可高达70%[5]。
咖啡叶锈病对咖啡种植产业的危害长达几个世纪,该病曾对斯里兰卡及拉丁美洲等多个咖啡种植国家,造成了严重的经济损失[6]。近年中国咖啡产业发展迅速,仅2014年,中国咖啡种植面积达到12.86万hm2,年产咖啡豆12.6万t,均创历史新高[7]。据报道,在2015年,仅云南小粒咖啡的种植面积已经超过12万hm2,产量达13万t[8]。然而,由咖啡驼孢锈菌(Hemileia vastatrix)引起的咖啡叶锈病是中国咖啡种植区最严重的毁灭性病害,严重威胁咖啡产业稳定、健康和安全发展[9]。
目前,咖啡叶锈病的防治措施主要有:选育抗病品种、生物防治、化学防治以及农业生态调控4个方面[5]。及早发现病害,因地制宜采取相应的防控措施,才能有效地对病害进行控制,减少产量损失。迄今为止,对咖啡驼孢锈菌的检测与鉴定,仍然依赖常规的形态学并结合传统鉴别寄主技术的方法。该方法比较费时费力,且不同环境条件下的病菌形态会有所差异,需要具备专业的分类学知识以及丰富的经验[10-12]。同时,咖啡驼孢锈菌是一种专性寄生真菌,传统诊断方法具有一定的局限性,以致于难以满足快速、高通量鉴定与检测的实际需求。近年来随着核酸分子生物学技术的发展,以PCR技术为代表的分子检测方法得到迅速发展和应用。因其具有快速、准确、灵敏且不需要进行病原菌的分离培养等特点,已广泛应用于植物病害检测及其病原菌鉴定等方面。然而,在咖啡驼孢锈菌检测方面,国内还未见有简单易行、准确灵敏的分子检测技术。因此,有必要研发一种能快速、准确检测咖啡驼孢锈菌的现代分子诊断与检测技术,为咖啡驼孢锈菌的潜伏、发生、群体分布及消长动态提供可靠的监测手段,进而为有效预测与防治咖啡锈病提供科学依据。
1 材料与方法
1.1 材料
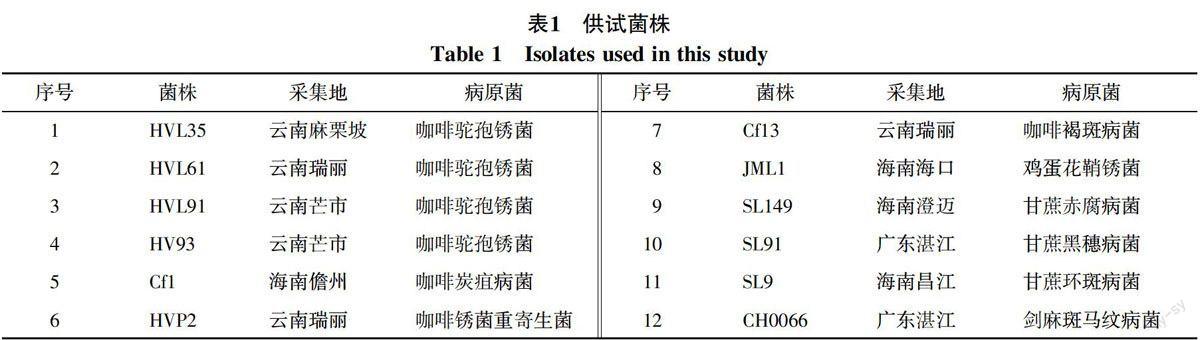
1.1.1 菌株 本实验所采用来自云南咖啡产区的咖啡驼孢锈菌(Hemileia vastatrix)菌株,并以咖啡炭疽菌(Colletotrichum kahawae),咖啡锈菌重寄生菌(hyperparasites of Hv),咖啡褐斑病菌(Cerospora coffeicola Berket Cooke),鸡蛋花鞘锈菌(Coleosporium plumierae)、甘蔗赤腐病菌(Colletotrichum falcatum)、甘蔗黑穗病菌(Ustilago scitaminea)、甘蔗环斑病菌(Leptosphaeria sacchari Breda)、以及剑麻斑马纹病菌(Phytophthora nicotianae Breda)等作为对照菌株。供试菌株具体寄主及来源详见表1。所有菌株均保存在中国热带农业科学院环境与植物保护研究所。
1.1.2 试剂 EcoTaq PCR SuperMix购于全式金生物技术(北京)有限公司,西班牙琼脂糖(Biowest regular agarose G-10),10×rTaq Buffer,2.5 mmol/L dNTPs,rTaq DNAPolymerase均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 总DNA提取 采集已严重发锈病的咖啡与鸡蛋花叶片,于实验室利用接种刀片刮下其表面附着的夏孢子堆。所得的孢子堆,直接采用真菌DNA提取试剂盒(E.Z.N.ATM Fungal DNA kit,Omega公司,美国)提取上述菌株的DNA。其它菌株则采用菌丝体通过上述试剂盒进行DNA提取。
1.2.2 咖啡锈菌ITS序列片段克隆與测序 利用真菌ITS序列扩增通用引物ITS1/ITS4[13]。采用20 μL反应体系:14.2 μL ddH2O,2 μL 10×rTaq Buffer,1.6 μL 2.5 mmol/L dNTPs,0.2 μL rTaq DNA Polymerase(5 U/μL),各0.5 μL 10 μmol/L的上下通用引物,1 μL DNA模板(30 ng/μL)。PCR反应在Mastercycler gradient Mastercycler PCR扩增仪上进行,扩增程序为:94 ℃预变性3 min,94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸5 min,15 ℃保存。扩增结束后取8 μL PCR产物于1%琼脂糖凝胶电泳,检测其扩增结果。随后将4 μL PCR扩增产物与T1载体连接后,转化到大肠杆菌培养,采用OMEGA的质粒DNA提取试剂盒,提取构建的重组质粒DNA,委托英潍捷基(上海)贸易有限公司广州实验室测序。
1.2.3 引物设计 将克隆获得的驼孢锈菌序列通过软件DNAStar5.0将两端拼接在一起,并进行手动检查和确认。于NCBI网站(http://www.ncbi.nlm.nih.gov/)进行同源性搜索。下载同源性较高的其它菌株序列利用DNAStar5.0进一步进行多重比较,于咖啡驼孢锈菌特异性区域参考引物设计原理设计引物。
1.2.4 特异性检测 利用上述设计的特异引物,并以表1中各菌株DNA为模板并以灭菌ddH2O为阴性对照,进行PCR扩增,以检测其特异性。PCR反应体系及反应程序同1.2.2,PCR产物用1.0%的琼脂糖凝胶电泳检测。
1.2.5 灵敏度检测 将咖啡驼孢锈菌菌株基因组DNA浓度调整为10 ng/μL,按10的数量级逐步向下稀释至10-5 ng/μL作为模板,进行PCR扩增。PCR反应体系和反应程序与1.2.2相同,PCR产物用1.0%的琼脂糖凝胶电泳检测。
1.2.6 田间疑似发病咖啡植株检测 采集田间发病典型症状或疑似症状的咖啡植株叶叶片,切取病健交界处组织块,采用CTAB法[14]提取发病组织和健康植株叶片的基因组DNA,以此基因组DNA(30 ng/μL)为模板,并以咖啡锈病菌重组质粒DNA为阳性对照,利用所设计的引物对进行PCR扩增实验。PCR反应体系及反应程序同1.2.2,PCR产物用1.0%的琼脂糖凝胶电泳检测。
2 结果与分析
2.1 特异引物的设计
咖啡驼孢锈菌Hv ITS基因序列与其它高同源性ITS序列的多重比对结果表明,咖啡驼孢锈菌ITS2区域为特异性区域(图1),最终于该区域合适位点设计了1对咖啡驼孢锈菌的特异性引物Hv-ITS-F/R。具体而言,上游正向引物Hv-ITS-F序列:5′-GGTACACCTGTTTGAGAGTATG-3′;下游反向引物Hv-ITS-R序列:5′-CAAAATATGTCATA
CCTCTCATTCT-3′,其包含引物序列在内的片段大小分别为396 bp。将设计的引物于NCBI网站中进行同源性搜索,结果无论是正向还是反向引物二者均仅与咖啡驼孢锈菌拥有100%的同源性。
2.2 引物特异性检测
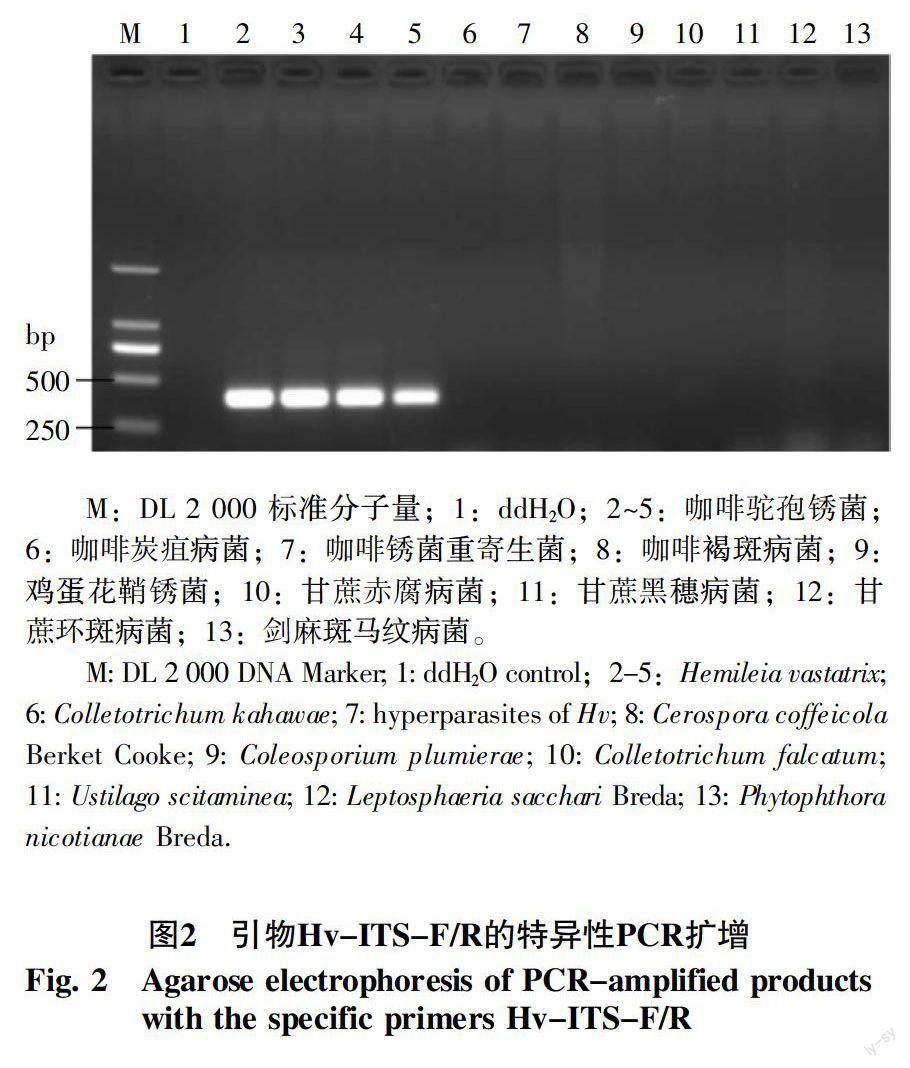
利用设计的特异性引物Hv-ITS-F/R对供试菌株(表1)的基因组DNA进行PCR扩增,以验证引物的特异性。试验结果与设计分析的相吻合,引物对Hv-ITS-F/R仅能从咖啡驼孢锈菌DNA中扩增出一条396 bp特异性条带,测序比对后与咖啡驼孢锈菌ITS片段序列完全一致,而从其它菌株中均扩增不到任何条带,表明引物对Hv-ITS-F/R可特异性地检测咖啡驼孢锈菌(图2)。
2.3 引物的灵敏性检测
利用引物对Hv-ITS-F/R,以1 μL各浓度梯度咖啡驼孢锈菌DNA为模板,进行常规PCR;如图3所示,当咖啡驼孢锈菌的DNA浓度大于或等于10 pg/μL时,利用引物对Hv-ITS-F/R可以特异性的扩增得到396 bp的DNA条带,但当浓度小于10 pg/μL后,则扩增不到条带,由此表明,该引物对可以检测到咖啡驼孢锈菌基因组DNA浓度≥10 pg/μL。
2.4 咖啡田间疑似发病植株检测
采用常规PCR对采集的咖啡植株进行检测,检测结果表明,以健康咖啡嫩叶基因组DNA为模板时,引物Hv-ITS-F/R检测不出任何条带;以发病咖啡植株基因组DNA为模板时,引物Hv-ITS-F/R能检测出清晰条带,即能稳定地扩增出一条分子量约为396 bp的特异条带(图4)。由此表明,该引物可以应用到咖啡驼孢锈菌检测中。
3 讨论
病原菌检测的传统方法需经过发病症状观察、分离病原菌、生物学性状测定以及回接至寄主等环节,这些方法虽能起到一定的鉴别作用,但耗时费力且受人为及环境因素的影响极大。随着分子生物学技术的发展,以PCR技术为基础的分子诊断学逐步解决了上述不足,并以其高效简便的优点被科研单位广泛使用。据不完全统计,中国应用PCR及其相关技术而检测的植物病害达50余种[15-16]。该技术已经在烟草、大豆、苜蓿疫霉菌(Pytophthora)[17-18],松干锈菌(Puccinia)[19],棉花黄萎病菌(Verticillium spp.)[20],梨轮纹病菌和炭疽病菌[21],甘蔗黑粉菌[22]等病原真菌鉴定、分类及系统发育等方面得到广泛地应用。其中,由于核糖体基因转录间隔区序列具有种间高度变异及种内稳定保守的特点,此区域常常被用来设计特异性引物对,进而用于病原真菌的鉴别与分类[11,23]。本研究通过对咖啡驼孢锈菌ITS序列进行比对分析,于咖啡驼孢锈菌ITS特异性区域,设计一对特异性引物,依此建立了一套省时、准确、快速、简便的PCR检测方法。利用该特异引物,通过对咖啡驼孢锈菌、咖啡褐斑病菌、咖啡重寄生菌、咖啡炭疽菌以及不同属其它菌基因组DNA进行PCR扩增。结果表明,此引物对只能從咖啡驼孢锈菌基因组DNA中扩增出约396 bp的特异条带,对其它相似或相近的病原真菌则无扩增条带。灵敏度试验结果表明,在DNA水平上检测浓度可达10 pg/μL。相比之下,与巢式PCR检测琯溪蜜柚黑斑病病原菌[24]等文献报导中的PCR灵敏度检测一致。
自然界中,咖啡驼孢锈菌的夏孢子侵入叶片并经过大约20 d后而致其发病[2]。通过本研究建立的咖啡锈菌快速分子检测技术可以缩短对咖啡驼孢锈菌的鉴定时间,灵敏、快速地鉴定出咖啡驼孢锈菌,克服了传统鉴定方法步骤繁琐、鉴定周期长等问题。本检测体系可以检测到侵染浓度≥10 pg/μL的咖啡驼孢锈菌基因组DNA,并且能在田间疑似症状的咖啡植株叶片基因组DNA检测出条带,可以满足一般的咖啡锈病病原菌预测及诊断,为咖啡驼孢锈菌的潜伏、发生、群体分布及消长动态提供可靠的监测手段,进而为病害的防控措施提供参考依据。值得注意的,本研究建立的咖啡驼孢锈菌普通PCR检测体系,仍然存在如灵敏度不够高,以及诊断过程中需要PCR扩增仪等仪器设备,以致于在基层条件不是很完善的情况下或者是需要更加精准度的情况下推广起来受到限制。由此可见,关于咖啡驼孢锈菌的早期检测体系,还需要进一步研究精度更高的咖啡驼孢锈菌巢式PCR检测体系,以及更适合基层,更加灵敏的LAMP检测体系,以满足不同层次的检测技术需求。这也是本课题即将开展的工作。
参考文献
[1] Bridson D, Verdcourt B. Flora of tropical East Africa: Rubiaceae (part 2)[M]. Publ Rotterdam: AA Balkema, 1988.
[2] Schieber E. Economic Impact of Coffee Rust in Latin America[J]. Annual Review of Phytopathology, 1972, 10(7): 491-510.
[3] Nyvall R F. The reporting of estimated plant disease losses[J]. Plant Disease, 1983, 67(12): 1 303-1 306.
[4] 丁丽芬, 马巾媛, 杜华波, 等. 思茅地区小粒咖啡锈病的发生与防治[J]. 中国农业信息月刊, 2014, (3S): 96-100.
[5] Daivasikamani S. Biological control of coffee leaf rust pathogen, Hemileia vastatrix Berkeley and Broome using Bacillus subtilis and Pseudomonas fluorescens[J]. Journal of Biopesticides, 2009, 2(1): 94-98.
[6] McCook S, Vandermeer J. The big rust and the red queen: long-term perspectives on coffee rust research[J]. Phytopathology, 2015, 105(9): 1 164-1 173.
[7] 刘树芳, 金桂梅, 杨艳鲜, 等. 云南咖啡主要病虫害及防治调查研究[J]. 热带农业科学, 2014, 34(5): 69-71.
[8] 王 莉. 我国咖啡生产及贸易发展状况[J]. 中国热带农业, 2009, (2): 22-24.
[9] 张洪波, 白学慧, 李锦红, 等. 云南咖啡抗锈品种抗锈性丧失原因及防治对策[J]. 热带农业工程, 2011, 35(4): 4-8.
[10] McCartney H A, Foster S J, Fraaije B A, et al. Molecular diagnostics for fungal plant pathogens[J]. Pest Management Science, 2003, 59(2): 129-142.
[11] 趙 杰. ITS序列分析及其在植物真菌病害分子检测中的应用[J]. 陕西农业科学, 2004, (4): 35-37.
[12] Silva M C, Várzea V, Guerra-Guimaraes L, et al. Coffee resistance to the main diseases: leaf rust and coffee berry disease[J]. Brazilian Journal of Plant Physiology, 2006, 18(1): 119-147.
[13] White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: PCR Protocols: A Guide to Methods and Applications[M]. New York, Academic Press, Inc, 1990: 315-322.
[14] 何月秋. 真菌菌丝体培养和提取DNA方法的改进[J]. 菌物学报, 2000, 19(3): 434-434.
[15] Iwen P C, Hinrichs S H, Rupp M E. Utilization of the internal transcribed spacer regions as molecular targets to detect and identify human fungal pathogens[J]. Medical Mycology, 2002, 40(1): 87-109.
[16] 杨 瑞. 苹果蠹蛾Cydia pomonella(L.)在中国的适生性研究[D].杨凌: 西北农林科技大学, 2008.
[17] 赵永强, 张成玲, 张 薇, 等. 烟草根黑腐病菌的PCR分子检测[J]. 植物病理学报, 2009, 39(1): 23-29.
[18] 张正光, 王源超, 郑小波, 等. 大豆疫霉和苜蓿疫霉rDNA ITS序列分析[J]. 菌物系统, 2003, 22(4): 542-548.
[19] 侯丽冰, 贺 伟, 刘小勇, 等.我国几种松干锈菌亲缘关系的ITS序列分析[J]. 北京林业大学学报, 2002, 24(5/6): 175-182.
[20] Nazar R N, Hu X, Schmidt J, et al. Potential use of PCR-amplified ribosomal intergenic sequences in the detection and differentiation of Verticillium wilt pathogens[J]. Physiological and Molecular Plant Pathology, 1991, 39(1): 1-11.
[21] 张 磊, 常有宏, 刘邮洲, 等. 梨轮纹病和炭疽病病原菌PCR检测[J]. 江苏农业学报, 2012, 28(2): 189-194.
[22] Chen LS, Liu CD, Tsay JG, et al. PCR-mediated detection of Sporisorium scitamineum in sugarcane based on the bE mating-type gene sequence[J]. Tropical Plant Pathology. 2015, 40(1): 65-69.
[23] Wang Y, Zhang W, Wang Y, et al. Rapid and sensitive detection of Phytophthora sojae in soil and infected soybeans by species-specific polymerase chain reaction assays[J]. Phytopathology, 2006, 96(12): 1 315-1 321.
[24] 郑域茹, 罗金水, 张汉荣, 等.巢式PCR检测琯溪蜜柚黑斑病病原菌[J]. 热带作物学报, 2013, 34(2): 358-361.

