叶酸荧光分光光度法测定Hg(Ⅱ)的研究
龙立平,周丽萍,孟 维,王姣亮,谢 丹(湖南城市学院 化学与环境工程学院,湖南 益阳 413000)
叶酸荧光分光光度法测定Hg(Ⅱ)的研究
龙立平,周丽萍,孟 维,王姣亮,谢 丹
(湖南城市学院 化学与环境工程学院,湖南 益阳 413000)
基于Hg(Ⅱ)对叶酸的内源性荧光的荧光熄灭作用,建立了测定微量Hg(Ⅱ)的荧光分析方法﹒选用pH为6.0的HAc-NaAc缓冲溶液,最大激发与发射波长分别为277.0 nm 和443.0 nm,叶酸浓度选用5.00×10-6mol/L,相对荧光强度与Hg(Ⅱ)浓度的对数呈良好的线性关系,测定Hg(Ⅱ)浓度的线性范围为(4.20×10-6-6.20×10-3)mol/L,检出限为1.30×10-7mol/L,相对标准偏差为1.38%(n=11),加标回收率为95.6%-99.7%﹒该法具有良好的选择性,可直接用于测定环境水样中的Hg(Ⅱ)含量﹒
荧光光度法;荧光熄灭;叶酸;Hg(Ⅱ)
汞是一种有毒金属,测定汞的方法有原子荧光分光光度法[1]、微波消解-原子吸收分光光度法[2]、ICP发射光谱法[3]、氢化物-原子荧光法[4]、冷原子吸收法[5]、分光光度法[6]等﹒分光光度法灵敏度低、线性范围窄;原子吸收法操作繁琐、分析费用高;而荧光光度法测定汞具有灵敏度高、选择性好和操作简便等优点[7]﹒常用测Hg(Ⅱ)的荧光试剂有西夫碱化合物[8]和对羟基苯甲醛缩邻氨基苯甲酸[9]等﹒但这些试剂有的制备困难,有的价格昂贵,有的涉及环境污染物.
叶酸作为一种水溶性B族维生素[10],在细胞分裂、生长过程中不可缺少.目前,文献报道的大多是运用各种方法来测定叶酸的含量.叶酸分子本身具有内源性荧光,还未见利用其荧光特性直接来进行分子或离子的测定.本实验发现,在水溶液中,Hg(Ⅱ)能与叶酸发生反应,形成不发荧光的配合物,而使叶酸荧光熄灭.选取最大激发/发射波长λex/λem=277.0 nm/443.0 nm 处,建立了Hg(Ⅱ)-叶酸体系测定微量Hg(Ⅱ)的荧光分析方法,直接用于实际样品中Hg(Ⅱ)的测定,结果满意.
1 实验部分
1.1 主要仪器和试剂
日立F-4600荧光分光光度计(日本日立公司);pHS-3C型精密pH计(上海第三分析仪器厂).
5.00×10-4mol/L叶酸(AR,成都市科龙化工试剂厂)标准储备溶液:准确称取叶酸0.0552 g于小烧杯中,加水溶解后过滤,转入250 mL容量瓶中,用水定容,摇匀.用时稀释至所需浓度.
0.10 mol/L 的Hg(Ⅱ)标准储备液:准确称取Hg(NO3)2(AR)8.115 8 g 于小烧杯中,加少量水溶解后转入250 mL容量瓶,用水定容,摇匀.
1.2 实验方法
准确移取1.00 mL 5.00×10-5mol/L的叶酸标准溶液于 10.00 mL比色管,然后加不同浓度Hg(Ⅱ),加入5.00 mL pH为6.0的NaAc-HAc缓冲溶液,用水定容至刻度;选择激发/发射夹缝宽为5.0 nm/5.0 nm,光电倍增电压PTM为700 V,用1 cm的石英比色皿盛入待测液,于最大激发/发射波长λex/λem==277.0 nm/443.0 nm 处测其荧光强度.所有实验均在(20±1) ℃下进行,其余无机或有机试剂均为分析纯,并未再经提纯和无荧光.实验用水为二次蒸馏水.
2 结果与讨论
2.1 荧光光谱
由于叶酸有较大的共轭结构(供体),Hg(Ⅱ)是强的电子受体,当供体-受体分子相互碰撞时形成电荷转移络合物[11].在宏观上将表现为荧光熄灭作用.选择最大激发/发射波长为 277.0 nm/443.0 nm,加入1.00 mL 5.00×10-5mol/L的叶酸,5.00 mL pH为6.0的NaAc-HAc缓冲溶液与不同浓度的Hg(Ⅱ)形成络合物后的荧光发射光谱如图1 所示.由图1 可知:在发射波长为443.0 nm处,Hg(Ⅱ)浓度的不断加大,对叶酸荧光强度的熄灭程度也在增加,这样从理论上测定Hg(Ⅱ)含量提供了可行性.
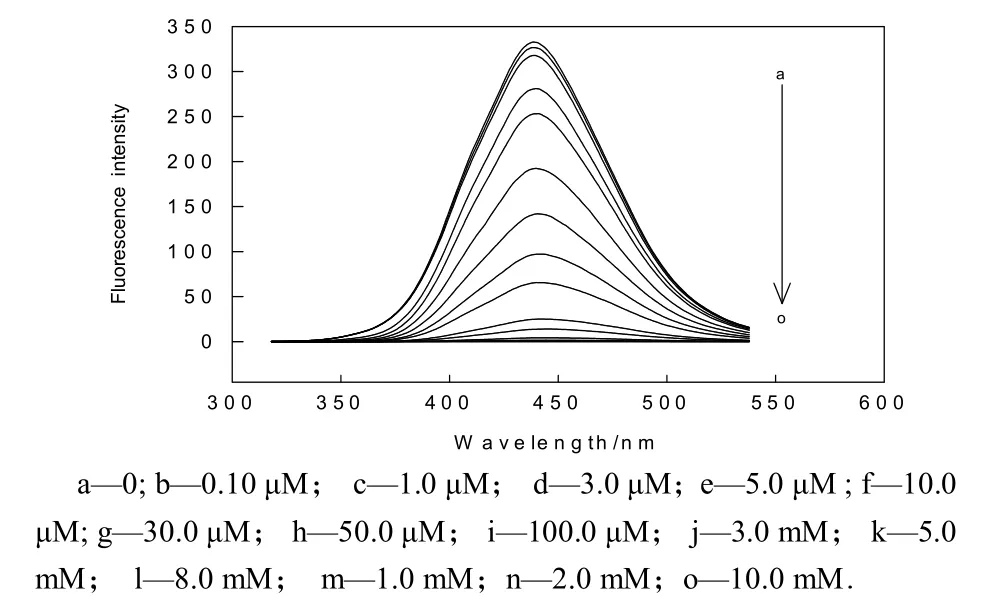
图1 叶酸与不同浓度的Hg(Ⅱ)反应达平衡时荧光光谱图
2.2 叶酸用量的选择
叶酸的用量影响测定 Hg(Ⅱ)的灵敏度大小及线性范围.取5.00×10-5mol/L浓度不同体积的叶酸液及pH为6.0的NaAc-HAc缓冲溶液5.00 mL,加水配成10.00 mL试剂,用作空白样品,测定其荧光强度F0;同样,5.00×10-5mol/L浓度不同体积的叶酸液再加1.00×10-4mol/L 的Hg(Ⅱ)溶液及pH 为6.0的NaAc-HAc缓冲溶液5.00 mL,加水配成10.00 mL试剂,测定其荧光强度F,得到相对荧光强度F0/F与叶酸浓度c的影响.结果如图2所示.
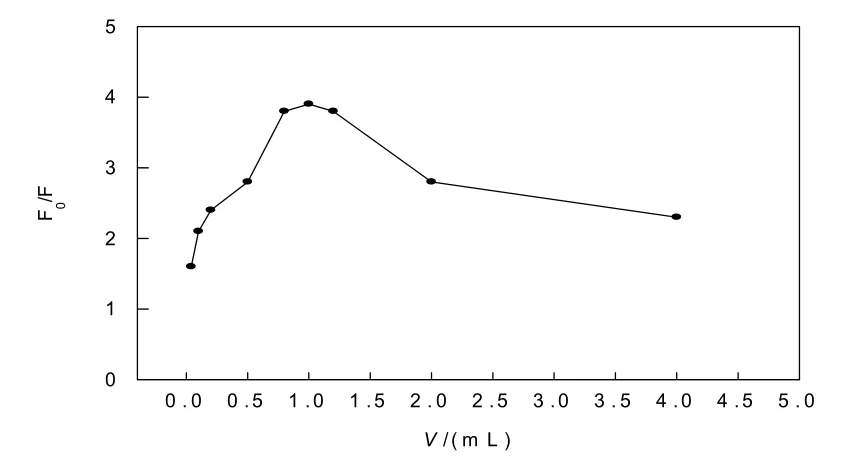
图2 叶酸的用量对测定Hg(Ⅱ)的荧光强度的影响
由图2可知,叶酸用量太小,反应可能完全,荧光响应值小,随着叶酸的加入量过大,相对荧光强度增加;至1.30 mL以后,可能由于内滤效应使荧光自猝灭,相对荧光强度又会减小.当5.00×10-5mol/L叶酸的用量为0.70~1.30 mL 时,相对荧光强度稳定且最大.因此,实验时选用叶酸最宜用量为1.00 mL的5.00×10-5mol/L.
2.3 pH的选择
考察了pH对叶酸测定Hg(Ⅱ)的影响作用.按1.2实验方法,取1.00 mL的5.00×10-5mol/L叶酸的标准储备溶液,并用1.0 mol/L的HCl溶液在1.0~7.0范围内调节溶液的pH,分别测定在叶酸不加和加Hg(Ⅱ)时的荧光强度F0和F,得到相对荧光强度F0/F,观察其F0/F与溶液pH的影响时发现在pH 6.0时为最大.后改用pH 6.0的NaAc-HAc缓冲溶液作为测试底液实验,所加的缓冲溶体积为5.0 mL时为最大,故实验选用5.00 mL pH 6.0的NaAc-HAc缓冲溶液作为测试底液.
2.4 测定Hg(Ⅱ)的原理
设Hg(Ⅱ)为A(aq)与叶酸为B(aq)作用形成组成比为m﹕n的络合物AmBn(aq),则Hg(Ⅱ)与叶酸之间具有平衡K为平衡常数即络合物的形成常数,按文献[12]方法处理得
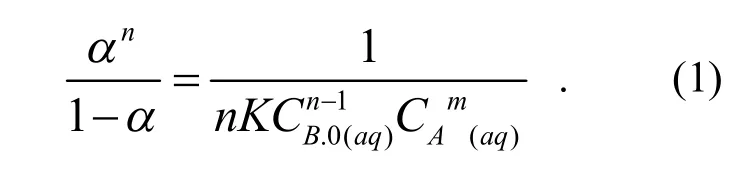
其中α是相对荧光响应值,可表示为
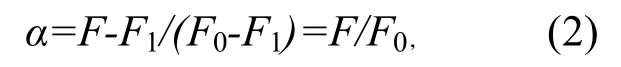
式中α=0 表示叶酸无络合,荧光强度F=F0;α= 1全部络合物,此时荧光强度F=F1= 0.
由式(1)、式(2)可知, 待测Hg(Ⅱ)浓度与α有确定函数关系,是本法测定Hg(Ⅱ)的定量依据.作F0/F—logc图,实验数据按公式(1)拟合进行绘图,其结果见图3.由图3可知:当m﹕n为1﹕2时(曲线c),实验点与理论拟合有很好的重合,所得平衡常数K=1.8×105,此曲线c可作为测定Hg(Ⅱ)含量的校准曲线.
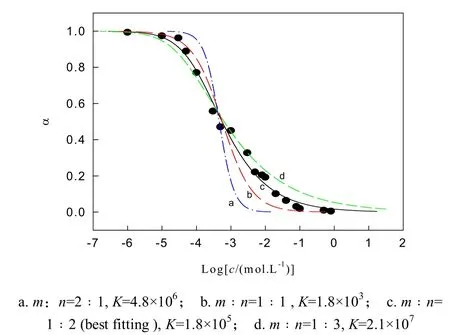
图3 实验数据点按式(2)进行拟合图
根据文献[13]处理方法,由0.05≤(1-α)≤0.95,来确定其动力学测定范围;同时根据3S0/K(S0为空白测定值的标准偏差,K为校准曲线的斜率)来确定检出限.对测定Hg(Ⅱ)的动力学范围为(4.20× 10-6-6.20×10-3) mol/L;对1.00×10-4mol/L的Hg(Ⅱ)平行测定11次,相对标准偏差为1.38%,计算出检出限为1.30×10-7mol/L.
2. 5 选择性实验
为考察一些常见干扰物质对叶酸测定Hg(Ⅱ)的影响,按荧光强度的相对误差≤±5%来进行干扰实验,选5.0×10-6mol/L和3.00×10-5mol/L Hg(Ⅱ)溶液作底液,分别加入其它离子进行测定.可允许的共存物质倍率为:30倍的Mg(II)、Al(Ⅲ);3倍的Pb (II)、Li (Ⅰ)、Ca(II)、Zn(Ⅱ)、Mn(Ⅱ);0.3倍的Cu(II)、Cr(Ⅺ)、Fe(Ⅲ);检测时需要用硫脲掩蔽Cu(Ⅱ),用连二亚硫酸钠掩蔽Cr(Ⅺ),用邻二氮菲掩蔽Fe(Ⅲ)等离子.
2.6 样品及回收率的测定
取蒸馏水 1.00 mL,加入 1.00 mL的5.00×10-5mol/L叶酸测定荧光强度F0;分别于上述水样中再加入1.00 mL的1.00×10-4mol/L 的Hg(Ⅱ),测定荧光强度F.按标准曲线定量,得该试样中Hg(Ⅱ)的浓度,其结果见表1,回收率为95.6%-99.7%.
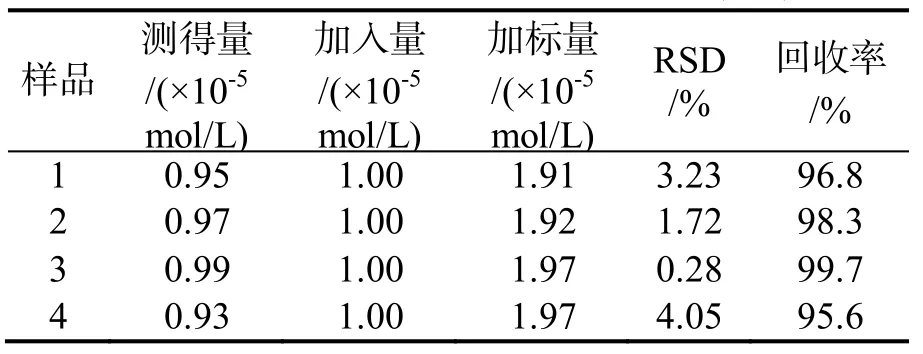
表1 样品及回收率的测定结果(n=5)
3 结论
[1]房宏伟, 时岚. 冷蒸汽-原子荧光光谱法测定水样中3种形态的汞[J].理化检验-化学分册, 2015, 51(5): 721-722.
[2]张泓, 吕维君, 茅建人, 等.微波消解--原子吸收分光光度法、原子荧光分光光度法测定土壤中的铜锌铅镉铬砷汞[J].中国卫生检验杂志, 2005, 15(7): 830-831.
[3]陈贺, 周慧兰.液液萃取-HPLC-ICPMS 联用技术测定水体中甲基汞[J].中国环境监测, 2015, 31(1): 109-112.
[4]袁爱萍, 唐艳霞, 黄玉龙, 等.氢化物-原子荧光方法测定精矿中痕量砷、汞的研究[J].理化检验-化学分册, 2006, 26(4): 1553-1556.
[5]朱利中, 陆军, 威文彬.冷原子吸收法测定痕量汞的研究[J].上海环境科学, 1993, 12(3): 25-27.
[6]赵保卫. 水样中痕量汞的分光光度法测定[J]. 干旱环境监测, 2000, 14(2): 67-71.
[7]刘欣, 黄汉国. 叶酸氧化物体系荧光测定铕[J].河北化工, 2004, 6(3): 62-64.
[8]胡乃梁, 陈燕, 杨家祥, 等.一种西夫碱化合物的合成及其在汞测定中的应用[J].安徽大学学报, 2008, 32(6): 65-68.
[9]李惠成, 仵博万, 张克钧, 等.对羟基苯甲醛缩邻氨基苯甲酸与汞的荧光猝灭反应及其应用[J].分析测试学报, 2010, 29(4): 415-417.
[10]刘慧娟, 李鹏, 张亚东, 等.叶酸与人血清白蛋白结合作用的光谱研究[J].光谱学与光谱分析, 2009, 29(7): 1915-1919.
[11]王柯敏.光化学传感器理论与方法[M].长沙: 湖南教育出版社, 1995: 52.
[12]Yang R H, Wang K M, Long L P,et al.A selective optode membrane for histidine based on fluorescence en-hancement of meso−meso-linked porphyrin dimer[J].Ana.l Chem., 2002, 74(5): 1088-1096.
[13]Choi M M F, Wu X J, Li Y R. Optode membrane for determination of nicotine via generation of its bromoethane derivative[J].Anal. Chem., 1999, 71(7): 1342-1349.
(责任编校:陈健琼)
Determination of Mercury (Ⅱ ) Based on Fluorescence Quench of Folic Acid
LONG Li-ping, ZHOU Li-ping, MENG Wei, WANG Jiao-liang, XIE Dan
(College of Chemistry and Environmental Engineering, Hunan City University, Yiyang, Hunan 413000, China)
A simple and sensitive fluorescence quenching method for the determination of mercury (Ⅱ) was reported. It was based on fluorescence quenching effect of mercury (Ⅱ) on folic acid. When the concentration of folic acid is 5.00×10-6mol/L in HAc-NaAc buffer solution of pH 6.0, the maximum excitation and emission wavelengths of folic acid are 277.0 nm and 443.0 nm respectively. There is a good linear relationship between the relative fluorescence intensity and the concentration of mercury (Ⅱ) ranged from (4.20×10-6to 6.20×10-3) mol/L, with detection limit of 1.30×10-7mol/L. The relative standard deviation (n=11) is 1.38%. The average recovery is 95.6%-99.7%. The method has a good selectivity, which can be applied to the direct determination of mercury (Ⅱ) in environment water.
Spectrophotofluorimetry;fluorescence quenching;folic acid;mercury(Ⅱ)
O621.15
A
10.3969/j.issn.1672-7304.2017.01.15
1672–7304(2017)01–0073–03
2016-08-16
国家自然科学基金项目(21545003,21502048);湖南省自然科学基金项目(2015JJ2023,13JJ3117);湖南省高校科技创新团队支持计划项目(湘教通[2014]207号);湖南省黑茶金花重点实验室项目(湘科规财[2016]8号)
龙立平(1964-),男,湖南益阳人,教授,主要从事光化学传感器的研制与应用研究.E-mail: llping401@163.com

