甲亢患者血清尿酸水平与发生房颤的相关性分析
陈婷,张美英
(南昌大学第二附属医院内分泌代谢科,江西南昌330006)
甲亢患者血清尿酸水平与发生房颤的相关性分析
陈婷,张美英
(南昌大学第二附属医院内分泌代谢科,江西南昌330006)
目的分析血清尿酸水平与甲状腺功能亢进症患者心房颤动的关系。方法回顾性收集2013年10月-2015年10月于该院就诊的227例甲亢患者临床资料,根据是否合并房颤,分为甲亢伴房颤组(n=49)和甲亢无房颤组(n=178),排外除甲亢以外其他疾病导致的房颤及其他可以引起尿酸水平变化的因素。记录入选患者的一般资料、实验室检查及心脏彩超结果,并对这些数据与房颤发生之间的关系进行单因素和多因素Logistic回归分析。结果甲亢伴房颤组的年龄、甲亢病程、尿素氮、肌酐、尿酸、球蛋白、左心房前后径及左心室舒张末期内径均高于甲亢无房颤组(P<0.05),甲亢伴房颤组的肾小球滤过率、总胆固醇、高密度脂蛋白、低密度脂蛋白、白蛋白及左室射血分数低于甲亢无房颤组(P<0.05)。通过多因素Logistic回归分析显示年龄(:1.097,95%CI:1.036,1.160)、尿酸(:1.009,95%CI:1.002,1.016)、左心房前后径(:1.294,95%CI:1.134,1.476)及左室射血分数(:0.902,95%CI:0.814,1.000)是甲亢患者房颤发生的独立相关因素。结论尿酸水平是甲亢患者房颤发生的危险因素,年龄、左心房前后径和左室射血分数也与甲亢患者房颤发生存在独立相关性。
甲状腺功能亢进症;心房颤动;血清尿酸;危险因素
房颤是一种临床上常见的心律失常,其患病率和死亡率都很高。目前,认为炎症反应和氧化应激与房颤的发生和维持密切相关。尿酸可能是预测心血管疾病发生风险的指标[1]。越来越多的证据显示,尿酸是房颤发生的危险因素[2]。尿酸通过促进炎症激活和氧化应激程度增加介导房颤的发生[3]。目前,尚无甲亢患者房颤发生与尿酸水平的相关性研究,本研究旨在分析甲亢患者房颤发生与尿酸水平的关系。
1 资料与方法
1.1 研究资料
选取2013年10月-2015年10月在南昌大学第二附属医院内分泌科住院甲亢患者227例,根据有无合并房颤分为两组。甲亢并房颤组49例,平均(54.25±12.05)岁;甲亢无房颤组178例,平均(39.78± 11.74)岁。甲亢诊断标准参考第8版内科学的甲状腺功能亢进症诊断标准[4]:①高代谢症状和体征;②甲状腺肿大;③血清总甲状腺素(total thyroxine,TT4)、游离甲状腺素(free thyroxine,FT4)增高,促甲状腺激素(thyroid stimulating hormone,TSH)减低。具备以上3项诊断即可成立。房颤诊断标准为12导联心电图、动态心电图记录到房颤的发生。排除标准:冠状动脉粥样硬化性心脏病(冠心病)、心肌病、先天性心脏病、心脏病手术史、高血压病、糖尿病、呼吸系统疾病、肾功能衰竭、肿瘤、近期有过手术或者外伤,近期感染性疾病、自身免疫性疾病和应用影响尿酸代谢药物(利尿剂除外)。
1.2 研究方法
收集入选者的姓名、性别、年龄、脉搏、呼吸、血压及心率等一般临床资料。所有入选患者使用福田FX-7402十二导联心电图仪(日本福田电子株式会社)或者博英BI-9800动态心电图仪(广东省深圳市博英医疗仪器科技有限公司)进行描记心电图。入选患者均禁食10~12 h,次日早晨抽取空腹血标本。应用Beckman-AU5831全自动生化分析仪(美国贝克曼库尔特公司)测定肝功能、肾功能、电解质、空腹血糖和血脂,应用HST-302全自动五分类血液分析仪(日本希森美康株式会社)进行血细胞分析及cen taur-XP全自动化学发光免疫分析仪(德国西门子公司)进行甲状腺功能检查。肾功能滤过率(estimated glomerular filtration rate,eGFR)采用肾脏病膳食改良试验(modification of diat in renal disease,MDRD)简化公式计算:eGFR=186×(肌酐mg/dl)-1.154×(年龄)-0.203×(女性×0.742)。使用IE33心脏超声诊断仪(荷兰飞利浦公司),测量左心房前后径(left artrial diameter,LAD)、室间隔厚度(interventricular septal thickness,IVST)、左心室后壁厚度(left ventricular posterior wall thickness,LVPWT)、左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)及左心室射血分数(left ventricle eject fraction,LVEF)。
1.3 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,两组间比较用t检验(服从正态分布)或秩和检验(不服从正态分布);计数资料用百分构成比(%)表示,两组间比较用χ2检验,P<0.05为差异有统计学意义。影响因素的分析,采用非条多因素Logistic回归模型。
2 结果
2.1 两组一般临床资料、实验室及心脏超声检查结果
甲亢伴房颤组的年龄、甲亢病程、尿素氮、肌酐、尿酸、球蛋白、LAD及LVEDD均高于甲亢无房颤组,甲亢伴房颤组的eGFR、总胆固醇、高密度脂蛋白、低密度脂蛋白、白蛋白和LVEF明显低于甲亢无房颤组,差异有统计学意义(P<0.05)。见表1。
2.2 与甲亢患者房颤发生的相关因素
单因素Logistic分析中,年龄、甲亢病程、尿素氮、肌酐、尿酸、球蛋白、白蛋白、LAD、LVEDD、总胆固醇、高密度脂蛋白和LVEF均为甲亢患者房颤发生的相关因素(P<0.05)。见表2。但多因素Logistic分析结果示年龄、尿酸、LAD及LVEF为甲亢患者房颤的危险因素(见表3)。
表1 患者一般资料、实验室及心脏超声检查结果(±s)
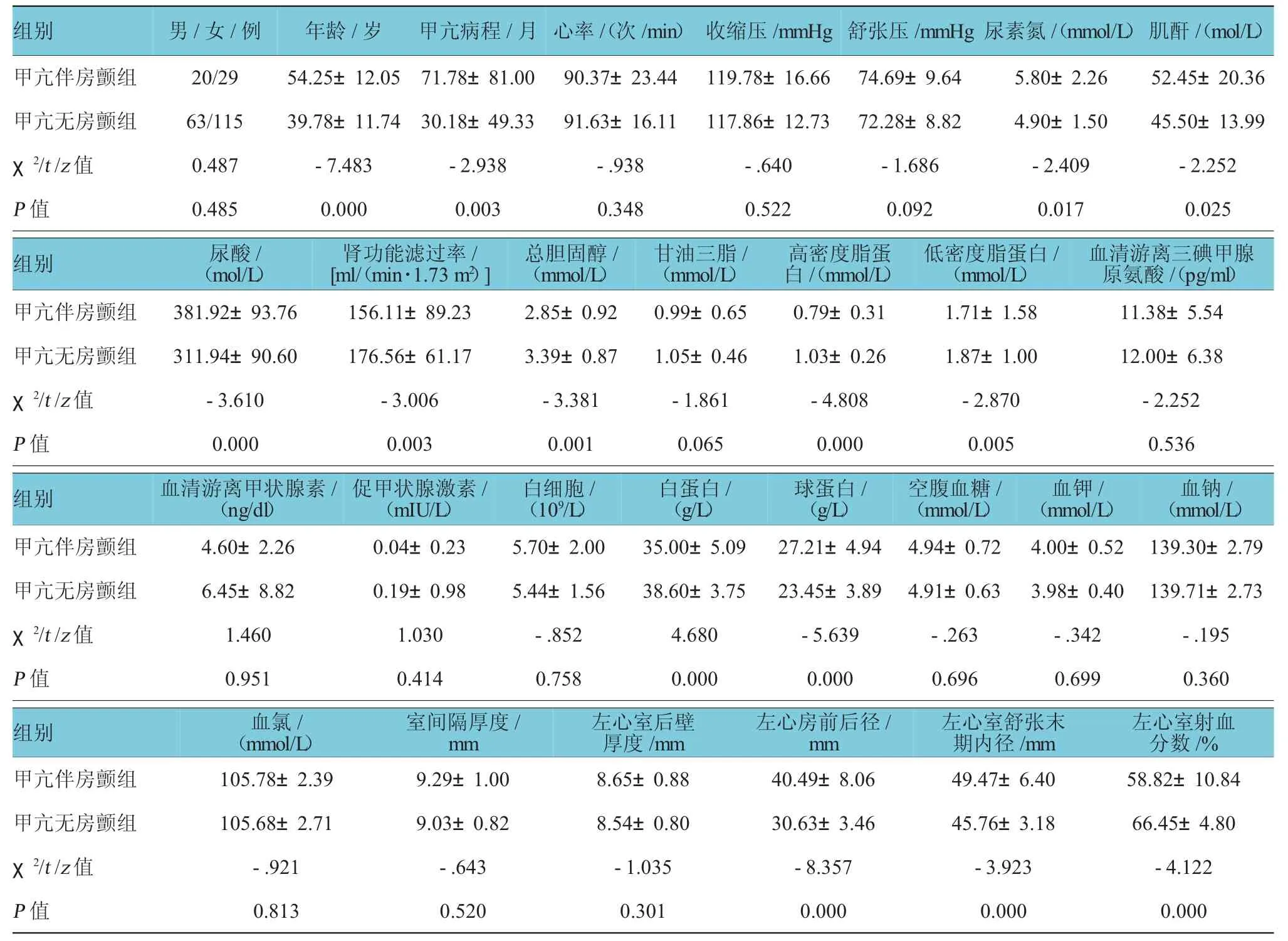
表1 患者一般资料、实验室及心脏超声检查结果(±s)
组别肌酐/(m o l / L)甲亢伴房颤组2 0 / 2 9 5 4 . 2 5 ± 1 2 . 0 5 7 1 . 7 8 ± 8 1 . 0 0 9 0 . 3 7 ± 2 3 . 4 4 1 1 9 . 7 8 ± 1 6 . 6 6 7 4 . 6 9 ± 9 . 6 4 5 . 8 0 ± 2 . 2 6 5 2 . 4 5 ± 2 0 . 3 6甲亢无房颤组6 3 / 1 1 5 3 9 . 7 8 ± 1 1 . 7 4 3 0 . 1 8 ± 4 9 . 3 3 9 1 . 6 3 ± 1 6 . 1 1 1 1 7 . 8 6 ± 1 2 . 7 3 7 2 . 2 8 ± 8 . 8 2 4 . 9 0 ± 1 . 5 0 4 5 . 5 0 ± 1 3 . 9 9 χ2/t/z值0 . 4 8 7 -7 . 4 8 3 -2 . 9 3 8 -. 9 3 8 -. 6 4 0 -1 . 6 8 6 -2 . 4 0 9 -2 . 2 5 2P值0 . 4 8 5 0 . 0 0 0 0 . 0 0 3 0 . 3 4 8 0 . 5 2 2 0 . 0 9 2 0 . 0 1 7 0 . 0 2 5男/女/例年龄/岁甲亢病程/月心率/(次/ m i n)收缩压/ m m H g 舒张压/ m m H g 尿素氮/(m m o l / L)血清游离三碘甲腺原氨酸/(p g / m l)甲亢伴房颤组3 8 1 . 9 2 ± 9 3 . 7 6 1 5 6 . 1 1 ± 8 9 . 2 3 2 . 8 5 ± 0 . 9 2 0 . 9 9 ± 0 . 6 5 0 . 7 9 ± 0 . 3 1 1 . 7 1 ± 1 . 5 8 1 1 . 3 8 ± 5 . 5 4甲亢无房颤组3 1 1 . 9 4 ± 9 0 . 6 0 1 7 6 . 5 6 ± 6 1 . 1 7 3 . 3 9 ± 0 . 8 7 1 . 0 5 ± 0 . 4 6 1 . 0 3 ± 0 . 2 6 1 . 8 7 ± 1 . 0 0 1 2 . 0 0 ± 6 . 3 8 χ2/t/z值-3 . 6 1 0 -3 . 0 0 6 -3 . 3 8 1 -1 . 8 6 1 -4 . 8 0 8 -2 . 8 7 0 -2 . 2 5 2P值0 . 0 0 0 0 . 0 0 3 0 . 0 0 1 0 . 0 6 5 0 . 0 0 0 0 . 0 0 5 0 . 5 3 6组别尿酸/(m o l / L)肾功能滤过率/ [ m l /(m i n · 1 . 7 3 m2)]总胆固醇/(m m o l / L)甘油三脂/(m m o l / L)高密度脂蛋白/(m m o l / L)低密度脂蛋白/(m m o l / L)血钠/(m m o l / L)甲亢伴房颤组4 . 6 0 ± 2 . 2 6 0 . 0 4 ± 0 . 2 3 5 . 7 0 ± 2 . 0 0 3 5 . 0 0 ± 5 . 0 9 2 7 . 2 1 ± 4 . 9 4 4 . 9 4 ± 0 . 7 2 4 . 0 0 ± 0 . 5 2 1 3 9 . 3 0 ± 2 . 7 9甲亢无房颤组6 . 4 5 ± 8 . 8 2 0 . 1 9 ± 0 . 9 8 5 . 4 4 ± 1 . 5 6 3 8 . 6 0 ± 3 . 7 5 2 3 . 4 5 ± 3 . 8 9 4 . 9 1 ± 0 . 6 3 3 . 9 8 ± 0 . 4 0 1 3 9 . 7 1 ± 2 . 7 3 χ2/t/z值1 . 4 6 0 1 . 0 3 0 -. 8 5 2 4 . 6 8 0 -5 . 6 3 9 -. 2 6 3 -. 3 4 2 -. 1 9 5P值0 . 9 5 1 0 . 4 1 4 0 . 7 5 8 0 . 0 0 0 0 . 0 0 0 0 . 6 9 6 0 . 6 9 9 0 . 3 6 0组别血清游离甲状腺素/(n g / d l)促甲状腺激素/(m I U / L)白细胞/(1 09/ L)白蛋白/(g / L)球蛋白/(g / L)空腹血糖/(m m o l / L)血钾/(m m o l / L)左心室射血分数/ %甲亢伴房颤组1 0 5 . 7 8 ± 2 . 3 9 9 . 2 9 ± 1 . 0 0 8 . 6 5 ± 0 . 8 8 4 0 . 4 9 ± 8 . 0 6 4 9 . 4 7 ± 6 . 4 0 5 8 . 8 2 ± 1 0 . 8 4甲亢无房颤组1 0 5 . 6 8 ± 2 . 7 1 9 . 0 3 ± 0 . 8 2 8 . 5 4 ± 0 . 8 0 3 0 . 6 3 ± 3 . 4 6 4 5 . 7 6 ± 3 . 1 8 6 6 . 4 5 ± 4 . 8 0 χ2/t/z值-. 9 2 1 -. 6 4 3 -1 . 0 3 5 -8 . 3 5 7 -3 . 9 2 3 -4 . 1 2 2P值0 . 8 1 3 0 . 5 2 0 0 . 3 0 1 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0组别血氯/(m m o l / L)室间隔厚度/ m m 左心室后壁厚度/ m m左心房前后径/ m m 左心室舒张末期内径/ m m

表2 甲亢患者房颤影响因素的单因素Logi st i c回归分析
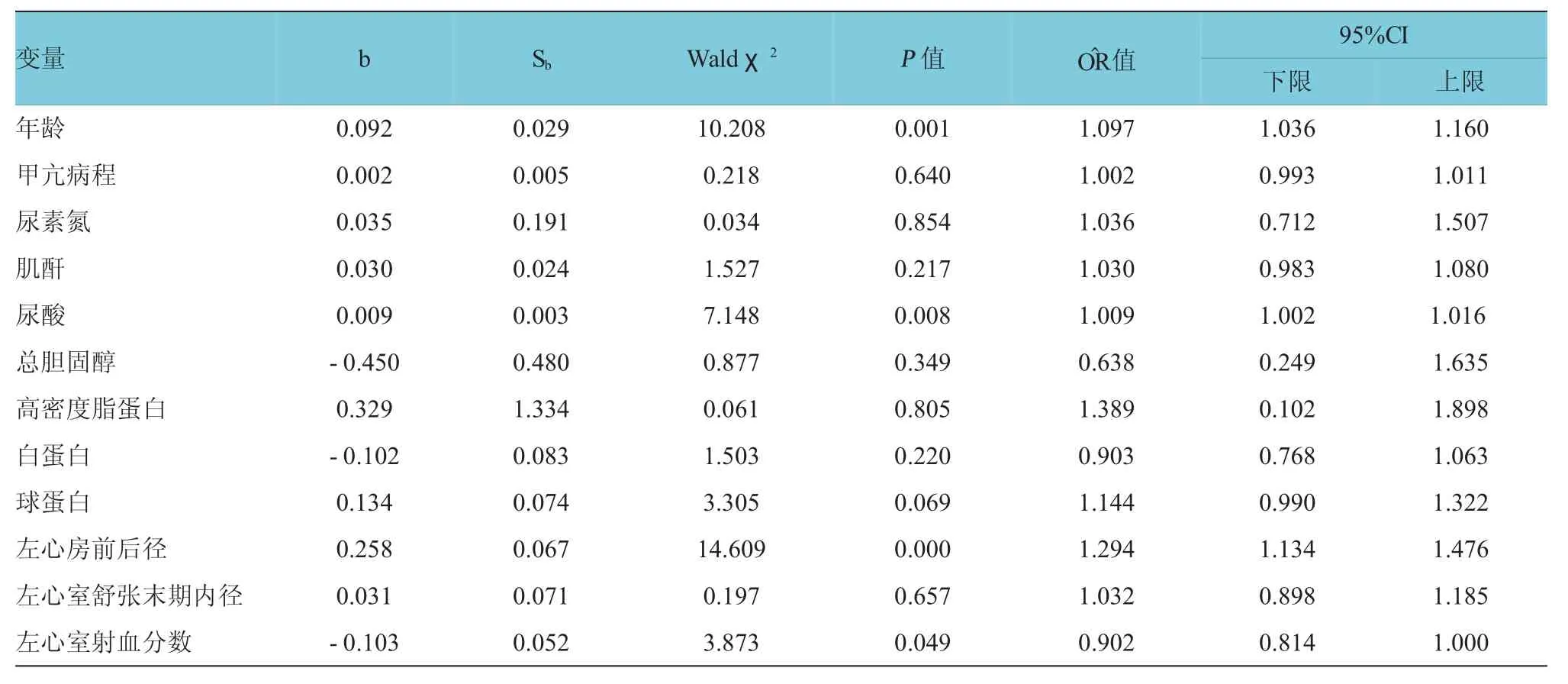
表3 甲亢患者房颤影响因素的多因素非条件Logi st i c回归分析
3 讨论
房颤是一个全球性的医疗问题,据统计房颤的人群患病率为0.4%~1.0%,且随着年龄的增长呈上升的趋势[5]。房颤在甲亢患者中的患病率大约为10%~25%[5]。甲亢作为一种代谢性疾病,能够抑制肾小管排泄尿酸,同时促进嘌呤代谢,导致尿酸水平升高[6]。甲亢患者高尿酸血症的患病率比无甲亢者明显升高。
笔者对227例住院的甲亢患者进行分析,发现仅年龄、尿酸、LAD及LVEF与甲亢患者房颤发生存在独立相关,其中高龄、LAD增大和高尿酸水平为甲亢患者房颤发生的危险因素。大量证据显示尿酸与房颤发生密切相关。SUN等[7]的一项横断面研究,提示高尿酸血症患者房颤的患病率高于尿酸水平正常者(2.4%vs 1.0%,P=0.00)。多因素Logistic回归分析提示高尿酸血症与房颤患病率独立相关(OR:1.94,95%CI:1.26,3.00,P<0.05)。当以尿酸水平作为变量时,发现尿酸水平也是房颤总患病率的危险因素(OR:1.20,95%CI:1.06,1.36,P<0.05),但是对于女性患者来说,尿酸水平与房颤发生无关,差异无统计学意义(P>0.05)。LETSAS等[8]一项病例对照研究,入选86例房颤患者(持续性房颤41例,阵发性房颤45例)和48例对照组患者,结果提示尿酸是持续性房颤的危险因素(OR:2.172,95%CI:1.327,3.555,P<0.05)。
关于尿酸与房颤发生风险的内在机制尚不清楚。目前,认为房颤发生和维持的主要机制是电生理重构和结构重构[9]。炎症和氧化应激参与房颤发生、维持的过程[10]。C反应蛋白(C-reactionprotein,CRP)是一种临床上十分常见炎症标记物。BRUINS等[11]首次提出炎症和房颤的关系,发现在冠状动脉搭桥术后的患者中补体系统的激活和促炎细胞因子的释放发生在心脏手术期间和之后,CRP在手术后第2天达到峰值,而心脏术后的房颤通常发生在术后第1个72 h[12],两者的峰值基本一致。官媛[13]动物实验提示炎症和氧化应激参与房颤的发生和电重构过程。大量证据表明,尿酸是糖尿病、高血压病、心血管疾病及脑卒中幸存者的心血管疾病事件和死亡率的独立预测指标[14]。根据不同的细胞环境和尿酸浓度,尿酸可以表现为抗氧化或者促氧化的作用[15]。当女性尿酸浓度超过6 mg/dl,男性超过6.5~7.5 mg/dl时,将会导致大量的过氧化氢和超氧自由基(superoxide radical,ROS)[16]生成,导致氧化应激增强。尿酸还可以激活促炎因子(IL-1β、IL-6和TNF-γ)和局部的肾素-血管紧张素(renin-angiotensinsystem,RAS)系统[17-18],炎症介质能激活成纤维细胞、促进基质金属蛋白酶分泌,导致心肌溶解、心肌细胞凋亡及纤维化,改变心房的电生理重构和结构重构[19]。另外,黄嘌呤氧化酶(xanthine oxidase,XO)是合成尿酸的关键酶。尿酸合成过程中,XO催化生成大量的ROS。在一项关于家族性胆固醇血症患者的研究提示,XO活性是炎症介质白介素-6(interleukin-6,IL-6)、超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)增加的独立预测因子[20]。本研究通过多因素Logistic回归分析显示,尿酸是甲亢患者房颤发生的危险因素。因此推测尿酸通过促进炎症激活和氧化应激程度增强,导致甲亢患者房颤的发生。
既往的研究和本研究提示,监测尿酸水平对预测甲亢患者房颤风险很有帮助。众所周知,别嘌呤醇是一种XO抑制剂,并且可以减少血管氧化应激、改善炎症状态和内皮功能[21],RAO等[22]的前瞻性观察性研究发现,在冠状动脉搭桥术围手术期加用别嘌呤醇能够降低术后房颤总发病率。MASAO等[23]认为,别嘌呤醇能够通过抑制心房的电重构和结构重构预防房颤。然而,降低尿酸水平是否可以减少房颤发生风险的可靠药理学证据仍不多。未来需要大规模的临床随机对照研究来证实,应用别嘌呤醇治疗高尿酸血症是否能对房颤产生有益影响。
[1]LEVANTESI G,MARFISI R M,FRANZOSI M G,et al.Uric acid:A cardiovascular risk factor in patients with recent myocardial infarction[J].International Journal of Cardiology,2013,167(1):262-269.
[2]KOZA Y.Uric acid elevation in atrial fibrillation:is it simply an epiphenomenon or not[J].International Journal of Cardiology,2014, 174(3):869.
[3]WATANABE E.Uric acid and atrial fibrillation-cause or other association[J].Circulation Journal,2012,76(3):584-585.
[4]葛均波,徐永健.内科学[M].第8版.北京:人民卫生出版社,2013:689.
[5]FUSTER V,RYDÉN LE,CANNOM DS,et al.ACCF/AHA/HRS focusedupdatesincorporatedintotheACC/AHA/ESC2006 guidelines for the management of patients with atrial fibrillation:a report of the american college of cardiology foundation/american heart association task force on practice guidelines[J].Journal of the American College of Cardiology,2011,57(11):e269-e367.
[6]FORD H C,LIM W C,CHISNALL W N,et al.Renal function and electrolyte levels in hyperthyroidism:urinary protein excretion and the plasma concentrations of urea,creatinine,uric acid,hydrogen ion and electrolytes[J].Clinical Endocrinology,1989,30(3):293-301.
[7]SUN G Z,GUO L,WANG J,et al.Association between hyperuricemia and atrial fibrillation in rural China:a cross-sectional study[J].BMC Cardiovascular Disorders,2015,15(1):98.
[8]LETSAS K P,PANAGIOTIS K,FILIPPATOS G S,et al.Uric acid elevation in atrial fibrillation[J].Hellenic Journal of Cardiology, 2010,51(3):209-213.
[9]ALDHOON B,MELENOVSKY V,PEICHL P,et al.New Insights into Mechanisms of Atrial Fibrillation[J].Physiological Research,2009,59(1):1-12.
[10]WU N,XU B,XIANG Y,et al.Association of inflammatory factors with occurrence and recurrence of atrial fibrillation:A meta-analysis[J].International Journal of Cardiology,2013,169(1):62-72.
[11]BRUINS P,VELTHUIS H,YAZDANBAKHSH A P,et al.Activation of the complement system during and after cardiopulmonary bypass surgery:postsurgery activation involves C-reactive protein and is associated with postoperative arrhythmia[J].Circulation,1997,96(10):3542-3548.
[12]TAMIS J E,STEINBERG J S.Atrial fibrillation independently prolongs hospital stay after coronary artery bypass surgery[J]. Clinical Cardiology,2000,23(3):155-159.
[13]官媛.炎症和氧化应激标志物在犬心房颤动模型中的变化及意义[D].西安:第四军医大学,2010.
[14]WANG J J,ZHU S H,LIU MF,et al.Uric acid and cardiovascular risk[J].New England Journal of Medicine,2009,360(359):1811-1821.
[15]SAUTIN Y,JOHNSON R.Uric acid:the oxidant-antioxidant paradox[J].Nucleosides Nucleotides&Nucleic Acids,2008,27(6):608-619.
[16]BASAGA H S.Biochemical aspects of free radicals[J].Biochemistry&Cell Biology,1990,68(68):989-998.
[17]MEHMET K,MARK S,BARIS A,et al.The role of uric acid in the pathogenesis of human cardiovascular disease[J].Heart, 2013,99(11):759-766.
[18]PUDDU P,PUDDU GM,CRAVERO E,et al.Relationships among hyperuricemia,endothelial dysfunction and cardiovascular disease:molecular mechanisms and clinical implications[J].Journal of Cardiology,2012,59(3):235-242.
[19]HU Y F,CHEN Y J,LIN Y J,et al.Inflammation and the pathogenesis of atrial fibrillation[J].Nature Reviews Cardiology, 2015,12(4):230.
[20]MARTINEZ-HERVAS S,REAL J T,IVORRA C,et al.Increased plasma xanthine oxidase activity is related to nuclear factor kappa beta activation and inflammatory markers in familial combined hyperlipidemia[J].Nutrition Metabolism&Cardiovascular Diseases,2010,20(10):734-739.
[21]KHOSLA UM,ZHARIKOV S,FINCH J L,et al.Hyperuricemia induces endothelial dysfunction[J].Kidney International,2005, 67(5):1739-1742.
[22]RAO D A R V,GUDIMANI D S C,KUMAR D A,et al.Effect of prophylactic supplementation of allopurinol,magnesium and statin on the incidence of atrial fibrillation in off pump and on pump coronary artery surgery[J].International Journal of Biomedical Research,2014,5(1):46-49.
[23]SANCHIS-GOMAR F,PEREZ-QUILIS C,CERVELLIN G,et al.Anti-gout drugs as potential therapy for atrial fibrillation[J]. International Journal of Cardiology,2014,177(3):1061-1062.
Association between serum uric level and atrial fibrillation in patients with hyperthyroidism
Ting Chen,Mei-ying Zhang
(Department of Endocrine and Metabolic,the Second Affiliated Hospital of Nanchang University,Nanchang,Jiangxi 330006,China)
ObjectiveTo investigate the association between atrial fibrillation(AF)and serum uric acid (SUA)level in patients with hyperthyroidism.Methods227 hospitalization patients with hyperthyroidism treated in our hospital from October 2013 to October 2015,were divided into hyperthyroidism with AF group(n=49) and hyperthyroidism without AF group(n=178)according to whether had AF or not.Clinical characteristics,laboratory data and characteristics of all patients were carefully recorded.The association between AF and those clinical data of the two groups were analyzed by univariate and multivariate logistic regression analysis.ResultsThe age,duration of hyperthyroidism,blood urea nitrogen,serum creatinine,SUA,globulin,left atrial diameter(LAD),left ventricular end-diastolic dimension(LVEDD)were significantly higher in hyperthyroidism with AF group than those in hyperthyroidism without AF group(P<0.05).The estimated glomerular filtration rate(eGFR),total cholesterol,high-density lipoprotein,low-density lipoprotein,albumin,left ventricular ejection fraction(LVEF)were lower in hyperthyroidism with AF group than those in hyperthyroidism without AF group (P<0.05).Multivariate logistic regression analysis showed that only age(:1.097,95%CI:1.036,1.160),SUA (:1.009,95%CI:1.002,1.016),LAD(:1.294,95%CI:1.134,1.476),LVEF(O^R:0.902,95%CI:0.814,1.000)were independently associated with AF in patients with hyperthyroidism.ConclusionsSUA maybe a risk factor of AF in patients with hyperthyroidism.And age,LAD,LVEF are independently associated with AF in patients with hyperthyroidism.
hyperthyroidism;atrial fibrillation;serum uric acid;risk factor
R581.1
A
10.3969/j.issn.1005-8982.2017.08.024
1005-8982(2017)08-0117-05
2016-07-13
张美英,E-mail:zhang0mei0ying@126.com

