丁苯酞氯化钠注射液联合双重抗血小板治疗进展性脑梗死合并睡眠障碍及对睡眠结构的影响
戴海琳,王丽,王彦珍,王秀卿,杨月君,张春良,赵凤丽
(河北省保定市第二医院1.神经内科,2.耳鼻喉科,河北保定071051)
丁苯酞氯化钠注射液联合双重抗血小板治疗进展性脑梗死合并睡眠障碍及对睡眠结构的影响
戴海琳1,王丽1,王彦珍2,王秀卿1,杨月君1,张春良1,赵凤丽1
(河北省保定市第二医院1.神经内科,2.耳鼻喉科,河北保定071051)
目的探讨丁苯酞氯化钠注射液联合阿司匹林、氯吡格雷双重抗血小板治疗进展性脑梗死患者睡眠障碍的疗效及对睡眠结构的影响。方法选取2013年4月-2015年12月于保定市第二医院神经内科住院患者共206例,均符合进展性脑梗死合并睡眠障碍,随机分为治疗组(加用丁苯酞氯化钠注射液治疗)103例及对照组103例(不加用丁苯酞氯化钠注射液治疗),发病时间在48 h内,匹兹堡睡眠质量指数(PSQI)≥8分。分别于治疗前、治疗后第8、15及30天进行PSQI、NIHSS评分和Barthel评分,入组第1及30天进行多导睡眠监测,对PSQI、美国国立卫生研究院卒中量表(NIHSS)评分、日常生活能力评定量表(Barthel)评分、睡眠结构及进程参数进行分析。结果治疗后第15和30天,治疗组与治疗前同组及同期对照组比较,PSQI、NIHSS评分及Barthel评分,差异有统计学意义(P<0.05)。治疗组与对照组治疗后30 d比较,总睡眠时间、睡眠效率及深睡眠比例增加,夜间觉醒次数、睡眠呼吸暂停低通气指数减少(P<0.05)。治疗组治疗后30 d与治疗前比较,总睡眠时间、睡眠效率、深睡眠比例及REM期睡眠比例增加,入睡潜伏期、夜间觉醒次数及睡眠呼吸暂停低通气指数减少(P<0.05)。结论丁苯酞氯化钠注射液联合阿司匹林、氯吡格雷对进展性脑梗死后睡眠障碍可进行有效干预,并改善睡眠结构。
丁苯酞;阿司匹林;氯吡格雷;睡眠障碍;睡眠结构;多导睡眠监测
脑梗死并发睡眠障碍的发生率高达78.0%,主要表现为睡眠-觉醒障碍及睡眠呼吸紊乱[1],合并睡眠障碍脑梗死患者有更严重的神经功能缺损和更差的日常生活能力,是病情加重的标志[2-3],并增加复发风险及死亡率[4-5]。本研究拟对合并睡眠障碍的进展性脑梗死进行药物干预,以改善睡眠障碍及睡眠结构紊乱,减少卒中进展风险。
1 资料与方法
1.1 一般资料
1.1.1 入选标准①发病年龄为18~80岁;②首次发病,临床表现及影像检查证实为急性脑梗死,均符合全国第4届脑血管病会学术会议修订的诊断标准[6],且参照睡眠障碍国际分类中失眠的诊断标准[7],合并睡眠障碍,匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)≥8分;③发病时间在48 h内,在规范治疗过程中病情出现恶化,美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分下降≥1分,无意识障碍;④病情进展后头颅电子计算机断层扫描(computed tomography,CT)及磁共振成像(magnetic resonance imaging,MRI)复查除外脑出血、短暂性脑缺血发作、梗死后出血和其他颅内动脉再发脑梗死,除外因严重的感染及水电解质紊乱、高热或心功能不全等所致的病情进展;⑤患者及家属知情同意,患者能够完成整夜的多导睡眠监测。
1.1.2 病例排除标准①年龄>80岁或<18岁者;②血管性痴呆及其他痴呆史、精神异常等无法合作者,短暂性脑缺血发作,出血倾向者;③先天性血管异常并发缺血性卒中者;④心室率<50次/min者;⑤心源性梗死者;⑥有严重心、肝、肾异常及其他伴发严重疾病者,恶性肿瘤;⑦有芹菜过敏史者;⑧妊娠或哺乳期妇女。
1.2 方法
1.2.1 分组选取2013年4月-2015年12月按住院时间顺序于保定市第二医院神经内科住院患者共206例,均符合进展性脑梗死,随机分为观察组(加用丁苯酞氯化钠注射液治疗)103例及对照组103例(不加用丁苯酞氯化钠注射液治疗)。观察组:男性59例,女性44例;年龄42~78岁,平均(62.7± 10.5)岁。对照组:男性57例,女性46例;年龄40~79岁,平均(61.1±9.8)岁。两组在年龄、性别、基础疾病和病情严重程度、日常生活能力、睡眠状态及多导睡眠参数上,经统计学检验差异无统计学意义(见表1)。
1.2.2 治疗方法对照组采用抗血小板聚集治疗(首剂氯吡格雷300 mg、阿司匹林100 mg口服,次日起至发病21 d氯吡格雷75 mg、阿司匹林100 mg口服日1次,22 d后阿司匹林100 mg口服日1次),银杏制剂20 ml静脉滴注日1次(共14 d),依达拉奉30 mg静脉滴注日2次(共14 d),阿托伐他汀40 mg口服日1次,甜梦胶囊3粒日2次,及其他对症处理(包括调整血压、血糖及减轻脑细胞水肿、维持水电解平衡及康复治疗等),不使用其他抗血小板聚集、抗凝和降纤(写全称)等药物。
观察组在对照组治疗基础上加用丁苯酞氯化钠注射液25 mg(河北省石家庄市石药集团恩必普药业有限公司生产,批准文号:国药准字H20100041),静脉滴注,每日2次,每次滴注时间≥50 min,2次用药时间间隔≥6 h,疗程14 d。由于聚氯乙烯(polyvinyl chloride,PVC)输液器对丁苯酞有明显的吸附作用,故使用PE(补充中英文全称)输液器。
1.2.3 观察指标①睡眠状态评估:采用PSQI评价患者的睡眠状态,由7个项目构成,总分为0~21分,PSQI≥8分作为睡眠障碍的标准,分值越高,表示睡眠质量越差[8]。②神经功能缺失:采用NIHSS评估脑卒中患者的神经功能缺损程度[9]。NIHSS共由15个项目组成,总分范围为0~42分,分值越高表示神经功能缺损越严重。③生活能力状态:采用日常生活能力评定量表(Barthel),评定脑卒中患者的日常生活活动能力[10]。Barthel共有10项评分内容构成,总分范围为0~100分,得分越高,表示独立性越好,依赖性越小。以上3个项目分别在开始丁苯酞氯化钠注射液治疗前及治疗后第8、15及30天,由经过培训的2位医师共同进行评定。④多导睡眠监测(polysomnography,PSG):客观评价患者睡眠质量、睡眠时间、睡眠效率及睡眠分期,获得睡眠结构及进程参数:总睡眠时间(total sleep time,TST)、睡眠潜伏期(sleep latency,SL)、夜间觉醒次数(awaking number,AN)、睡眠效率(sleep efficiency,SE)%、睡眠阶段S1、S2、S3及S4占整个睡眠时间的百分比[即S1%、S2%和(S3+S4)%(S3和S4属于深睡眠,合为1个统计单位)]、快速动眼期(rapid eye movement,REM)时间、REM百分比及REM潜伏期等。还可以通过对口鼻气流、血氧饱和度及鼾声等的监测,得出睡眠呼吸暂停低通气指数(apnea hypopnea index,AHI),协助对睡眠呼吸紊乱患者进行分期、分级。
对入选患者第1及30天进行多导睡眠监测。使用美国Embla EB2-C多导睡眠监测系统监测,由多导睡眠监测技师操作,监测时间为患者正常入睡时间至次日晨6∶00结束,≥7h。监测室为安静、舒适及隔音的单人房间,室温20~25℃。监测前,清洁患者头面部皮肤,安放电极,操作方法参照Rechtschaffen-Kales标准,多导睡眠图自带Pro Fusion PSG分析软件记录分析,并由睡眠组医师人工复核校正结果。
1.2.4 偏倚控制①在设计和现场调查阶段严格按照纳入和排除标准选择研究对象;②现场调查过程采用统一的调查表、统一的调查方式进行调查;③按照设计的时间节点收集相关资料,标准统一,并及时记录。操作人员相对固定;④对患者进行良性心理暗示,解除其紧张及焦虑,睡眠环境舒适;⑤加强皮肤处理环节,有效去除电极贴放部位油脂及角质,避免电极脱落,减少阻抗,提高信号质量及监测成功率。
1.3 统计学方法
数据分析采用SPSS 13.0统计软件,计量资料以均值±标准差(±s)表示;计量资料采用t检验,计数资料采用χ2检验,行各指标重复测量设计的方差分析,评价观察组与对照组之间基本特征、PSQI、NIHSS、Barthel及PSG各睡眠参数的差异,P<0.05为差异有统计学意义。
2 结果
2.1 两组PSQ I、N I H SS评分及Bart hel评分结果
采用重复测量数据的方差分析。①治疗前,治疗组与对照组PSQI、NIHSS评分、Barthel评分差异无统计学意义(F=1.056,P=0.283)。②治疗第8天,治疗组PSQI、NIHSS评分及Barthel评分与治疗前同组比较差异无统计学意义(F=1.697,P=0.202);与同期对照组比较差异无统计学意义(F=1.778,P=0.193)。③治疗后第15天,治疗组与治疗前同组PSQI、NIHSS评分及Barthel评分,差异有统计学意义(F=3.763,P=0.025);与同期对照组比较,差异有统计学意义(F=4.002,P=0.018)。④治疗后第30天,治疗组与治疗前同组比较,PSQI、NIHSS评分及Barthel评分差异有统计学意义(F=3.602,P=0.029);与同期对照组比较,差异有统计学意义(F=3.175,P=0.013)。见表2。
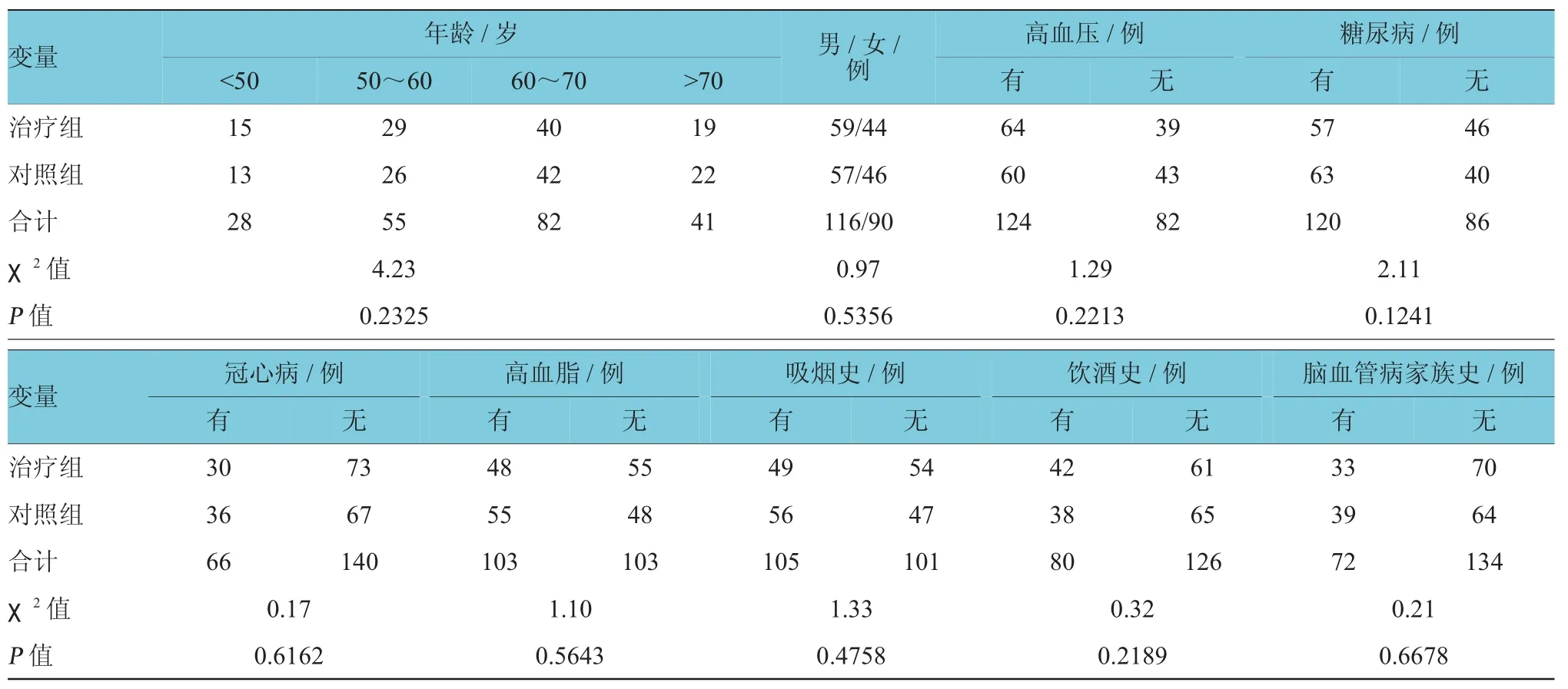
表1 患者基本特征情况
表2 两组治疗第8、15及30天不同量表评估(n=103±s)

表2 两组治疗第8、15及30天不同量表评估(n=103±s)
注:†与治疗前同组比较,P<0.05
B a r t h e l评分治疗前对照组1 7 . 6 5 ± 2 . 5 9 1 9 . 2 1 ± 2 . 1 7 4 7 . 7 7 ± 5 . 6 1治疗组1 8 . 0 2 ± 1 . 9 8 1 8 . 6 2 ± 2 . 7 8 4 9 . 0 2 ± 4 . 5 6第8天对照组1 5 . 2 2 ± 2 . 1 1 1 7 . 7 2 ± 2 . 2 3 5 2 . 2 4 ± 5 . 3 2治疗组1 4 . 0 7 ± 1 . 3 2 1 5 . 6 8 ± 2 . 5 5 5 6 . 1 8 ± 4 . 6 6第1 5天对照组1 2 . 8 9 ± 1 . 7 8 1 5 . 0 5 ± 1 . 8 7 5 4 . 6 7 ± 4 . 7 8治疗组9 . 0 9 ± 2 . 2 5†1 0 . 9 6 ± 2 . 0 6†6 4 . 7 3 ± 3 . 9 1†第3 0天对照组1 0 . 6 3 ± 2 . 3 4 1 1 . 3 6 ± 1 . 7 5 5 9 . 6 1 ± 5 . 7 7治疗组7 . 6 1 ± 2 . 2 9†5 . 5 7 ± 2 . 0 6†7 1 . 6 0 ± 4 . 6 3†时间组别P S Q I N I H S S评分
2.2 两组睡眠结构及进程参数结果
与治疗组比较,对照组治疗后第30天TST、SE、深睡眠及REM期睡眠比例增加,AN、AHI显著减少(P<0.05),见表3。治疗组治疗后第30天与治疗前比较,TST、SE、深睡眠比例、REM期睡眠比例增加,SL、AN及AHI减少(P<0.05)。见表4。
表3 两组治疗后第30天PSG结果(n=103±s)
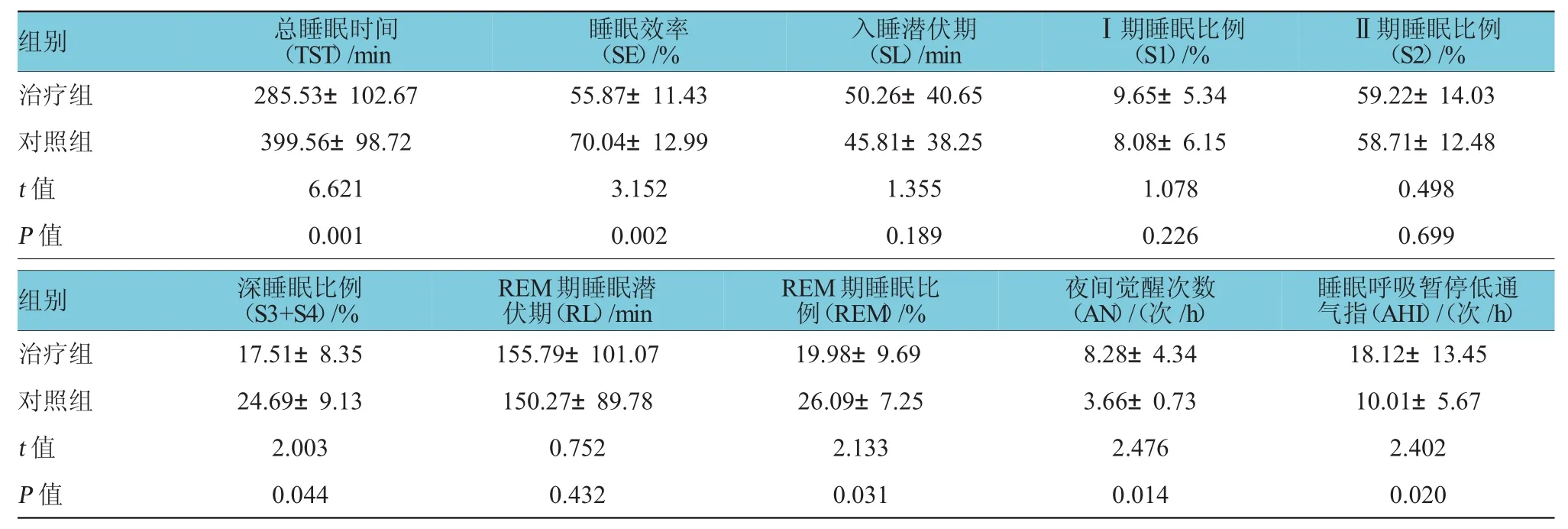
表3 两组治疗后第30天PSG结果(n=103±s)
Ⅱ期睡眠比例(S 2)/ %治疗组2 8 5 . 5 3 ± 1 0 2 . 6 7 5 5 . 8 7 ± 1 1 . 4 3 5 0 . 2 6 ± 4 0 . 6 5 9 . 6 5 ± 5 . 3 4 5 9 . 2 2 ± 1 4 . 0 3对照组3 9 9 . 5 6 ± 9 8 . 7 2 7 0 . 0 4 ± 1 2 . 9 9 4 5 . 8 1 ± 3 8 . 2 5 8 . 0 8 ± 6 . 1 5 5 8 . 7 1 ± 1 2 . 4 8t值6 . 6 2 1 3 . 1 5 2 1 . 3 5 5 1 . 0 7 8 0 . 4 9 8P值0 . 0 0 1 0 . 0 0 2 0 . 1 8 9 0 . 2 2 6 0 . 6 9 9组别总睡眠时间(T S T)/ m i n睡眠效率(S E)/ %入睡潜伏期(S L)/ m i nⅠ期睡眠比例(S 1)/ %睡眠呼吸暂停低通气指(A H I)/(次/ h)治疗组1 7 . 5 1 ± 8 . 3 5 1 5 5 . 7 9 ± 1 0 1 . 0 7 1 9 . 9 8 ± 9 . 6 9 8 . 2 8 ± 4 . 3 4 1 8 . 1 2 ± 1 3 . 4 5对照组2 4 . 6 9 ± 9 . 1 3 1 5 0 . 2 7 ± 8 9 . 7 8 2 6 . 0 9 ± 7 . 2 5 3 . 6 6 ± 0 . 7 3 1 0 . 0 1 ± 5 . 6 7t值2 . 0 0 3 0 . 7 5 2 2 . 1 3 3 2 . 4 7 6 2 . 4 0 2P值0 . 0 4 4 0 . 4 3 2 0 . 0 3 1 0 . 0 1 4 0 . 0 2 0组别深睡眠比例(S 3 + S 4)/ % R E M期睡眠潜伏期(R L)/ m i n R E M期睡眠比例(R E M)/ %夜间觉醒次数(A N)/(次/ h)
表4 治疗组治疗前及治疗后第30天PSG结果(n=103,±s)
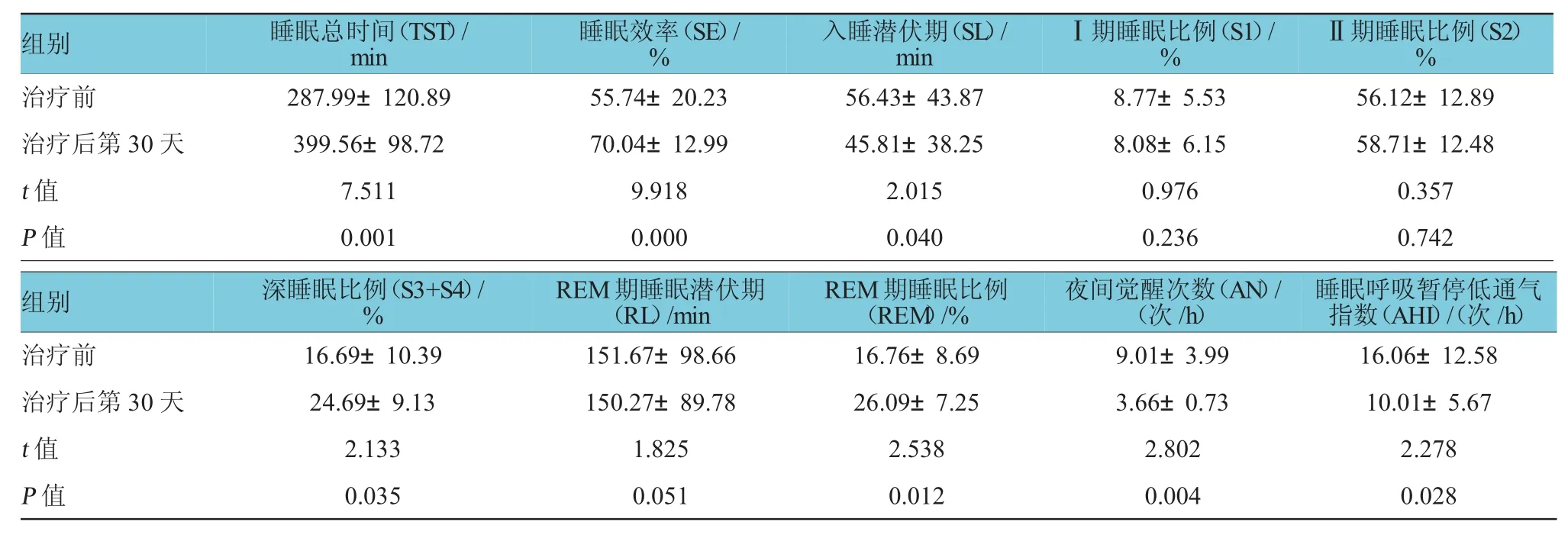
表4 治疗组治疗前及治疗后第30天PSG结果(n=103,±s)
Ⅱ期睡眠比例(S 2)%治疗前2 8 7 . 9 9 ± 1 2 0 . 8 9 5 5 . 7 4 ± 2 0 . 2 3 5 6 . 4 3 ± 4 3 . 8 7 8 . 7 7 ± 5 . 5 3 5 6 . 1 2 ± 1 2 . 8 9治疗后第3 0天3 9 9 . 5 6 ± 9 8 . 7 2 7 0 . 0 4 ± 1 2 . 9 9 4 5 . 8 1 ± 3 8 . 2 5 8 . 0 8 ± 6 . 1 5 5 8 . 7 1 ± 1 2 . 4 8t值7 . 5 1 1 9 . 9 1 8 2 . 0 1 5 0 . 9 7 6 0 . 3 5 7P值0 . 0 0 1 0 . 0 0 0 0 . 0 4 0 0 . 2 3 6 0 . 7 4 2组别睡眠总时间(T S T)/ m i n 睡眠效率(S E)/ %入睡潜伏期(S L)/ m i n Ⅰ期睡眠比例(S 1)/ %睡眠呼吸暂停低通气指数(A H I)/(次/ h)治疗前1 6 . 6 9 ± 1 0 . 3 9 1 5 1 . 6 7 ± 9 8 . 6 6 1 6 . 7 6 ± 8 . 6 9 9 . 0 1 ± 3 . 9 9 1 6 . 0 6 ± 1 2 . 5 8治疗后第3 0天2 4 . 6 9 ± 9 . 1 3 1 5 0 . 2 7 ± 8 9 . 7 8 2 6 . 0 9 ± 7 . 2 5 3 . 6 6 ± 0 . 7 3 1 0 . 0 1 ± 5 . 6 7t值2 . 1 3 3 1 . 8 2 5 2 . 5 3 8 2 . 8 0 2 2 . 2 7 8P值0 . 0 3 5 0 . 0 5 1 0 . 0 1 2 0 . 0 0 4 0 . 0 2 8组别深睡眠比例(S 3 + S 4)/ % R E M期睡眠潜伏期(R L)/ m i n R E M期睡眠比例(R E M)/ %夜间觉醒次数(A N)/(次/ h)
3 讨论
研究表明,睡眠障碍可使急性期脑梗死交感神经兴奋和糖耐量降低,从而严重影响血压和血糖的调控[11-12],而高血压、糖尿病又是进展性脑梗死的独立危险因素,尤其是发病后的高血压和高血糖状态[13-15]。睡眠结构的紊乱是睡眠障碍最重要的原因,而睡眠呼吸紊乱是卒中后睡眠结构紊乱的重要危险因素[16],会加重局部脑组织缺血[17-18],是脑梗死急性期病情进展、预后不良的重要危险因素,故改善睡眠障碍及睡眠结构紊乱是阻止脑梗死进展的措施之一。
睡眠量表监测简单,可操作性强,但被检者可能存在一定的主观性,而PSG是对睡眠监测的重要补充及客观评价,它可以通过监测整夜的脑电、眼动、肌电、体动、呼吸、脉搏及血氧饱和度等,进行睡眠结构参数及睡眠进程参数、睡眠呼吸暂停低通气指数分析,从而客观评价患者睡眠时间、睡眠效率及睡眠分期,确定睡眠障碍类型,指导治疗方法的选择。急性脑梗死患者睡眠结构变化的主要表现为:睡眠总时间缩短,睡眠效率低,睡眠潜伏期延长和觉醒时间增加;浅睡眠(S1睡眠)增加,深睡眠(S3、S4睡眠)和REM时间减少;睡眠呼吸紊乱。
本研究采用睡眠量表和多导睡眠监测相结合,客观体现患者睡眠状况。结果显示,丁苯酞氯化钠注射液联合阿司匹林、氯吡格雷对进展性脑梗死患者睡眠障碍有改善,对睡眠结构产生良性影响,增加睡眠总时间、睡眠效率、深睡眠及REM期睡眠,减少入睡潜伏期、夜间觉醒次数及睡眠呼吸暂停低通气指数,并且随着睡眠的好转,神经系统功能损害减轻,日常生活能力有所恢复。分析其机制可能为:双重抗血小板强化抗栓[19],丁苯酞减轻脑细胞水肿、保护线粒体、促进侧枝循环建立及抑制兴奋性氨基酸释放等作用,对与睡眠-觉醒系统相关的受损脑组织,如额叶底部、脑干网状结构抑制区、眶部皮质、上行网状系统、基底节、丘脑和下丘脑等,减轻细胞毒性作用,增加脑血流及减轻脑水肿导致的压迫[20-21],故改善睡眠-觉醒功能。同时促进与觉醒有关的神经递质如多巴胺、5-羟色胺和去甲肾上腺素等的正常合成和释放,以维持正常的睡眠-觉醒功能。通过对中枢神经功能障碍的改善,其所支配的呼吸驱动依赖的化学感受器及上气道的神经反射活动所受不良影响减小,舌根松弛、后坠以及咽喉、软腭肌肉功能失调、肌肉松弛和上气道管腔狭窄等症状减轻,故睡眠呼吸暂停低通气指数降低。日常生活能力的逐步恢复可以进一步减轻患者活动障碍、躯体不适,减轻焦虑情绪,从而改善睡眠障碍,且神经功能的恢复使快速眼动时间延长及比例增加[22],改善睡眠结构。
但本研究显示,与未合并睡眠障碍的进展性脑梗死比较[23],治疗第8天时NIHSS评分及Barthel评分未见到明显改善,提示合并睡眠障碍及睡眠结构紊乱的进展性脑梗死神经系统功能可能恢复时间更长。
综上所述,对进展性脑梗死后睡眠障碍要提高认识,常规筛查和评估睡眠功能,进行多导睡眠监测,以确定睡眠障碍的诊断与分型。丁苯酞氯化钠注射液联合阿司匹林、氯吡格雷治疗对进展性脑梗死后睡眠障碍可进行有效干预,通过改善睡眠结构,以阻止卒中进展,促进神经功能恢复,改善不良结局。
[1]PASIC Z,SMAJLOVIC D,DOSTOVIC Z,et al.Incidence and types of sleep disorders in patients with stroke[J].Medicinski Arhiv,2011,65(4):225-227.
[2]陈东,王文安.急性脑卒中患者睡眠障碍的特点[J].临床神经病学杂志,2015,28(1):34-36.
[3]KIM C R,CHUN MH,HAN E Y.Effects of hypnotics on sleep patterns and functional recovery of patients with subacute stroke[J]. American Journal of Physical Medicine&Rehabilitation,2010, 89(4):315-322.
[4]HERMANN D M,BASSETTI C L.Sleep-related breathing and sleep-wake disturbances in ischemic stroke[J].Neurology,2009, 73(16):1313-1322.
[5]王娇,梅丽,孟会红,等.脑卒中后睡眠障碍的临床因素相关研究[J].脑与神经疾病杂志,2013,21(4):281-285.
[6]王新德.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379-380.
[7]MEDICINE AAOS.International classification of sleep disorders:diagnostic and coding manual[J].Chest,2000,41(1):160-160.
[8]JIMENEZGENCHI A,MONTEVERDEMALDONADO E,NENCLARESPORTOCARRERO A,etal.Reliability andfactorial analysis of the spanish version of the pittsburgh sleep quality index among psychiatric patients[J].Gaceta Medica De Mexico, 2008,144(6):491-496.
[9]GOLDSTEIN L B,BERTELS C,DAVIS J N.Intervater reliability of the NIH stroke scales[J].Jama Neurology,1989,46(6):660-662.
[10]DUNCAN P W,JORGENSEN H S,WADE D T.Outcome measures in acute stroke trails:a systematic review and some rec ommendation to improve practice[J].Stroke,2000,31(6):1429-1438.
[11]朱伟芳,孙嘉曦.高血压病与睡眠障碍的相关性研究[J].实用医学杂志,2014,37(1):139.
[12]LEPPÄVUORI A,POHJASVAARA T,VATAJA R,et al.Insomnia in ischemic stroke patients[J].Cerebrovascular Diseases, 2002,14(2):90-97.
[13]钟芳芳,孙雪东,章燕幸,等.进展性脑梗死相关因素的Logistic回归分析[J].中华全科医学,2013,11(11):1719.
[14]王占芬,张学艳,李明.高血压与进展性卒中的关系研究及分析[J].中国医药导刊,2016,18(5):473.
[15]王霆,蒋纯新,将宏杰.进展性脑梗死相关危险因素分析[J].脑与神经疾病杂志,2013,21(2):103.
[16]DYKEN M E,IM K B.Obstructive sleep apnea and stroke[J]. Chest,2014,143(5):1668-1677.
[17]张强,高薇薇.脑梗死分型与睡眠结构的相关研究[J].卒中与神经疾病杂志,2015,22(3):137.
[18]GAO B,CAM E,JAEGER H,et al.Sleep disruption aggravates focal cerebral ischemia in the rat[J].Sleep,2010,33(7):879-887.
[19]吴晓力,倪旭明.氢氯吡格雷联合阿司匹林治疗进展型脑梗死临床观察[J].药物流行病学杂志,2014,23(5):275-277.
[20]宁文婧,杜业亮,孙乐津.丁苯酞对脑缺血大鼠AQP9mRNA表达的影响[J].中国实用神经疾病杂志,2014,17(4):52-54.
[21]施晓耕,黄如训,刘春岭,等.丁苯酞对高血压性脑卒中预防作用的实验研究[J].中国神经精神疾病杂志,2007,33(8):486-489.
[22]李露娜,邓丽影,邹学良,等.急性脑梗死患者睡眠结构的变化[J].中风与神经疾病杂志,2011,28(6):490.
[23]戴海琳,王丽,王彦珍,等.丁苯酞氯化钠注射液联合双重抗血小板治疗进展性脑梗死的临床疗效观察[J].中国现代医学杂志, 2015,25(33):95-97.
Study of treatment effect of butylphthalide and sodium chloride injection combined with dual antiplatelet therapy on sleep disorders in patients with progressive cerebral infarction
Hai-lin Dai1,Li Wang1,Yan-zhen Wang2,Xiu-qing Wang1, Yue-jun Yang1,Chun-liang Zhang1,Feng-li Zhao1
(1.Department of Neurology;2.Department of Otolaryngology,the Second Hospital of Baoding,Baoding,Hebei 071051,China)
ObjectiveTo investigate the treatment effect of aspirin and clopidogrel dual antiplatelet therapy combined with butylphthalide and sodium chloride injection on sleep disorders in patients with progressive cerebral infarction and the influence on sleep structure,and to providing the basis for reducing the progressive risk of cerebral infarction.MethodsA total of 206 patients who were hospitalized in the department of Neurology of the Second Hospital of Baoding from April 2013 to December 2015 were sampled in accordance with the progressive cerebral infarction associated with sleep disorder.The samples were randomly divided into treatment group including 103 cases(treated with butylphthalide and sodium chloride injection)and control group with another 103 cases without treatment.The onset time of the patients was within 48 hours,PSQI≥8.Grading for PSQI,NIHSS,Barthel scores were recoeded before the treatment,and after the treatment on the day 8,15 and 30.All patients were monitored through polysomnography on the day 1 and 30.All thedata including PSQI,NIHSS,Barthel scores,sleep structure and process index were recorded,compared and analyzed.ResultsThere were significant differences(P<0.05)between the treatment group on day 15 and day 30 after treatment.Compared with the control group,and with the same group before treatment,the PSQI, NIHSS score and Barthel score in the treatment group had significant differences(P<0.05).After the 30-day treatment,compared with the control group,the total sleep time,sleep efficiency,deep sleep ratio,and the ratio of REM phase were all significantly increased.The sleep latency,sleep apnea,nighttime awakenings and the apnea hypopnea index(P<0.05)were significantly decreased in the treatment group.ConclusionsButylphthalide and sodium chloride injection combined together with aspirin and clopidogrel can effectively intervene in the progress of sleep disorder after cerebral infarction and improve the sleep structure.
butylphthalide;aspirin;clopidogrel;sleep disorder;sleep architecture;polysomnography
R743.33
A
10.3969/j.issn.1005-8982.2017.08.021
1005-8982(2017)08-0103-06
2016-10-24
赵凤丽,E-mail:fenglizhaovip@163.com

