稳消Ⅱ方对兔腹主动脉粥样硬化模型NF-κB P65蛋白表达的影响
生书萌,梁 荣,霍清萍
稳消Ⅱ方对兔腹主动脉粥样硬化模型NF-κB P65蛋白表达的影响
生书萌,梁 荣,霍清萍
目的 观察稳消Ⅱ方对兔动脉粥样硬化模型腹主动脉壁核因子-κB(NF-κB) P65蛋白表达的影响,探讨其抗动脉粥样硬化的作用机制。方法 将38只健康新西兰大白兔随机分为空白组(9只)和造模组(29只),分别给予标准饲料和高脂饲料。8周后,造模组随机处死1只兔子,确认造模成功。将造模组随机分为3组:稳消Ⅱ方组、辛伐他汀组、模型对照组,停用高脂饲料,改用标准饲料,分别给予稳消Ⅱ方、辛伐他汀、蒸馏水灌胃治疗8周,处死动物,采用免疫组化法观察NF-κB P65表达。结果 与模型对照组比较,稳消Ⅱ方组和辛伐他汀组NF-κBP65表达均显著下降,差异有统计学意义(P<0.05);干预前后稳消Ⅱ方组和辛伐他汀组同组比较,差异有统计学意义(P<0.05)。结论 稳消Ⅱ方可能通过抑制NF-κB P65表达防治和稳定动脉粥样硬化斑块,减少心脑血管病不良事件的发生。
动脉粥样硬化;稳消Ⅱ方;核因子-κB P65;兔
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症性反应的病理过程,以血管壁巨噬细胞源性泡沫细胞和大量趋化因子、细胞因子和生长因子堆积为主要特征。AS斑块破裂、血栓形成是导致急性心脑血管事件发生的主要原因,其发病机制复杂,炎症学说(in flammatory hypothesis)是AS发生机制的重要学说。核因子-κB(nuclear factor-kappa B,NF-κB)是一种具有调控多项基因转录调节作用的蛋白质,存在于血管内皮细胞、平滑肌细胞及单核-巨噬细胞中,参与多种与炎症反应有关基因的表达调控,在动脉粥样硬化病变形成过程起关键性的调控作用[1]。NF-κB活化被认为是AS的始动机制之一,研究其生物学特性并通过药理学作用调控,对防治动脉粥样硬化的发生发展具有重要临床意义。
中药稳消Ⅱ方是霍清萍教授治疗本病的经验方,具有通络活血、化瘀清热、行气化痰之功效。前期研究证实,稳消Ⅱ方可通过调节脂质代谢、抑制炎症反应、降低纤维蛋白原(fibrinogen,FIB)水平等发挥抗AS作用[2-8]。为了进一步探讨其作用机制,本实验通过喂饲高脂饲料方法建立兔AS模型,观察稳消Ⅱ方对实验兔动脉粥样硬化NF-κB信号通路的影响。现报道如下。
1 材料与方法
1.1 实验动物 38只体重2.2 kg~2.5 kg健康新西兰大白兔,月龄3个月~4个月,雌雄不限,购自上海松江车墩实验动物良种厂,饲养条件为2级,室温在22 ℃~24 ℃,相对湿度50%,光照时间07:00~17:00。
1.2 实验药物 高脂饲料:胆固醇1%,蛋黄粉5%,猪油3%,普通食料91%,由上海中医药大学动物实验中心加工而成。稳消Ⅱ方免煎颗粒:由水蛭、地龙、丹参、牡丹皮、郁金、半夏各药按3∶3∶3∶3∶3∶2比例混合组成,江阴天江药业有限公司代为生产,批号:1409050。辛伐他汀:商品名舒降之,默沙东公司产品,批号:130578。根据临床用药剂量[9],按人与动物体质量比例折算,折合实验兔用量:水蛭、地龙、丹参、丹皮、郁金各575 mg/kg,半夏383.33 mg/kg,辛伐他汀0.77 mg/kg,用蒸馏水溶解,混匀后灌胃。
1.3 实验试剂与仪器 实验试剂:NF-κB p65抗体:Life Span Bio Sciences公司;NF-κB免疫组化试剂盒:上海南溪生物有限公司; DAB显色试剂盒:DAKO公司。实验仪器:脱水机(JJ-12J)、包埋机(JB-P5):武汉俊杰电子有限公司;病理切片机(RM2016):上海徕卡仪器有限公司;冻台(JB-L5):武汉俊杰电子有限公司;组织摊片机(KD-P):浙江省金华市科迪仪器设备有限公司;烤箱(DHG-9140A):上海慧泰仪器制造有限公司;载玻片(80312-3181)、盖玻片(10212432C):江苏世泰实验器材有限公司;微波炉(MM823LA6-NS):美的微波电器制造有限公司;脱色摇床(WD-9405A):北京市六一仪器厂;涡旋混合器(TYXH-II):天悦电子;移液枪(KA0056573):Dragon;组化笔(GT1001):Gene tech;显微镜(XSP-C204):CIC;成像系统(Nikon DS-U3):日本尼康。
1.4 实验过程
1.4.1 分组、造模 动物饲养在本院实验动物中心,饲养条件为2级,室温在22 ℃~24 ℃,相对湿度50%,光照时间07:00~17:00。每只实验兔每日给予150 g标准饲料,观察7 d无异常后称重。采用随机分组法将其分为空白组(9只)和造模组(29只)。其中空白组继续标准饲料喂养,造模组给予高脂饲料每日100 g,余由标准饲料补足,均自由饮水。高脂饲料喂养至第8周末,在造模组随机处死实验兔1只,于腹主动脉至髂总动脉分叉处(以左右髂动脉分叉为参照)向上留取2 cm标本,进行石蜡切片,光镜下观察造模情况。实验兔动脉内膜可见乳白色或淡黄色、大小不等的弥漫性隆起脂纹、斑块;HE染色,光镜下可见广泛的泡沫细胞,证实造模成功。
1.4.2 药物干预 造模成功后,将造模组随机分为稳方Ⅱ组、辛伐他汀组、模型对照组。各组给予相应药物灌胃,停用高脂饲料,改为标准饲料饲养,饲养条件同前。
1.4.3 取材 实验第16周末,于取材前夜禁食禁水12 h,用戊巴比妥钠(1.3 mL/kg)麻醉实验兔,无菌条件下取腹主动脉标本。用0.9%氯化钠溶液轻轻冲洗后各留取1 cm置于4%多聚甲醛中固定,-40 ℃冻存。
1.5 观察项目及检测方法 采用免疫组织化学法检测NF-κB P65,实验步骤均按试剂盒说明书严格操作。每组内每张切片随机挑选3个200倍视野进行拍照。应用Image-Pro Plus6.0软件选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析得出每张照片阳性的累积光密度值(IOD),保存图片中组织的面积(AREA)及IOD/AREA(Mean Density),以Mean Density数值为最终观测结果。
2 结 果
2.1 一般情况 共34只兔完成实验。造模实验阶段:腹泻死亡1只;造模后随机处死1只观察造模情况;给药实验阶段:稳消Ⅱ方组肺炎死亡1只,模型组坏疽死亡1只;其余存活实验兔均能自由活动,状况良好。
2.2 各组兔NF-κB P65水平比较 模型对照组增厚的动脉内膜及中膜内可见大量的棕黄色颗粒状阳性染色物质,明显高于空白组(P<0.05);稳消Ⅱ方组动脉内膜及中膜内可见较多的棕黄色颗粒状阳性染色物质,较模型对照组明显降低(P<0.05);辛伐他汀组动脉内膜及中膜内可见较多的棕黄色颗粒状阳性染色物质,较模型对照组明显降低(P<0.05)。详见表1、图1。
表1 各组兔NF-κB P65水平比较(±s)
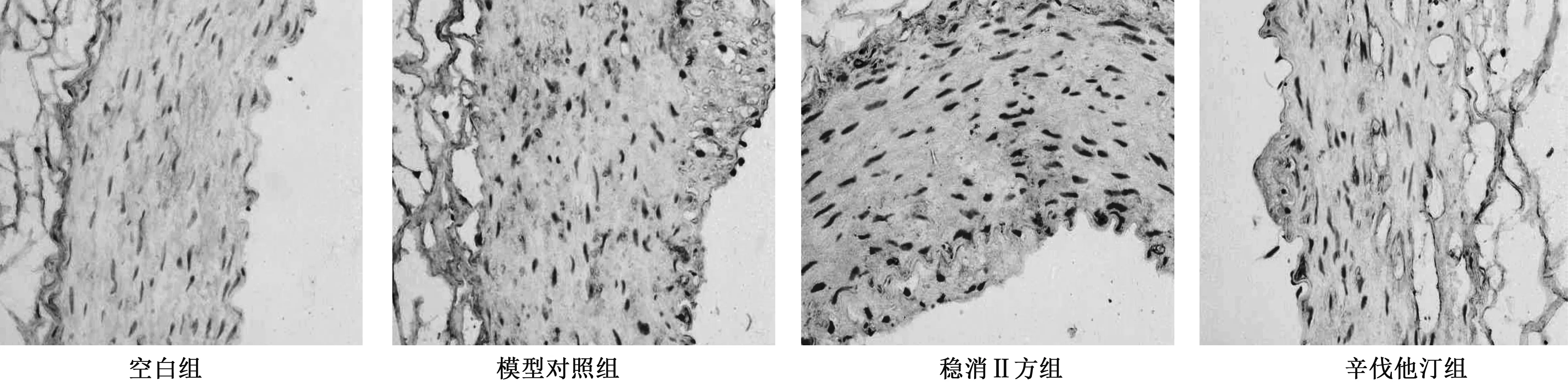
图1 各组NF-κB P65免疫组织化学染色(×200)
3 讨 论
炎症学说、内皮损伤学说是目前公认的AS发病学理论。NF-κB是细胞因子、黏附分子和生长因子间重要的联络因子,在AS形成起重要作用[8-9],可促进硬化斑块形成、生长和破裂,最终导致心脏病和脑卒中等疾病发生。
NF-κB/Rel家族成员主要包括:RelA(p65)、RelB、C-Rel、NF-κB1(p50)及NF-κB2(p52)[10]。NF-κB的活化形式为二聚体,NF-κB家族成员间可相互形成同源或异源二聚体,不同NF-κB/Rel蛋白二聚体具有各自独有特性,可识别不同DNA靶目标。在细胞发挥主要生理作用且丰富的二聚体是p50-p65异源二聚体,故通常一般将NF-κB定义为p50/p65异源二聚体。
细胞黏附分子、单核细胞趋化因子等炎症因子在AS炎症过程有重要作用,这些因子基因的启动子或增强子存在一个或多个κB序列,其活化受到NF-κB调控[11-13]。有研究证实,AS早期多种刺激因素作用于动脉壁造成内皮细胞受损,NF-κB激活启动靶基因转录,刺激下游相关基因表达,激发一系列级联式炎症反应,诱发动脉壁脂质聚集部位的炎症反应,NF-κB信号通路位于炎症反应轴心,是促进AS发生的共同通路[14-15]。大量实验研究结果显示,动脉粥样硬化斑块等疾病可通过调控NF-κB信号通路,减轻炎症反应取得满意疗效[16-20]。因此,NF-κB认为是一种治疗靶点,备受研究者关注。
中医治疗动脉粥样硬化历史悠久,认为本病与体虚、年老、劳累、情绪、饮食、气滞、瘀血、痰浊、寒侵等因素有关。霍清萍教授在长期临床实践中发现本病病人不但痰湿瘀滞,且蕴而化热者也颇多见,瘀、痰、热是产生AS斑块的主要病理因素。病机为本虚标实,在机体脏腑虚损、阴阳失衡、气血运行失利基础上,加之痰、瘀、毒的相互作用,终致疾病发生[21]。瘀热互结、痰浊凝聚为其重要的发病机制并据此创立活血通络、清热化瘀、祛痰化浊的稳消Ⅱ方。方中水蛭破血逐瘀消症,为君药;地龙通经活络,力专善走,周行全身,为臣药;辅以丹参、牡丹皮凉血活血化瘀,清血分之热,解淤积之毒;半夏燥湿化痰、消痞散结;郁金性辛,行周身气血以散瘀结,同时兼有凉血、清解郁热之效。全方共奏通络活血、化瘀清热、行气化痰之功,药专力强。
本研究发现,稳消Ⅱ方组及辛伐他汀组NF-κB均较模型对照组 P65表达明显下调(P<0.05)。本实验结果提示,稳消Ⅱ方及辛伐他汀均能抑制NF-κB P65水平表达,抑制炎症反应,达到稳定斑块作用,且稳消Ⅱ方抑制NF-κB P65的作用与辛伐他汀相近。由于本研究样本量有限,其结果有待扩大样本数量后进一步验证。
初步结果提示,稳消Ⅱ方通过下调NF-κB p65蛋白表达,抑制一系列炎性因子的释放,减缓动脉粥样硬化斑块的发生、发展,有益于动脉粥样硬化斑块的防治与稳定,减少心脑血管病不良事件发生。
[1] Orr AW,Hahn C,Blackman BR,et al.PAK signaling regulates oxidant-dependent NF-κB activation by flow[J].Circ Res,2008,103(6): 671- 679.
[2] 霍清萍,梁芳,王宇新,等.稳消颗粒对动脉粥样硬化模型兔血脂代谢的影响[C].济南:第十次全国中西医结合虚证与老年病学术会议暨山东中西医结合学会老年医学专业委员会2009年年会,2009:1-5.
[3] 梁芳,霍清萍,王宇新,等.稳消颗粒对兔实验性动脉粥样硬化血脂代谢的影响[J].现代中西医结合杂志,2011,20(31):3926-3927;3992.
[4] 霍清萍,梁芳,孔林,等.稳消颗粒对兔实验性动脉粥样硬化血清FIB和CRP表达的影响[J].中西医结合心脑血管病杂志,2010,8(12):1477-1479.
[5] 霍清萍,梁芳,李金菩,等.稳消颗粒对兔实验性动脉粥样硬化单核细胞趋化蛋白-1及肿瘤坏死因子α表达的影响[J].中国中医药信息杂志,2009,16(11):29-31.
[6] 刘含嫣,霍清萍,梁芳,等.稳消方对兔实验性颈动脉粥样硬化ICAM-1及VCAM-1表达的影响[J].中国中医药信息杂志,2011,18(7):43-45.
[7] 魏德芝.稳消颗粒对兔实验性颈动脉粥样硬化肿瘤坏死因子-α、白介素-6及脂质代谢的影响[D].上海:上海中医药大学,2013:1-44.
[8] 梁芳,马玉梅,魏德芝.稳消方对颈动脉粥样硬化不稳定斑块MCP-1、VCAM-1表达、脂质代谢、踝臂指数的影响[J].现代中西医结合杂志,2015,24(22):2400-2403.
[9] 徐叔云,卞如濂,陈修.药理实验方法学[M].北京:人民卫生出版社,1994:1049-1050.
[10] Auwardt RB,Mudge SJ,Chen C,et al.Inhibtion with antisense igonuchide suggest that Ikappa B-alpha does not form a negatire autoregulatory loop for NF-kappaB in mesangial cells[J].Exp Nephro,2000,8(3):144-151.
[11] Yoshimura S,Morishita R,HayashiK,et al.Inhibition of intimalhyperplasia after balloon injury in rat carotid artery model using ciselement‘decoy’of nuclear factor-kappa B binding site as a novel molecular strategy[J].Gene Ther,2001,8(21):1635-1642.
[12] Kwon HM,Sangiorgi G,Ritman EL,et al.Enhanced coronary vasavasorum neovascularization in experimental hypercholesterolemia[J].Clin Invest,1998,101(8):1551-1556.
[13] Semenza GL.HIF-1,O(2),and the 3 PHDs: how animal cells signal hypoxia to the nucleus[J].Cell,2001,107(1):1-3.
[14] Madonna R,De Caterina R.Relevance of new drug discovery to reduce NF-κB activation in cardiovascular disease[J].Vascul Pharmacol,2012,57(1):41.
[15] 杨先梅.动脉粥样硬化的发病机制研究[J].现代医药卫生,2013,29(18):2871-2872.
[16] 司秋菊,张艳慧,王鑫国,等.大黄庶虫虫丸对动脉粥样硬化鼠 NF-κB通路及炎性因子影响[J].中国实验方剂学杂志,2013,19(7):254-258.
[17] 栗艳婵,张明升.通心络胶囊对实验家兔动脉粥样硬化腹主动脉NF-κB的影响[J].临床合理用药,2011,4(4A):1-2.
[18] 杜雅薇,吴圣贤.解毒活血法对动脉粥样硬化斑块IκB-β/IκB-α/NF-κB信号通路的影响[J].中华中医药学刊,2013,31(5):999-1002.
[19] 王建新,沈晓君.丹参酮ⅡA 调控NF-κB通路抗动脉粥样硬化实验研究[J].河南中医,2013,33(5):681-683.
[20] 范丹丹,翟桂兰,祝焕林.牛磺酸对动脉粥样硬化兔NF-κB信号转导途径的影响[J].中国现代医学杂志,2013,23(17):30-34.
[21] 徐剑,李越华,李海涛,等.动脉粥样硬化的中医病因病机研究进展[J].四川中医,2013,31(5):149-150.
(本文编辑薛妮)
Effect of Wenxiao Ⅱ Granule on the Expression of NF-κB P65 in Experimental Atherosclerosis Rabbits
Sheng Shumeng,Liang Rong,Huo Qingping
The Sixth People's Hospital Affiliated to Shanghai Jiaotong University,Shanghai 200233,China
Huo Qingping
Objective To observe the effect of different dose of Wenxiao Ⅱ granule (WXG) on the expression of nuclear factor-kappa B(NF-κB) P65 in experimental atherosclerosis rabbits,and explore its mechanism in treating atherosclerosis.Methods Thirty-eignt New Zealand rabbits were randomly divided into blank group (n= 9) and model group (n= 29).After 8 weeks,a rabbit was randomly killed in model group to confirm model established successfully.Then rabbits in model group were divided into 3 subgroups:WXG group,simvastatin group and model control group.The rabbits in three subgroups were treated with WXG,simvastatin,distilled water, respectively and fed with the standard food for another 8 weeks.At the end of experiment,all the rabbits were sacrificed. The expression of NF-κB P65 was determined by immunohistochemistry staining. Results Compared with the model group,the levels of NF-κB P65 decreased in WXG group and simvastatin group(P<0.05).There was significant difference in the level of NF-κB P65 between pre and post treatment in WXG group and simvastatin group (P<0.05).Conclusion WXG can inhibit the expression of NF-κB P65,which may stabilize plaque of atherosclerosis,reduce incidence of adverse events of cardiovascular and cerebrovascular disease.
atherosclerosis;Wenxiao Ⅱ granule;nuclear factor-kappa B P65;rabbits
上海市卫生局中医药科研基金项目(No.2012L057A);上海市临床优势专科建设项目(No.ZYSNXD-YL-YSZK013);申康中医验方项目(No.SHDC12012409)
上海交通大学附属第六人民医院(上海 200233)
霍清萍,E-mail:huoqingping005@126.com
R543.5 R289.5
A
10.3969/j.issn.1672-1349.2017.08.008
1672-1349(2017)08-0928-04
2016-07-23)
引用信息:生书萌,梁荣,霍清萍.稳消Ⅱ方对兔腹主动脉粥样硬化模型NF-κB P65蛋白表达的影响[J].中西医结合心脑血管病杂志,2017,15(8):928-931.

