妊娠期高血压与胎儿先天性心脏病发病风险的meta分析
马 丽
兰州大学第二医院西固医院 兰州市西固区人民医院(甘肃兰州 730060)
·论 著·
妊娠期高血压与胎儿先天性心脏病发病风险的meta分析
马 丽
兰州大学第二医院西固医院 兰州市西固区人民医院(甘肃兰州 730060)
目的评价妊娠期高血压与胎儿先天性心脏发病的关系。方法通过数据库(PubMed、Elsevier和Web of Science)检索妊娠期高血压与胎儿先天性心脏病发病相关的文献。利用Stata软件对其进行综合分析。结果纳入13项病例对照和10项队列研究。妊娠期高血压增加胎儿先天性心脏病发病风险(RR=1.65,95%CI:1.50~1.83);亚组分析显示,妊娠期高血压治疗组和未治疗组,均会增加胎儿先天性心脏病发病风险(RR=2.11,95%CI:1.72~2.58;RR=1.61,95%CI:1.34~1.94);在高血压治疗组中,钙离子通道阻滞剂、肾上腺素受体阻滞剂和利尿剂不会增加胎儿先天性心脏病发病风险(P>0.05),β受体阻滞剂和血管紧张素转换酶抑制剂者均会增加胎儿先天性心脏病发病风险(P<0.05)。结论妊娠期高血压增加胎儿先天性心脏病发病风险。
妊娠期高血压; 先天性心脏病; 发病风险
先天性心脏病(congenital heart disease,CHD)是指胎儿时期心脏血管发育异常所致的心血管畸形,是儿童时期最常见的心脏病,所致死亡远远超过感染原因,每1 000例活产婴儿有6~12例发病[1]。据中国妇幼卫生监测数据显示,从2004年起CHD的发病率已升至出生缺陷第1位,且5岁儿童死因分析结果显示,CHD的死亡率居前2位[2]。尽管CHD有较高的发病率以及可能产生的严重后果,但是引起CHD的病因学仍然是未知的,母体肥胖、糖尿病、高血压和妊娠期不良行为被认为是先心病的危险因素[3]。有相关报道妊娠期高血压可以改变流向子宫的血流,可能会对胎儿造成严重影响,而大约有2%~10%孕妇患有高血压[4,5]。本研究通过对母孕期高血压与CHD的发病进行meta分析,探讨妊娠期高血压、不同药物治疗高血压和其他危险因素与CHD的发病关系,为CHD的病因学研究提供一定的理论依据。
1 资料与方法
1.1 资料来源
通过检索PubMed、Elsevier和Web of Science 数据库,收集文献至2016年8月1日公开发表的关于与母亲孕期高血压的文献,并结合文献追溯的方法,全面收集相关文献。使用主题词与自由词结方式检索并经过多次预检索后确定检索策略,主题词为:(hypertension,pregnancy-induced 或pregnancy或hypertension或antihypertensive agents或labetalol或adrenergic alphaantagonists或nifedipine或calcium channel blockers或angiotensin-converting enzyme inhibitors或preeclampsia或eclampsia)和 (congenital abnormalities或 heart defects,congenital 或 ductus arteriosus,patent或 pulmonary valve stenosis 或 heart septal defects,ventricular 或 aortic valve stenosis 或 tetralogy of fallot)。
文献纳入必须同时满足:①研究类型是病例对照或队列研究;②研究内容为妊娠期高血压与发病的相对危险度(RR)及其95%的可信区间(95% CI)或提供原始数据可以进行上述指标的计算;③对照的选择和病例的诊断有明确标准。排除标准:①重复报道;②综述类文献;③病例诊断不明确及研究结局数据不完整。
1.2 方法
1.2.1 质量评价与数据提取 按照纽卡斯尔-渥太华量表对纳入文献进行质量评价。该量表主要从三个方面评价纳入meta分析文献的质量:研究对象的选择,组间可比性,结局的测量。满分为9分。文献筛选和数据的提取均有两名作者完成,结果相矛盾的地方由两人讨论后达成一致。具体要提取的数据资料如下:①研究作者、发表年份;②纳入研究对象的人数;③结局事件及其发生的例数。
1.2.2 暴露和结局的定义 影响CHD的影响因素众多,本研究重点研究母亲妊娠期高血压对于患儿CHD的发病风险的研究,同时根据文献纳入了不同治疗药物等相关影响因素。CHD包括肺动脉瓣狭窄、主动脉瓣狭窄、房间隔缺损、室间隔缺损、法洛四联症等。
1.3 统计学分析
采用Stata 11及其glst命令完成,用Q值进行异质性检验,以I2值来评估纳入研究的异质性的大小;当I2<50%,采用固定效应模型,反之则采用随机效应模型,即将随机误差纳入考虑范围。评价分析结果的稳定性,必要时进行亚组分析和meta回归来排除异质性来源。为了评价潜在的发表偏倚,采用Begg法进行检验[6],当P>0.05,提示存在发表偏移的可能性较小。
2 结果
2.1 纳入文献的基本情况
通过数据库检索到文献总量为2 118篇,手动补充检索文献13篇,剔除重复后获得文献1 968篇;通过阅读题目和摘要,排除1 846篇,对符合条件的122篇文献进一步全文阅读,排除99篇(其中63篇无法获取有效数据;24篇研究结局指标不符合;12篇为综述或系统评价文献)后,最终23篇文献,共9 830 490例研究对象纳入研究[4,6-27]。见图1。
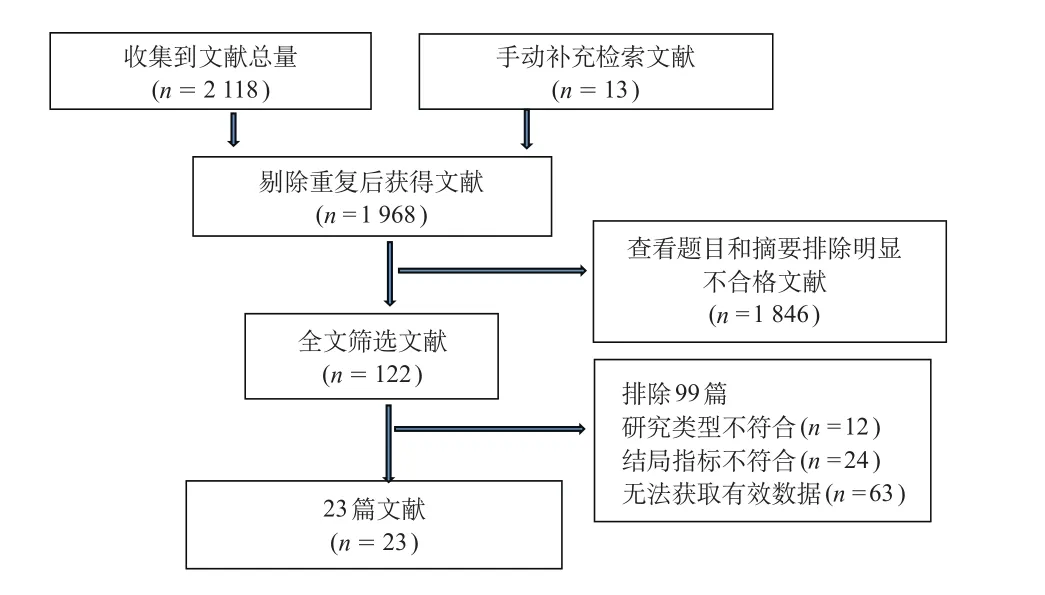
图1 文献筛选流程图
2.2 异质性检验及meta分析结果
经异质性检验,23篇文献存在异质性(I2=79.5%,P<0.001),故采用随机效应模型计算妊娠期高血压与CHD发病风险的合并效应(RR=1.65,95% CI:1.50~1.83),可以认为妊娠期高血压可以增加CHD的发病风险,是妊娠期未患高血压所育婴儿的1.65倍。见图2。
2.3 妊娠高血压与CHD发病风险的样本量分析
对样本量进行分层,样本量≤200例,各项研究之间存在统计学异质性,因此采用随机效应模型进行分析(RR=2.45,95% CI:0.70~8.65);样本量>200例,各项研究之间存在统计学异质性,因此采用随机效应模型进行分析(RR=1.63,95% CI:1.48~1.80)。两者之间差异存在统计学意义(P<0.05),提示纳入研究样本量会对妊娠期高血压与先心病发病风险相关性产生影响。见表1。
2.4 妊娠高血压治疗与CHD发病风险的分析
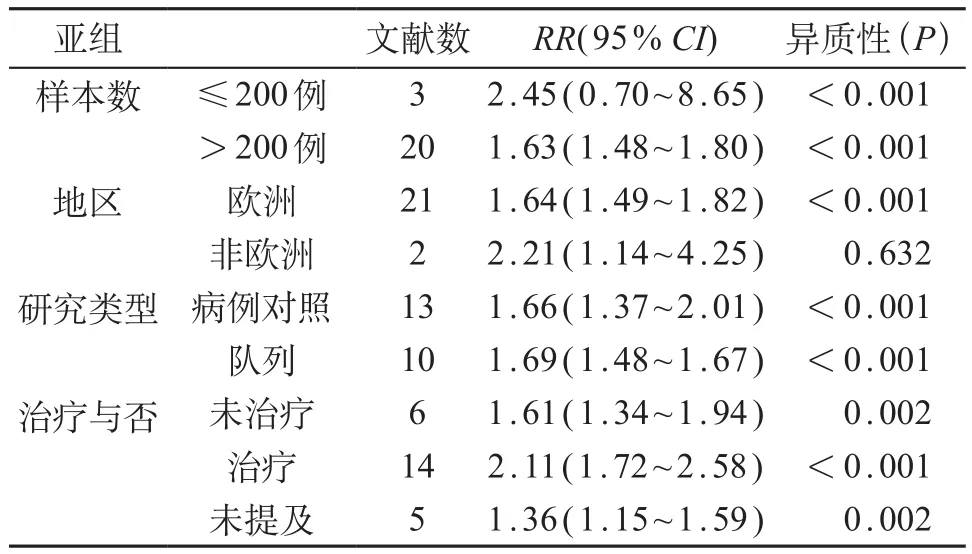
表1 妊娠高血压与CHD病发病风险的亚组分析
对于治疗与否进行分层,治疗时,各项研究之间存在统计学异质性,因此采用随机效应模型进行分析(RR=2.11,95%CI:1.72~2.58);未治疗时,各项研究之间存在统计学异质性,采用随机效应模型进行分析(RR=1.61,95%CI:1.34~1.94);未提及治疗时,各项研究之间存在统计学异质性,采用随机效应模型进行分析(RR=1.36,95%CI:1.15~1.59)。亚组之间存在统计学差异(P<0.05),并且治疗时,妊娠期高血压增加CHD发病风险的可能性相对较大。可能提示妊娠期高血压的严重程度会对CHD发病风险产生影响。
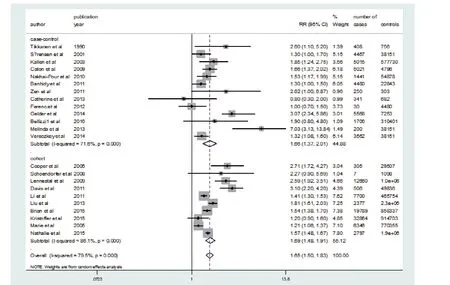
图2 妊娠期高血压增加先天性心脏病的发病风险
2.5 妊娠期高血压与不同CHD亚型的发病风险
4篇文献涉及到妊娠期高血压与室间隔缺损,各项研究之间存在统计学异质性,采用随机效应模型进行分析(RR=2.05,95%CI:1.12~3.73);6篇文献涉及到妊娠期高血压与房间隔缺损,各项研究之间存在统计学异质性,采用随机效应模型进行分析(RR=2.25,95%CI:1.35~3.74);5篇文献涉及到妊娠期高血压与主动脉瓣狭窄,各项研究之间无统计学异质性,因此采用固定效应模型进行分析(RR=1.48,95%CI:1.16~1.89);2篇文献涉及到妊娠期高血压与法洛四联症,各项研究之间无统计学异质性,因此采用固定效应模型进行分析(RR=1.60,95%CI:1.09~2.50);1篇文献涉及到妊娠期高血压与肺动脉瓣狭窄,采用固定效应模型进行分析(RR=2.60,95%CI:1.30~5.40)。结果提示,妊娠期高血压会不同程度增加CHD不同亚型的发病风险,且在肺动脉瓣狭窄、房间隔缺损和室间隔缺损分型中风险较高。见表2。
2.6 不同药物治疗妊娠高血压后CHD的发病风险
5篇文献包含使用钙离子通道阻滞剂降压与CHD的研究,各项研究之间无统计学异质性,采用固定效应模型进行分析(RR=1.13,95%CI:0.72~1.77),差异无统计学意义,提示妊娠期高血压,使用钙离子通道阻滞剂降压不会增加CHD的发病风险;5篇文献包含使用β受体阻滞剂降压与CHD关系的研究,各项研究之间有统计学异质性,采用随机效应模型进行分析(RR=1.95,95%CI:1.01~3.75),差异有统计学意义,提示妊娠期高血压,使用β受体阻滞剂降压会增加CHD的发病风险;5篇文献包含使用血管紧张素转化酶抑制剂降压与CHD的研究,各项研究之间无统计学异质性,采用固定效应模型进行分析(RR=1.54,95% CI:1.08~2.21),差异有统计学意义,提示妊娠期高血压,使用血管紧张素转化酶抑制剂降压会增加CHD的发病风险。提示妊娠期高血压药物的使用会对CHD的发病风险产生影响。见表3。
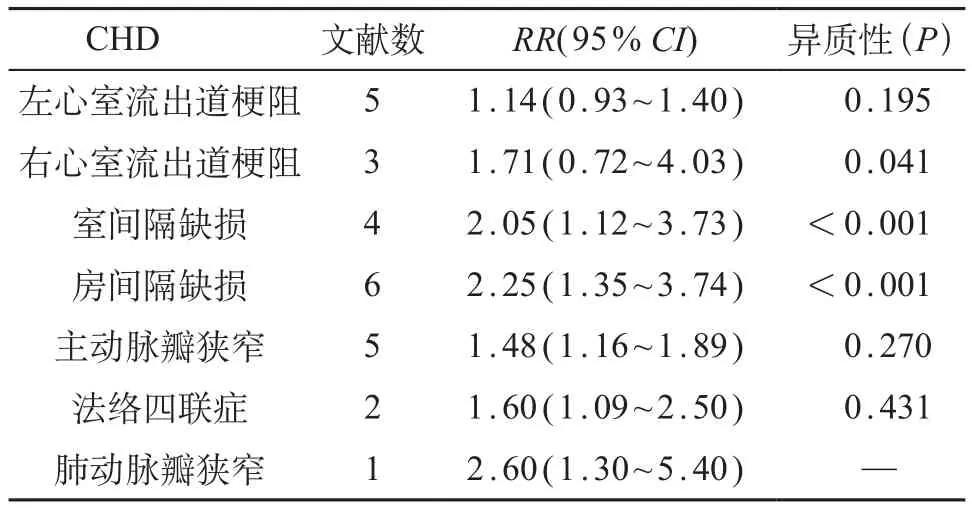
表2 妊娠高血压与不同CHD亚型的发病风险
2.7 发表偏移
采用Begg法对潜在的发表偏倚进行检测,漏斗图结果显示大部分研究的效应点分布集中在一定区域内,呈基本对称,且P=0.132,提示存在发表偏倚的可能性较小。

表3 不同药物治疗妊娠高血压后天性心脏病的发病风险
3 讨论
CHD是目前最常见的一种出生缺陷,有严重的临床表现,且并发症较多,严重威胁患儿的生命。虽然国内外一直对其进行研究,但其病因至今尚未明确。本文对国外发表的高质量文献进行meta分析,通过调整混杂因素,进行不同亚组分析,结果显示妊娠期高血压增加CHD及其亚型发病的风险,是它的危险因素,其发病风险为非妊娠期高血压的1.65倍;妊娠期高血压药物治疗中,钙离子通道阻滞剂、肾上腺素受体阻滞剂和利尿剂不会增加CHD的发病风险,β受体阻滞剂和血管紧张素转化酶抑制剂可能会增加CHD的发病风险。然而,到底是降压药物的使用导致了胎儿CHD的发生还是母体潜在的高血压导致了胎儿的CHD,存在混杂,其结果有待于大样本前瞻性队列研究证实。
本研究发现妊娠期高血压增加CHD的发病风险(RR=1.65,95% CI:1.50~1.91)。有研究显示妊娠期高血压患者发生出生缺陷、早产等不良出生结局的危险性高[28]。相关研究发现妊娠期高血压是CHD发病的危险因素(RR=1.81,95%CI:1.61~2.03)[19],与本研究一致。进一步对妊娠期高血压治疗与否进行亚组分析,结果显示治疗组发病风险(RR=2.11)高于未治疗组(RR=1.61)。
有研究发现妊娠期药物的使用会增加CHD发病风险[29]。因此,本研究对妊娠期不同降压药的使用进行了亚组分析,结果显示β受体阻滞剂和血管紧张素转化酶抑制剂会增加CHD的发病风险(RR=1.95,95% CI:1.01~3.75;RR=1.54,95% CI:1.08~2.21),相关研究发现使用β受体阻滞剂较未使用会增加CHD的发病风险(RR=2.60,95% CI:1.20~5.30)[4],也与本研究结果一致。妊娠期高血压使孕妇全身小动脉痉挛,胎盘微血管生成血栓,导致绒毛膜栓塞或坏死,胎盘和子宫血流量明显减少,胎盘功能受损,胎儿对氧气和营养物质的摄取量减少,从而影响宫内胎儿的正常发育,导致CHD的发生[4,30]。另有研究发现在妊娠期高血压早期使用血管紧张素转化酶抑制剂是不安全的,应该避免使用,它会增加CHD的发病风险(RR=2.71,95% CI:1.72~4.27)[21],这也支持本研究的结论。血管紧张素转化酶抑制剂在早期胚胎的心、脑和肾组织中发挥主要作用[31,32]。在老鼠致畸实验中,染色体3q作为血管紧张素转换酶抑制剂的作用位点,增加小鼠室间隔缺损风险,同时血管紧张素转换酶抑制剂在个体的心室隔膜发挥作用[33]。血管紧张素转换酶抑制剂扩增胎儿动脉导管中的心室平滑肌细胞,可能会导致动脉导管未闭[32]。
综上所述,CHD的发生可能与妊娠期高血压、高血压用药等有关,为降低CHD的发病率,应加强健康教育,增强孕期保健意识,重视产前检查,早期发现CHD的危险因素,及早干预,降低发病风险。
[1] Botto LD, Correa A, Erickson JD. Racial and temporal variations in the prevalence of heart defects [J]. Pediatrics, 2001, 107(3): E32.
[2] 中华人民共和国卫生部. 2009中国卫生统计年鉴[M]. 中国协和医科大学出版社; 2009.
[3] Botto LD, Lin AE, Riehle CT, et al. Seeking causes:classifying and evaluating congenital heart defects in etiologic studies [J]. Birth Defects Res A, 2007, 79(10): 714-727.
[4] Alissa RC, Erin MB, Charlotte MD, et al. Antihypertensive medication use during pregnancy and the risk of cardiovascular malformations [J]. Hypertension, 2009, 54(1): 63-70.
[5] Lawler J, Osman M, Shelton JA, et al. Population-based analysis of hypertensive disorders in pregnancy [J]. Hypertens Pregnancy, 2009, 26(1): 67-76.
[6] Auger N, Fraser WD, Healyprofitós J, et al. Association between preeclampsia and congenital heart defects [J]. JAMA, 2015, 314(15): 1588-1598.
[7] Bánhidy F, Ács N, Puhó EH, et al. Chronic hypertension with related drug treatment of pregnant women and congenital abnormalities in their offspring: a population-based study [J]. Hypertens Res, 2011, 34(2): 257-263.
[8] Bánhidy F, Szilasi M, Czeizel AE. Association of preeclampsia with or without superimposed chronic hypertension in pregnant women with the risk of congenital abnormalities in their offspring: a population-based case-control study [J]. Eur J Obstet Gynecol Reprod Biol, 2012, 163(1): 17-21.
[9] Bateman BT, Huybrechts KF, Fischer MA, et al. Chronic hypertension in pregnancy and the risk of congenital malformations: a cohort study [J]. Am J Obstet Gynecol, 2015, 212(3): 337.
[10] Bellizzi S, Ali MM, Abalos E, et al. Are hypertensive disorders in pregnancy associated with congenital malformations in offspring? Evidence from the WHO multicountry cross sectional survey on maternal and newborn health [J]. BMC Pregnancy Childb, 2016, 16(1): 198.
[11] Brodwall K, Leirgul E, Greve G, et al. Possible common aetiology behind maternal preeclampsia and congenital heart defects in the child: a Cardiovascular Diseases in Norway Project Study [J]. Paediatr Perinat Epidemiol, 2015, 30(1):76-85.
[12] Cedergren MI, Källén BAJ. Obstetric outcome of 6346 pregnancies with infants affected by congenital heart defects [J]. Eur J Obstet Gynecol Reprod Biol, 2006, 125(2):211-216.
[13] Csáky-Szunyogh M, Vereczkey A, Gerencsér B, et al. Maternal hypertension with nifedipine treatment associated with a higher risk for right-sided obstructive defects of the heart: a population-based case-control study [J]. Heart Asia, 2014, 6(1): 3-7.
[14] Davis RL, Eastman D, Mcphillips H, et al. Risks of congenital malformations and perinatal events among infants exposed to calcium channel and beta-blockers during pregnancy [J]. Pharmacoepidemiol Drug Saf, 2011, 20(2): 138-145.
[15] Gelder MV, Bennekom CV, Louik C, et al. Maternal hypertensive disorders, antihypertensive medication use, and the risk of birth defects: a case-control study [J]. BJOG, 2015, 122(7): 1002-1009.
[16] Källén BAJ, Olausson PO. Maternal drug use in early pregnancy and infant cardiovascular defect [J]. Reprod Toxicol, 2003, 17(3): 255-261.
[17] Lennestål R, Olausson PO, Källén B. Maternal use of antihypertensive drugs in early pregnancy and delivery outcome, notably the presence of congenital heart defects in the infants [J]. Eur J ClinPharmacol, 2009, 65(6): 615-625.
[18] Li DK, Yang C, Andrade S, et al. Maternal exposure to angiotensin converting enzyme inhibitors in the fi rst trimester and risk of malformations in offspring: a retrospective cohort study [J]. BMJ, 2011, 343: d5931-d5941.
[19] Liu S, Joseph KS, Lisonkova S, et al. Association between maternal chronic conditions and congenital heart defects: a population-based cohort study [J]. Circulation, 2013, 128(6):583-589.
[20] Nakhai-Pour HR, Rey E, Bérard A. Antihypertensive medication use during pregnancy and the risk of major congenital malformations or small-for-gestational-age newborns [J]. Birth Defects Res B Dev Reprod Toxicol, 2010, 89(2): 147-154.
[21] Cooper WO, Hernandez-Diaz S, Arbogast PG, et al. Major congenital malformations after first-trimester exposure to ACE inhibitors [J]. New Engl J Med, 2006, 354(23): 2443-2451.
[22] Sørensen HT, Czeizel AE, Rockenbauer M, et al. The risk of limb deficiencies and other congenital abnormalities in children exposed in utero to calcium channel blockers [J]. Acta Obstet Gynecol Scand, 2001, 80(5): 397-401.
[23] Tikkanen J, Heinonen OP. Risk factors for cardiovascular malformations in Finland [J]. Eur J Epidemiol, 1990, 6(4):348-356.
[24] Vasilakis-Scaramozza C, Aschengrau A, Cabral HJ, et al. Antihypertensive drugs and the risk of congenital anomalies [J]. Pharmacotherapy, 2013, 33(5): 476-482.
[25] Vereczkey A, Gerencsér B, Czeizel AE, et al. Association of certain chronic maternal diseases with the risk of speci fi c congenital heart defects: a population-based study [J]. Eur J Obstet Gynecol Reprod Biol, 2014, 182: 1-6.
[26] Weber-Schoendorfer C, Hannemann D, Meister R, et al. The safety of calcium channel blockers during pregnancy:A prospective, multicenter, observational study [J]. Reprod Toxicol, 2008, 26(1): 24-30.
[27] Zen TD, Rosa RFM, Zen PRG, et al. Gestational and family risk factors for carriers of congenital heart defects in southern Brazil [J]. PediatrInt, 2011, 53(4): 551-557.
[28] 冯永亮, 彭婷婷, 王芳, 等. 妊娠期高血压疾病对出生结局的影响及相关因素[J]. 中华疾病控制杂志, 2014, 18(2):131-134.
[29] 侯佳, 桂永浩, 奚立, 等. 先天性心脏病环境危险因素的病例对照研究[J]. 复旦学报(医学版), 2007, 34(5):652-655.
[30] Alwan S, Polifka JE, Friedman JM. Angiotensin II receptor antagonist treatment during pregnancy [J]. Birth Defects Res A Clin Mol Teratol, 2005, 73(2): 123-130.
[31] Hu F, Morrissey P, Yao J, et al. Development of AT(1) and AT(2) receptors in the ovine fetal brain [J]. Dev Brain Res, 2004, 150(1): 51-61.
[32] Burrell JH, Hegarty BD, Mcmullen JR, et al. Effects of gestation on ovine fetal and maternal angiotensin receptor subtypes in the heart and major blood vessels [J]. Exp Physiol, 2001, 86(1): 71-82.
[33] Tsuchida S, Matsusaka T, Chen X, et al. Murine double nullizygotes of the angiotensin type 1A and 1B receptor genes duplicate severe abnormal phenotypes of angiotensinogen nullizygotes [J]. J Clin Invest, 2011, 101(4): 755-760.
Meta-analysis of pregnancy induced hypertension with risk of morbidity in congenital heart diseases
MA Li
(Department of Pediatrics, Xigu Hospital, The Second Hospital of Lanzhou University, Lanzhou,730060, Gansu, China)
ObjectiveSystematical evaluation of studies published abroad on pregnancy induced hypertension and incidence of congenital heart diseases (CHDs), to investigate the relationship between pregnancy induced hypertension and the risk of CHDs morbidity.MethodsStudies of pregnancy induced hypertension and CHDs were identi fi ed by searching major electronic databases (PubMed, Elsevier and Web of Science) by the medical subject headings and keywords without language restriction. Stata was conducted to determine the risk of CHDs related to pregnancies induced hypertension.ResultsThirteen (13) case-control and 10 cohort studies were identi fi ed. Pregnancy induced hypertension was associated with an increased risk of CHDs morbidity (RR=1.65,95%CI: 1.50~1.83). Subgroup analysis showed that both of the pregnancy hypertension treated group and the untreated group increased the risk of CHDs morbidity (RR=2.11,95% CI: 1.72~2.58; RR=1.61,95% CI:1.34~1.94). Calcium channel blockers, adrenergic receptor blockers and diuretics did not increase the risk of CHDs morbidity (P>0.05), β-blockers and angiotensin-converting enzyme inhibitor increased the risk of CHDs morbidity (P<0.05).ConclusionsPregnancies induced hypertension increased risk of CHDs morbidity.
pregnancy induced hypertension; congenital heart disease; risk of morbidity
10.3969/j.issn.1000-3606.2017.05.013
2016-09-02)
(本文编辑:邹 强)
马丽 电子信箱:1308303956@qq.com

