嗜酸性粒细胞在特应性皮炎发病中的作用与机制
徐倩玥综述 余 红审校
上海交通大学医学院附属新华医院皮肤科(上海 200092)
·文献综述·
嗜酸性粒细胞在特应性皮炎发病中的作用与机制
徐倩玥综述 余 红审校
上海交通大学医学院附属新华医院皮肤科(上海 200092)
特应性皮炎(AD)是慢性复发性炎症性皮肤病。已有大量研究表明,嗜酸性粒细胞(EOS)与AD发病有重要关联。EOS主要在由Th2细胞介导的免疫反应分泌的细胞因子和趋化因子的作用下,活化、分化和增长,从骨髓和血液中迁移到真皮层,分泌颗粒蛋白、细胞因子等炎症递质,造成胶原沉积和皮肤增厚等改变。文章概述了EOS在AD发病中的主要作用与机制,以期对AD的发病有更深入的认识,也望对新药研发提供思路。
特应性皮炎; 嗜酸性粒细胞; 发病机制; Th2细胞; 细胞因子类
特应性皮炎(atopic dermatitis)是一种慢性复发性炎症性皮肤病。过去的30年里,全球特应性皮炎的发病率呈显著增长,目前发达国家患病率约10%~20%[1],在我国1~7岁儿童中的患病率为12.94%[2]。严重的特应性皮炎会使患者的生活质量受到很大影响,比如剧烈瘙痒而无法入眠等。特应性皮炎的发病机制复杂,目前认为,皮肤屏障破坏促进了外界抗原的刺激,主要激活Th2细胞介导的免疫反应,产生了一系列细胞因子和趋化因子,包括IL-5、IL-3、粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)、IL-4、IL-13、IL-25等[3]。这些细胞因子在嗜酸性粒细胞(eosinophil,EOS)的增长、活化和分化中起到重要作用。特应性皮炎患者外周血和皮损处的EOS及其分泌的颗粒蛋白和细胞因子的数量均有所增加,且与疾病的严重程度有关。
1 嗜酸性粒细胞在特应性皮炎中的作用
伊红染料结合碱性颗粒蛋白形成的红色斑点是EOS区别于其他白细胞的重要特征[4]。EOS具有抵抗病原体感染的作用,比如能在皮肤中产生胞外DNA诱捕网(extracellular DNA traps,EET)杀灭病原菌;EOS在趋化因子等的作用下从骨髓和血液中迁移到炎症反应部位,分泌一系列炎性和促纤维化的递质,包括细胞毒性颗粒蛋白、细胞因子、酶、脂质递质、氧化代谢产物、白三烯等,引起特应性皮炎的免疫病理损伤,并启动组织的修复反应和组织重构,促进成纤维细胞合成胶原,导致胶原沉积和皮肤增厚,加速特应性皮炎进展;EOS还能分泌与肥大细胞、T淋巴细胞、巨噬细胞、角质形成细胞等细胞激活和功能相关的细胞因子,调节特应性皮炎的免疫反应;EOS与特应性皮炎的瘙痒可能有一定间接联系[5]。
食物、花粉、尘螨、微生物等的致敏,会引起血液中EOS的增加,并与特应性皮炎的严重程度密切相关。有研究以特应性皮炎积分(SCORAD)作为评价疾病严重程度的指标,发现在重度特应性皮炎患者中,EOS的数量高于轻至中度患者[6]。有学者认为,EOS可作为特应性皮炎食物过敏的一个预测指标,血液中EOS增多是重症特应性皮炎的危险因素之一[7]。
近来发现,金黄色葡萄球菌(Staphylococcusaureus,SA)在特应性皮炎的发病和慢性化中起到重要作用,并与EOS有一定关联。SA主要产生肠毒素B(staphylococcal enterotoxin B,SEB)、A蛋白(protein A,PtA)和中毒休克综合征毒素等三种外毒素,具有超抗原特性,有减少EOS凋亡,诱导EOS脱颗粒,释放细胞毒性颗粒蛋白的作用。此外,SA肽聚糖(peptidoglycan,PGN)能上调细胞表面相关受体的表达,刺激EOS活化[8]。研究发现,特应性皮炎患者的皮损处有大量EOS相关的CD48的表达,CD48是一种糖基磷脂酰肌醇靶受体,属于CD2家族,SA及其外毒素能增强EOS表达CD48以及EOS的活化和信号转导等,CD48在EOS脱颗粒、释放IL-10、IL-8等炎症递质中起到重要作用,被认为是新的特应性皮炎等过敏性疾病的治疗靶点[9]。另有研究发现,EOS能表达SA相关模式识别受体(pattern recognition receptors,PRR),包括核苷酸结合寡聚化结构域蛋白2(nucleotide-binding oligomerization domain-containing protein 2,NOD2)和Toll样受体2(toll-like receptor 2,TLR2)[10]。在真皮成纤维细胞与EOS共培养时,SA通过NOD2/TLR2作用使得EOS产生一系列细胞因子和趋化因子,成纤维细胞上的细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)的表达增加,造成特应性皮炎炎性皮损[11]。
2 嗜酸性粒细胞在特应性皮炎发病中的作用机制
2.1 影响EOS生成的细胞因子
EOS来源于骨髓造血干细胞,在血细胞生成过程中,髓样祖细胞生成CD34+ IL-5Rα+ EOS祖细胞,其分化受到IL-3、GM-CSF和IL-5的影响[3]。其中IL-5是最具EOS特异性的细胞因子。Th2通过调节EOS生长因子IL-5,促进EOS合成、抑制其凋亡,对于EOS的增殖、活化和趋化有重要作用。IL-5基因敲除的小鼠模型中,特应性皮炎皮损处EOS的浸润减少并且表皮与真皮的增厚减少。治疗有研究将IL-5抗体美泊利单抗(Mepolizumab)用于特应性皮炎患者,其减少了血液中EOS的数量,但临床效果却并不明显[12],还有待进一步的探究。
2.2 趋化嗜酸性粒细胞的炎症递质
在特应性皮炎的发病中,各种细胞包括淋巴细胞、成纤维细胞、巨噬细胞、嗜碱性粒细胞和EOS自身等都能产生趋化EOS的炎症递质,从而使EOS从血液向真皮层迁移,加剧特应性皮炎皮损 (图1) 。
2.2.1 嗜酸性粒细胞趋化因子 EOS趋化因子(eotaxin,Eot)能使EOS向炎症反应区迁移。趋化因子是相对分子质量为8 000~10 000的小蛋白质,与白细胞的选择和迁移有关。目前认为,Eot家族主要分为eotaxin -1/CCL11、eotaxin -2 /CCL24和 eotaxin -3/ CCL26三类。大量细胞包括淋巴细胞、巨噬细胞、真皮成纤维细胞、角质形成细胞以及EOS自身都能合成Eot-3,其又能被IL-4和肿瘤坏死因子-α(TNF-α)等刺激产生[13]。这三类Eot都能结合并激活EOS趋化因子受体3(CCR3),即EOS膜上的G蛋白耦联受体,从而诱导EOS脱颗粒和上调黏附分子的表达,抑制Eot和CCR3已成为药物研发的新位点。
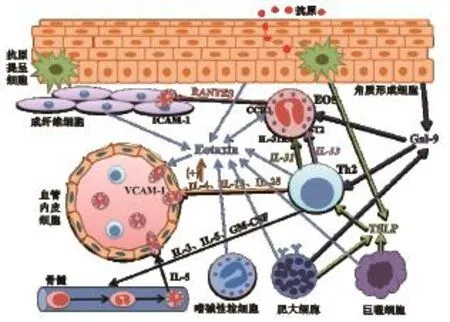
图1 趋化EOS的炎症递质在AD发病中的机制图
2.2.2 CCL5/RANTES CCL5/RANTES是EOS和淋巴细胞等的趋化因子,也可由EOS自身分泌产生,能介导EOS浸润真皮成纤维细胞层,对于急性和慢性皮损都有作用。另外,表皮角质形成细胞在受到搔抓后,会产生促炎因子TNF-α等,在TNF-α或IFN-γ的介导下会增加CCL5的产生[14]。
2.2.3 半乳糖凝集素-9 研究发现,半乳糖凝集素-9(galectin-9,Gal-9)在特应性皮炎患者的外周血和皮损处均高于正常对照组,且与皮损面积和严重程度相关[15]。Gal-9主要来源于表皮角质形成细胞和肥大细胞,具有趋化EOS的作用,还能调节T细胞的平衡,降低Th1和Th17细胞并增加Th2的数目,从而加重特应性皮炎,抑制Gal-9有望成为治疗特应性皮炎的一种新方法。
2.2.4 IL-4和IL-13 Th2细胞因子IL-13和IL-4,通过诱导趋化因子的表达,调节EOS迁移到炎症反应处的关键因子。IL-4和IL-13能上调成纤维细胞合成胶原,并能通过上调血管内皮细胞黏附因子(vascular cell adhesion molecule 1,VCAM-1),从而将EOS迁移至炎症反应处,起到间接促进胶原沉积的作用[3]。
2.2.5 IL-31和IL-33 IL-31是新发现的Th2细胞因子,IL-31的过表达会引起瘙痒和特应性皮炎皮损,并与疾病的严重程度相关。有研究发现EOS自身也能分泌大量IL-31,甚至超过CD4+Th细胞分泌IL-31的数量,SA产生的SEB能诱导IL-31的分泌[16]。IL-33是IL-1家族中的一员,包括IL-1β和IL-18[17],两者皆在特应性皮炎炎症受损处发现。EOS表达IL-31的受体A(IL-31 receptor A,IL-31RA)和IL-33的受体ST2。IL-31RA和ST2在真皮成纤维细胞的表面也有表达。IL-31作用于IL-31RA,从而趋化EOS,这一作用与诱导EOS表面表达黏附分子CD18有关,也与CCL26的释放增加有关[16]。 研究发现,IL-31和IL-33在EOS与成纤维细胞共培养时能刺激两者分泌数以百倍的促炎因子IL-6和特应性皮炎相关的趋化因子CXCL1、CXCL8、CXCL10、CCL2和CCL5[18]。其中,EOS被发现是释放CCL5的主要来源,而成纤维细胞是IL-6、CCL2、CXCL1、CXCL8和CXCL10的主要来源。在IL-31和IL-33的刺激下,EOS和成纤维细胞表面ICAM-1的表达有所上调,参与EOS的活化和黏附以及IL-6等趋化因子的释放。IL-31和IL-33有望成为治疗特应性皮炎的新靶点。
2.2.6 胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP) TSLP在过敏性炎症反应中有重要作用,主要由非造血细胞生成,也可由巨噬细胞、肥大细胞和树突状细胞分泌。TSLP能诱导Th2细胞因子IL-4、IL-5和IL-13等的产生。TSLP能诱导L-plastin磷酸化,在特应性皮炎中有所增加,并促进EOS的迁移,可能是通过蛋白激酶C(protein kinase C,PKC)信号通路起作用[19]。作用于TSLP和L-plastin的药物有望成为过敏性疾病的新靶点。
2.3 嗜酸性粒细胞的分泌产物
成熟EOS的颗粒中储存有细胞毒性颗粒蛋白,以及一系列的细胞因子、趋化因子、酶和生长因子等,EOS也能通过激活释放新合成的递质等。
2.3.1 颗粒蛋白 EOS颗粒内包含许多阳离子蛋白,其中主要由四种蛋白组成:位于核心的主要碱性蛋白(major basic protein,MBP),四周包围的EOS过氧化物酶(eosinophil peroxidise,EPO)、EOS来源神经毒素(eosinophil derived neurotoxin,EDN)和EOS阳离子蛋白(eosinophil cationic protein,ECP)。血清和尿液中EOS颗粒蛋白的测定,逐渐成为反映特应性皮炎患者炎症反应的指标[4]。其中,ECP是一种核糖核酸酶,具有细胞毒性、神经毒性,促纤维化、免疫调节功能,以及直接对抗寄生虫、细菌和病毒感染等作用。无论是成人还是儿童特应性皮炎,ECP水平均有升高,常被用来监测特应性皮炎等过敏性疾病的活动程度。ECP与临床症状严重程度高度相关,比如苔癣样变、睡眠不足、红斑、丘疹、瘙痒和抓痕等,且高于与血清总IgE水平的相关程度[20]。另外,EOS能产生EET,主要由线粒体DNA和ECP、MBP等颗粒蛋白共同组成,能结合并杀死病原菌,在感染性皮肤病和免疫性皮肤病中皆有发现,但其具体作用机制仍不明确[21]。
2.3.2 IL-12 在特应性皮炎炎症反应急性期,由Th2细胞主导,进入慢性期后,则由Th1细胞免疫反应为主。EOS的产物IL-12能促进Th2细胞向Th1细胞转化,从而使疾病慢性化[22]。
2.3.3 白三烯C4 已有研究发现,EOS能产生白三烯C4(leukotriene C4,LTC4),LTC4能通过半胱氨酰白三烯受体2(cysteinyl leukotriene receptor 2,CysLT2R)直接诱导成纤维细胞合成胶原纤维,并能促进成纤维细胞分泌角质形成细胞生长因子,包括IL-6和GM-CSF等,间接促进角质形成细胞增殖[23],阻断LTC4和CysLT2R有望对特应性皮炎的皮肤增厚有改善作用。
2.3.4 脑源性神经营养因子(brain-derived neurotrophic factor,BDNF) 有研究发现,特应性皮炎患者血清中的BDNF显著增高,并与疾病的活动程度、血清ECP水平以及血清总IgE相关,BDNF可能起到调节神经免疫的作用,与Th2细胞无关,主要是通过EOS介导,EOS能释放并生成BDNF,BDNF又能诱导EOS的趋化并抑制EOS的凋亡。特应性皮炎患者的EOS上表达的BDNF的受体也明显增加,包括全神经营养因子受体p75NTR以及酪氨酸激酶TrkB。BDNF能诱导神经轴突生长,是否能对特应性皮炎起到神经生长作用仍有待进一步研究[24]。
2.3.5 其他激活产物 许多细胞包括EOS激活后都能产生间质金属蛋白酶(matrix metalloproteinases,MMPs)和金属蛋白酶组织抑制剂(metalloproteinases tissue inhibitors,TIMPs),MMPs能降解细胞外基质成分,TIMPs能抑制蛋白降解,两者之间平衡的打破造成细胞外基质降解或组织纤维化,加重特应性皮炎[25]。另外,EOS激活还能新合成IL-4、TGF-β、TGF-α、IL-6、IL-10、IL-35、脂质递质、线粒体DNA等[22],刺激适应性免疫反应,加剧特应性皮炎炎症反应。
2.4 嗜酸性粒细胞相关基因与信号通路
特应性皮炎是基因异质性的疾病,其中与EOS分化、活化、增殖、趋化等有关的基因以及与EOS分泌产物相关的基因都与特应性皮炎的发病有一定程度的关联。例如编码EOS颗粒蛋白的基因的变异被认为在过敏性疾病的发病中有重要作用。ECP基因的非同义多态性被认为与过敏症状有关,此基因的3’UTR的多态性与ECP的组成成分有关[26];可也有研究却发现编码EOS颗粒蛋白的基因的变异在特应性皮炎致病中并无作用[27],有待进一步的实验探究。近来有研究发现在特应性皮炎等过敏性疾病中EOS表达的G蛋白耦联受体EMR1和EMR3基因有所增加,但其具体作用并不完全清楚,另外,CCR3基因的转录表达在特应性皮炎中也有所增加[28],在EOS趋化中起作用。
最近研究发现,JAK/STAT信号通路在特应性皮炎等炎症性皮肤病中过表达,许多炎症细胞包括EOS、肥大细胞、树突状细胞等都能通过此通路激活,IL-4能诱导B细胞中的JAK1和JAK3磷酸化,有研究证实JAK抑制剂托法替尼(tofacitinib)对于难治性特应性皮炎有一定效果[29]。
研究发现,在EOS与角质形成细胞共培养并在IL-31的刺激下,EOS中的磷脂酰肌醇3-激酶及其下游分子蛋白激酶(phosphatidylinositol 3-kinase-Akt,PI3K/AKT),丝裂原活化蛋白激酶p38(p38 mitogenactivated protein kinases,p38 MAPKs)、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和核转录因子-κB(nuclear factor-κB,NF-κB)信号通路被激活,EOS释放一系列细胞因子和趋化因子,其中ERK通路能延缓EOS凋亡[30]。NF-κB、p38 MAPKs、ERK信号通路也被证实在NOD2/TLR2介导激活EOS中起作用[11]。阻断EOS相关信号通路有望用于治疗特应性皮炎。
综上所述,特应性皮炎的病因复杂。EOS及其产物在特应性皮炎外周血和皮损处的增多与浸润早已被证实,与疾病的严重程度有关。EOS及其相关产物及趋化因子等能作为特应性皮炎活动程度的指标。EOS主要具有抵抗病原体、调节炎症反应以及组织纤维化与重构的作用。然而EOS在特应性皮炎的发病中的具体机制仍未完全了解,比如Th2、Th1及调节性T细胞等介导的免疫反应与EOS之间的相互作用,EOS分泌的颗粒蛋白具体致病机制,微生物感染与EOS之间的关系以及EOS相关的基因和信号通路等都有待更深入的研究。在EOS活化、增殖、趋化的任一环节影响EOS产生的药物对临床症状的改善都有望起到一定作用,了解其具体作用机制也对新药物的研发提供了新思路。
[1] Weidinger S, Novak N. Atopic dermatitis [J]. Lancet, 2016, 387(10023): 1109-1122.
[2] Guo Y, Li P, Tang J, et al. Prevalence of atopic dermatitis in chinese children aged 1-7 ys [J]. Sci Rep, 2016, 6: 29751.
[3] Simon D, Braathen LR, Simon HU. Eosinophils and atopic dermatitis [J]. Allergy, 2004, 59(6): 561-570.
[4] Bystrom J, Amin K, Bishop-Bailey D. Analysing the eosinophil cationic protein--a clue to the function of the eosinophil granulocyte [J]. Respir Res, 2011, 12: 10.
[5] de Graauw E, Beltraminelli H, Simon HU, et al. Eosinophilia in dermatologic disorders [J]. Immunol Allergy Clin North Am, 2015, 35(3): 545-560.
[6] Akan A, Azkur D, Civelek E, et al. Risk factors of severe atopic dermatitis in childhood: single-center experience [J]. Turk J Pediatr, 2014, 56(2): 121-126.
[7] Noh G, Jin H, Lee J, et al. Eosinophilia as a predictor of food allergy in atopic dermatitis [J]. Allergy Asthma Proc, 2010, 31(2): e18-e24.
[8] Wong CK, Cheung PF, Ip WK, et al. Intracellular signaling mechanisms regulating toll-like receptor-mediated activation of eosinophils [J]. Am J Respir Cell Mol Biol, 2007, 37 (1):85-96.
[9] Minai-Fleminger Y, Gangwar RS, Migalovich-Sheikhet H, et al. The CD48 receptor mediates Staphylococcus aureus human and murine eosinophil activation [J]. Clin Exp Allergy, 2014, 44(11): 1335-1346.
[10] Kvarnhammar AM, Cardell LO. Pattern-recognition receptors in human eosinophils [J]. Immunology, 2012,136(1):11-20.
[11] Jiao D, Wong CK, Qiu HN, et al. NOD2 and TLR2 ligands trigger the activation of basophils and eosinophils by interacting with dermal fibroblasts in atopic dermatitislike skin in fl ammation [J]. Cell Mol Immunol, 2016, 13(4):535-550.
[12] Furuta GT, Atkins FD, Lee NA, et al. Changing roles of eosinophils in health and disease [J]. Ann Allergy Asthma Immunol, 2014, 113(1): 3-8.
[13] Ahmadi Z, Hassanshahi G, Khorramdelazad H, et al. An overlook to the characteristics and roles played by eotaxin network in the pathophysiology of food allergies: allergic asthma and atopic dermatitis [J]. In fl ammation, 2016, 39(3):1253-1267.
[14] Lee LA. Atopic dermatitis and allergy in children: a dynamic relationship [J]. Food Chem Toxicol, 2008, 46(Suppl 10):S6-S11.
[15] Nakajima R, Miyagaki T, Oka T, et al. Elevated serum galectin-9 levels in patients with atopic dermatitis [J]. J Dermatol, 2015, 42(7): 723-726.
[16] Kunsleben N, Rüdrich U, Gehring M, et al. IL-31 induces chemotaxis, calcium mobilization, release of reactive oxygen species, and CCL26 in eosinophils, which are capable to release IL-31 [J]. J Invest Dermatol, 2015, 135(7): 1908-1911.
[17] Chow JY, Wong CK, Cheung PF, et al. Intracellular signaling mechanisms regulating the activation of human eosinophils by the novel Th2 cytokine IL-33: implications for allergic in fl ammation [J]. Cell Mol Immunol, 2010, 7(1): 26-34.
[18] Wong CK, Leung KM, Qiu HN, et al. Activation of eosinophils interacting with dermal fi broblasts by pruritogenic cytokine IL-31 and alarmin IL-33: implications in atopic dermatitis [J]. PLoS One, 2012, 7(1): e29815.
[19] Noh JY, Shin JU, Park CO, et al. TSLP regulates eosinophil migration via phosphorylation of L-plastin in atopic dermatitis [J]. Exp Dermatol, 2016, 25(11): 880-886.
[20] Park SY, Oh S, Kim EJ, et al. Utility of eosinophil cationic protein levels in the diagnosis of intrinsic atopic dermatitis [J]. Acta Derm Venereol, 2014, 94(3): 333-334.
[21] Simon D, Hoesli S, Roth N, et al. Eosinophil extracellular DNA traps in skin diseases [J]. J Allergy Clin Immunol, 2011,127(1): 194-199.
[22] Galli SJ, Tsai M, Piliponsky AM. The development of allergic in fl ammation [J]. Nature, 2008, 454(7203): 445-454.
[23] Oyoshi MK, He R, Kanaoka Y, et al. Eosinophil-derived leukotriene C4 signals via type 2 cysteinyl leukotriene receptor to promote skin fi brosis in a mouse model of atopic dermatitis [J]. Proc Natl AcAD Sci U S A, 2012, 109(13):4992-4997.
[24] Fölster-Holst R, Papakonstantinou E, Rüdrich U, et al. Childhood atopic dermatitis-Brain-derived neurotrophic factor correlates with serum eosinophil cationic protein and disease severity [J]. Allergy, 2016, 71(7): 1062-1065.
[25] de Oliveira Titz T, Orfali RL, de Lollo C, et al. Impaired CD23 and CD62L expression and tissue inhibitors of metalloproteinases secretion by eosinophils in Adults with atopic dermatitis [J]. J Eur AcAD Dermatol Venereol, 2016, 30(12): 2072-2076.
[26] Jönsson UB, Byström J, Stålenheim G, et al. A (G->C) transversion in the 3' UTR of the human ECP (eosinophil cationic protein) gene correlates to the cellular content of ECP [J]. J Leukoc Biol, 2006, 79(4): 846-851.
[27] Parwez Q, Stemmler S, Epplen JT, et al. Variation in genes encoding eosinophil granule proteins in atopic dermatitis patients from Germany [J]. J Negat Results Biomed, 2008, 7:9.
[28] Plager DA, Torres SM, Koch SN, et al. Gene transcription abnormalities in canine atopic dermatitis and related human eosinophilic allergic diseases [J]. Vet Immunol Immunopathol, 2012, 149(1-2): 136-142.
[29] Alves de Medeiros AK, Speeckaert R, Desmet E, et al. JAK3 as an emerging target for topical treatment of in fl ammatory skin diseases [J]. PLoS One, 2016, 11(10): e0164080.
[30] Cheung PF, Wong CK, Ho AW, et al. Activation of human eosinophils and epidermal keratinocytes by Th2 cytokine IL-31: implication for the immunopathogenesis of atopic dermatitis [J]. Int Immunol, 2010, 22(6): 453-467.
(本文编辑: 邹 强)
Role and mechanism of eosinophils in the pathogenesis of atopic dermatitis
Reviewer: XU Qianyue, Reviser:YU
Hong
(Department of Dermatology, Xin Hua Hospital Af fi liated to Shanghai Jiao Tong University School of Medicine,Shanghai 200092,China)
Atopic dermatitis (AD) is a chronic and recurrent in fl ammatory skin disease. Multiple studies have demonstrated a significant correlation between the eosinophil (EOS) and AD. Th2 cells secret cytokines and chemokines mediating the activation, differentiation and growth of EOS. EOS is recruited from bone marrow and blood into the dermis, and releases granule proteins, cytokines etc., resulting in the deposition of collagen and fi brosis thickening. This article reviews the recent studies of the main role and mechanism of EOS in the pathogenesis of AD, aiming to a further understanding of this disease and provides insights for the development of new drugs.
atopic dermatitis; eosinophil; pathogenesis; Th2 cells; cytokines
10.3969/j.issn.1000-3606.2017.05.016
2016-10-25)

