棉花黄萎病生防菌S12对棉花幼苗的影响及其抑菌物质的稳定性
李全胜,张国丽,马盼盼,武冬梅,高 能,谢宗铭
(新疆农垦科学院生物技术研究所/作物种质创新与基因资源利用兵团重点实验室,新疆 石河子832000)
0 引言
随着我国倡导化肥和农药减施增效技术的开发和应用,以及人们对生态环境保护和食品安全保障的关注,新型生物农药的开发和利用得到了进一步的发展。微生物农药作为绿色农药的一种类型,不论在基础研究还是产业化方面均走在了整个生物农药研究领域的前列[1-2]。截止到2016年,我国微生物农药的产品数量达到376个,有效成分种类为27个,主要商业化的细菌产品有:苏云金杆菌(Bacillus thuringiensis)、枯草芽孢杆菌(Bacillus subtilis)和蜡样芽孢杆菌(bacillus cereus)[3]。
在微生物农药的菌株资源筛选及其菌剂应用方面,芽孢杆菌因具有分布广、易培养、抗菌谱广、诱导作物抗病性产生等诸多优点以及产高耐性芽孢的独特性[4-6],已经成为粮食、油料和蔬菜等各种作物土传病害防治和促进作物生长的研究热点。经过多年研究和积累,一批具有优良防治效果的芽孢杆菌菌株资源和菌剂产品得到发掘和开发[7-9],并在农业生产中表现出良好的防效。如,江苏农科院植保所开发的发了生物杀菌剂B-916对纹枯病防效达75%—85%,对稻曲病防效达63.8%—85.7%[10-11];南京农业大学分离筛选获得的枯草芽孢杆菌B3,商品名为麦丰宁,对小麦纹枯病田间防效达50%—80%[12];张淑梅等研究表明,含有枯草芽孢杆菌B29菌株的生物拌种剂对大豆根腐病菌(Fxysporum f.sp.vedolens)具有强拮抗作用,苗期的田间防效达60%以上,同时能够显著提高根系中苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)的活性,具有间接诱导大豆抗病性作用[13]。
近年来,随着绿色有机农业的发展,微生物菌剂受到广泛关注,部分产品也进入商业化生产,但是真正得到大规模应用于田间作物病害稳定防治的种类还很少,主要原因在于田间不可控的因素,如温度、酸碱以及紫外线等对生防菌剂中微生物的繁殖、抑菌物质的产生以及防效作用的发挥影响较大,导致菌剂的田间防治效果不稳定[14-15]。本团队通过前期研究,从新疆石河子多年连作棉田中分离获得一株本土的盐碱适应性较强的菌株S12,通过形态学、生理生化特征和16 SrDNA基因测序将其鉴定为枯草芽孢杆菌,其对棉花黄萎病菌的菌丝生长及孢子萌发均具有较强的抑制作用[16],室内盆栽生防效果达到72.18%,为了后续更好的将其研发成生防菌剂并规模化应用到新疆棉田的土传病害防治中,本试验重点对菌株S12对棉花幼苗的促生效果以及其拮抗物质的稳定性进行了研究,以期为菌株S12防病促生菌剂的生产和保藏提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株与棉种
菌株S12是由本研究室从新疆石河子市多年连作棉田中分离获得,-80℃超低温冰箱中甘油保存;棉花黄萎病菌大丽轮枝菌(Verticillium dahliae Kleb.)和新陆早36号棉种由作物种质创新与基因资源利用兵团重点实验室提供。
1.1.2 培养基
PDA培养基:马铃薯200g,葡萄糖20g,琼脂粉15g,蒸馏水1 000 mL,pH 7.0—7.2。121℃灭菌20min;NA培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5.0 g,琼脂粉15g,蒸馏水1 000 mL,pH 7.0—7.2。121℃灭菌20min;NB培养基组成除不加琼脂粉外,其他成分同NA培养基;察氏培养基:蔗糖30 g、NaNO33 g、K2HPO41 g、MgSO4·7H2O 0.5 g、KCl 0.5 g、FeSO4·7H2O0.01 g、蒸馏水1 000 mL,121℃灭菌20min。
1.2 方法
1.2.1 菌悬液及发酵滤液的制备
将菌株S12在NA培养基上活化培养24 h,接种于NB培养基中,装液量为20mL/50 mL,30℃,200 r/min,摇床培养14h,即得种子发酵液。取种子发酵液400uL转接于装液量为40 mL/100mL的NB培养基中,30℃,200r/min,摇床培养48 h,即得菌株S12发酵液。取发酵液20mL装入50mL离心管,8500r/min离心20min,获得菌体沉淀和发酵上清液。菌体沉淀用不同体积的无菌水重悬浮,得到不同稀释倍数的菌体悬浮液;上清液经孔径0.22μm滤器过滤后得到菌株S12的发酵滤液,发酵滤液经不同体积的无菌水稀释后得到不同稀释倍数的发酵滤液。
1.2.2 抑菌活性测定
采用牛津杯法。将活化的棉花黄萎病菌菌饼(直径5mm)接种至100mL察氏培养基中,26℃,220r/min摇床培养4—6d,用4层纱布除去菌丝,获得孢子悬浮液,然后用无菌水稀释浓度至1×105个/mL,取0.1 mL孢子稀释液涂布于PDA培养基平板上,然后等距放置4个牛津杯,向牛津杯中加入菌株S12的无菌发酵滤液150μL,无菌水作为对照,25℃培养4 d,观察并测量抑菌圈直径[20]。
1.2.3 菌株生长特性分析
1.2.3.1 生长曲线
将菌株S12接入NB培养基中,30℃、180 r/min培养12 h后。按1%接种至装有50 mL NB培养基的100 mL三角瓶中,30℃、180 r/min培养,每2h测定600nm的吸光值。
1.2.3.2 耐盐性
取培养14 h的菌液,按1%接种至NaCl浓度分别为0、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.4%、4.0%、5.0%、6.0%、7.0%、8.0%、9.0%、10.0%NB培养基中,30℃、180 r/min培养16 h后测定600 nm的吸光值。
1.2.3.3 耐酸碱性
取培养14 h的菌液,按1%接种至pH分别为4、5、6、7、8、9、10的NB培养基中,30℃、180r/min培养16h后测定600nm的吸光值。
1.2.3.4 菌株S12的传代稳定性
将菌株S12在NA平板上每隔1 d转板1次,连续转板10次,将每次转板后的菌株再转接到NB培养基中,获取发酵滤液,每个处理重复3次,以棉花黄萎病菌为指示菌,牛津杯法测量抑菌圈直径。
1.2.4 菌株对幼苗的影响
挑选饱满、大小一致的棉花种子,75%乙醇浸泡45s后,无菌水冲洗3次,然后将种子浸于10%H2O2中2h,再用无菌水冲洗3次,将表面杀菌的种子播种于装有2/3的体积营养盒蛭石中。处理1:分别用菌株S12悬浮液(稀释10、100、1000倍)浇灌,处理2:分别用菌株S12发酵滤液(稀释10、20、50倍)浇灌,对照用无菌水浇灌,每种处理设置3个重复,每个营养盒浇灌量为300mL,然后温室25—28℃培养。在第9d调查成苗数,计算成苗率并测量株高和鲜重。
1.2.5 抑菌物质的稳定性
1.2.5.1 温度影响
取5只试管,每只试管中添加4 mL无菌发酵滤液,分别在45℃、65℃、85℃、100℃恒温水浴锅处理30min,或在121℃高温灭菌30min。以棉花黄萎病菌为指示菌,牛津杯法测量不同温度处理的发酵滤液的抑菌圈直径。对照为原发酵滤液,每个处理重复3次,
1.2.5.2 酸碱影响
取9个10mL离心管,每只试管中添加5 mL发酵滤液,在室温(25℃)下分别调pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,4℃静置过夜,再依次调pH至7.0,对照为原发酵滤液,每个处理重复3次,抑菌圈直径测定同上。
1.2.5.3 紫外线影响
将发酵滤液置于25W的紫外线灯下,距灯15cm处分别照射处理20、40、60、80、100、120、140、160、180min后,对照为原发酵滤液,每个处理重复3次,抑菌圈直径测定同上。
1.2.5.4 蛋白酶影响
取3个1 mL离心管,每只试管加入5mL发酵滤液,然后分别加胃蛋白酶、胰蛋白酶、蛋白酶K至酶反应终浓度为1mg/mL,在37℃恒温水浴条件下反应1.5h,50℃恒温水浴1h终止酶反应。对照为原发酵滤液,每个处理重复3次,抑菌圈直径测定同上。
1.2.6 数据统计与分析
运用SPSS17.0进行统计分析,并使用oneway ANOVA(Duncan检验)比较各处理间的差异显著性。
2 实验结果
2.1 菌株S12生长特性
2.1.1 菌株S12的生长曲线
菌株S12在30℃,180 r/min条件下,在NB培养基中培养2 h进入对数期,18 h进入稳定期,26 h达到最大值2.6×108CFU/mL(图1)。
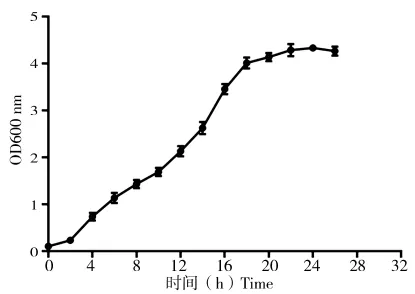
图1 菌株S12生长曲线Fig.1 The growth curve of strain 12
2.1.2 菌株S12的耐盐碱特性
菌株S12在含10%NaCl和pH 4.5—9.0的NB培养基中均可生长(图2、图3),具有较高的耐盐性和较广的酸碱耐受性。这有助于菌株S12在盐碱性较高的农田定殖和繁殖,进而更好的发挥生防效果。

图2 NaCl对菌株S12生长的影响Fig.2 The effect of NaCl on the growth of strain 12

图3 pH对菌株S12生长的影响Fig.3 The effect of pH on the growth of strain 12
2.1.3 菌株S12传代稳定性
将菌株S12连续转板10次,然后将各代菌株在NB培养基中培养,获取发酵滤液并测定其对棉花黄萎病菌的抑菌活性。从图4得知,各代菌株S12的抑菌活性较稳定,说明菌株S12的传代次数对其抑菌活性无影响,利于生防菌剂的生产和田间的防效的发挥。
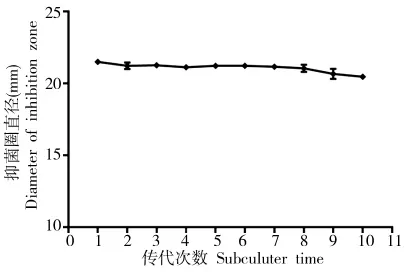
图4 传代次数对抑菌活性的影响Fig.4 The effect of subculture on antifungal activity

表1 菌株S12对棉花幼苗生长的影响Table1 The effect of strain S12 on cotton seedling growth
2.2 菌株S12对棉花幼苗的影响
由表1可知,稀释10至1 000倍菌体悬浮液均表现出促进作用,并且100倍效果最佳,处理9 d后,同对照相比,成苗率显著提高34.62%(p<0.05),株高增加3.63%,鲜重显著增加8.02%(p<0.05);稀释10和20倍发酵滤液均对棉花的成苗率、鲜重和株高表现出抑制作用,而50倍则表现出较好的促进作用,处理9 d后,同对照相比,成苗率显著提高30.77%(p<0.05),株高增加3.11%,鲜重显著增加7.63%(p<0.05)。
2.3 抑菌物质的稳定性研究
2.3.1 抑菌物质对温度的稳定性
菌株S12的发酵滤液在45℃和65℃条件下处理30 min,抑菌活性无明显变化。温度高于85℃时,抑菌活性有所下降,为原有活性的93.75%;当温度达到121℃时,抑菌活性依然可以达到原有活性的91.25%。由此可以得知,菌株S12发酵液中的抑菌物质具有较高的耐热性(图5)。
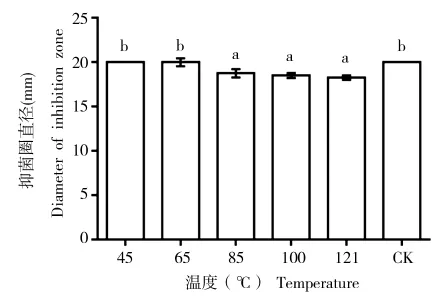
图5 抑菌物质对温度的稳定性Fig.5 Heat stability of antifungal substance
2.3.2 抑菌物质对蛋白酶的稳定性
菌株S12的无菌滤液分别经胃蛋白酶和胰蛋白酶处理1.5h后抑菌活性略有下降,但不明显(图6);经蛋白酶K处理后,抑菌活性较对照下降13.75%,说明菌株S12产生的抑菌物质对胃蛋白酶和胰蛋白酶不敏感,而对蛋白酶K较敏感。

图6 抑菌物质对蛋白酶的稳定性Fig.6 Proteinase stability of antifungal substance
2.3.3 抑菌物质对紫外线的稳定性
紫外线照射不同时间后,菌株S12发酵滤液的抑菌活性与对照相比无明显变化,说明发酵滤液中的抑菌物质对紫外线稳定,耐光照射(图7)。

图7 抑菌物质对紫外线的稳定性Fig.7 Ultraviolet radiation stability of antifungal substance
2.3.4 抑菌物质对酸碱的稳定性
菌株S12发酵滤液在中性条件pH 7.0时抑菌活性最大,为原有活性的108.75%;在酸性(pH 4—6)和碱性(pH 8—10)条件下,抑菌活性同原有活性相比无显著差异(p<0.05);其中,在pH 4时抑菌活性为原有活性的91.25%(图8)。说明该菌株发酵滤液中的抑菌物质具有较好的酸碱适应性。

图8 抑菌物质对酸碱的稳定性Fig.8 pH stability of antifungal substance
2.3.5 抑菌物质贮藏稳定性
菌株S12发酵滤液在4℃和室温(20—25℃)下贮藏30 d后,发酵滤液的抑菌活性无显著性差异(p<0.05)(图9)。表明菌株S12产生的抑菌物质有较好的耐贮藏性,其贮藏时间可以达到1个月以上。

图9 抑菌物质贮藏稳定性Fig.9 Storage time stability of antifungal substance
3 讨论
相对于化学农药,生物农药因具有环境友好、食品安全、不易产生抗药性等优点[2],符合农业绿色可持续发展的要求而不断创制和利用。其中微生物源农药经过国内外学者多年的研究,已经积累了成熟的工业化生产技术和大量的产品,尤其是芽孢杆菌类产品已进入了成熟的商品化阶段[3]。但是由于微生物农药的主要成分生防菌株为活体微生物,其在田间的定殖和生长易受到土壤及环境因子如温湿度、pH、紫外线等的影响[17],因此微生物农药产品在我国不同地区发挥的防效并不一致。
新疆地处欧亚大陆腹地,降雨量少,蒸发量大,紫外线强烈,是我国最为干旱、土壤盐碱化分布最广的地区[18]。随着连作年限延长,新疆棉田黄萎病的发生日趋严重。因此,要想研制能在新疆棉田应用且发挥高效防效的生物农药,就必须筛选获得具有耐盐碱能力的芽孢杆菌菌株资源。王娜等筛选获得的生防芽孢杆菌S6培养2 h可达到生长对数期,30 h后达到稳定期,适合生长pH为6—8,对NaCl的耐受能力达到10%[19]。周小江等筛选获得的两株海洋芽孢杆菌对NaCl的耐受力达到30%,在防治番茄灰霉病的同时,提高了番茄的抗盐能力[20]。本研究筛选的菌株S12培养2 h也可达到生长对数期,18 h达到稳定期,并且在含10%NaCl和pH 4.5—9.0的NB培养基中均可生长,而且菌株传代10次后抑菌活性仍然稳定;相比较菌株S6,菌株S12表现出更快的生长速度和更广的酸碱耐受性,这更加有助于菌株S12在新疆棉田中定殖和繁殖,进而更好抑制棉花黄萎病病菌的生长,提高棉花的抗盐能力,发挥防病作用。
研究表明,芽孢杆菌在产生抑菌活性物质的同时,还可以产生促进植物生长的因子,例如嗜铁素、植物激素及挥发性有机物质等,此外有些菌株还具有溶磷、固氮活性,在防病的同时还具有促生功能[21-22]。畅涛等研究表明,莫海威芽孢杆菌ZA1具有固氮和分泌IAA的能力,与马铃薯拌种后,能够促进其根、茎的长度和干重[23]。陶晶等研究发现,芽孢杆菌组合BCL-8处理番茄后,通过提高番茄对有机物质的利用率提高了其出苗率、株高和鲜重[24]。易有金等研究枯草芽孢杆菌通过产生吲哚乙酸和赤霉素提高了根长、株高、叶长、叶宽和鲜重[25]。本研究也表明,菌株S12悬浮液和稀释50倍发酵滤液均能促进棉花成苗率、株高和鲜重,这可能与其代谢物质中产生的促生长因子有关,具体是哪一类物质,还需进一步研究分析。
生防芽孢杆菌主要通过产生脂肽类抗生素和细胞壁降解酶等抑菌活性物质来抑制作物真菌病原菌的生长,进而达到防治植物病害的目的[26]。而在微生物农药加工、储藏和使用的过程中,温度的高低、光照的强弱、酸碱的大小以及时间的长短,都会影响其在田间效应的发挥[27]。因此,即使筛选获得了生防效果良好的菌株,也可能因抑菌活性物质稳定性差而无法应用到田间的病害防治。本研究结果表明,菌株S12抑菌物质具有较强的耐热性和酸碱适应性,且对紫外线、胃蛋白酶和胰蛋白酶不敏感,以上均说明S12发酵滤液中抑菌物质稳定性较好。在酸性(pH 2—6)和碱性(pH 9—10)条件下,菌株S12抑菌活性同中性条件相比均呈现显著下降(p<0.05),但酸性条件下抑菌活性均低于碱性条件,说明菌株S12发酵滤液中的抑菌物质在中性和弱碱性条件下能更好的发挥其抑菌作用。前期研究表明,S12主要产生脂肽类抑菌物质[16],此类物质在酸性条件下易沉淀析出,这可能是酸性条件下拮抗活性下降的主要原因。
4 结论
根据枯草芽孢杆菌S12对棉花幼苗的影响及其抑菌物质的稳定性的分析,获得以下结论:(1)菌株S12具有较好的耐盐碱性,适合在新疆滴灌棉田定殖和繁殖;(2)菌株S12经多次传代后抑菌活性较稳定,期抑菌物质也具有较强的耐热性、酸碱适应性和储藏性,利于生物菌剂的生产和储藏;(3)菌株S12悬浮液和稀释50倍发酵滤液可以提高棉苗的成活率,增加植株的鲜重和株高,说明该菌株对棉花具有促生长的功能。
References
[1]杨峻,林荣华,袁善奎,等.我国生物源农药产业现状调研及分析.中国生物防治学报,2014,30(4):441-445.Yang J,Lin R H,Yuan SK,et al.Survey and analysis of current situation of biologically derived pesticides industry in China.Chinese Journal of Biological Control,2014,30(4):441-445.(in Chinese)
[2]袁善奎,王以燕,农向群,等.我国生物农药发展的新契机.农药,2015,54(8):547-550.Yuan S K,Wang Y Y,Nong X Q,et al.The new opportu nity for the development of biological pesticide.Pesticides,2015,54(8):547-550.(in Chinese)
[3]邱德文.生物农药的发展现状与趋势分析.中国生物防治学报,2015,31(5):679-684.Qiu D W.Analysis of the development situation and trends of biological pesticides in China.Chinese Journal of Biological Control,2015,31(5):679-684.(in Chinese)
[4]黄曦,许兰兰,黄荣韶,等.枯草芽孢杆菌在抑制植物病原菌中的研究进展.生物技术通报,2010(1):24-29.Huang X,Xu L L,Huang R Z,et al.Research advance in controlling plant diseases by bacillus subtilis.Biotechnology Bulletin,2010(1):24-29.(in Chinese)
[5]梁宏,黄静,赵佳,等.生物防治棉花黄萎病的研究进展.生物技术通报,2015,31(5):1-6.Liang H,Huang J,Zhao J,et al.Studies on biocontrol of cotton verticillium wilt.Biotechnology Bulletin,2015,31(5):1-6.(in Chinese)
[6]O NGENA M,JACQUES P.Bacillus lipopeptides:versatile weapons for plant disease biocontrol.Trends in Microbiology,2008,16(3):115-125.
[7]王春,汪琨,崔志峰.芽孢杆菌活体微生物农药研究现状及应用.浙江农业科学,2013,1(7):830-834.Wang C,Wang K,Cui ZF.Research status and application of bacillus microbial pesticide.Journal of Zhejiang Agricultural Sciences,2013,1(7):830-834.(in Chinese)
[8]刘国红,刘波,王阶平,等.芽胞杆菌分类与应用研究进展.微生物学通报,2017,44(4):949-958.Liu G H,Liu B,Wang J P,et al.Advances in taxonomy and application of Genus Bacillus.Microbiology China,2017,44(4):949-958.(in Chinese)
[9]YANG L,QUAN X,XUE B,et al.Isolation and identifica tion of Bacillus subtilis strain YB-05 and its antifungal substances showing antagonism against Gaeumannomyces graminis var.tritici.Biological Control,2015,85:52-58.
[10]陈志谊,陆凡,刘永锋,等.防治水稻病害微生物农药纹曲宁的研制及产业化.江苏农业学报,2003,19(2):108-108.Chen ZY,Lu F,Liu Y F,et al.Develop and industrialization of microorganism fungicide for control of rice diseases-Wen quning.Jiangsu Journal of Agricultural Sciences,2003,19(2):108-108.(in Chinese)
[11]王晓宇,罗楚平,陈志谊.高效生防菌Bs-916表面活性素合成分子机理研究.中国微生物学会.中国微生物学会第二届全国芽胞杆菌研究与应用学术研讨会论文集.福建:中国微生物学会全国芽胞杆菌研究与应用学术研讨会,2012.18.Wang X Y,Luo C P,Lu Z Y,et al.Research of effective bio-control bacteria bs-916 surface active element syn thesis of molecular mechanism.The Second Taxonomy Symposium.Fujian:Chinese society for microbiology,2012.18.(in Chinese)
[12]黄海婵,裘娟萍.枯草芽孢杆菌防治植物病害的研究进展.浙江农业科学,2005,1(3):213-215.Huang H C,Qiu J P.Advances in research on control plant disease with Bacillus subtilis.Journal of Zhejiang Agricultural Sciences,2005,1(3):213-215.(in Chinese)
[13]张淑梅,王玉霞,赵晓宇,等.生物拌种剂防治大豆根腐病效果和机制.大豆科学,2009,28(5):863-868 Zhang S M,Wan Y X,Zhao X Y,et al.Efficacy and mechanism of biological seed coating agent against soy bean root rot disease caused by Fusarium oxysporum f.sp.vedolens.Soybean Science,2009,28(5):863-868.(in Chinese)
[14]刘萍萍,闫艳春.微生物农药研究进展.山东农业科学,2005(2):78-80.Liu P P,Yan Y C.Progress in research of microbial in secticides.Shandong Agricultural Sciences,2005(2):78-80.(in Chinese)
[15]刘顺字,曹永军.微生物源农药应用现状及发展前景.河南农业科学,2015,44(5):22-25.Liu S Y,Cao Y J.Application status and development prospect of microbial pesticides.Journal of Henan Agri cultural Sciences,2015,44(5):22-25.(in Chinese)
[16]李全胜,谢宗铭,张国丽,等.棉花黄萎病拮抗芽孢杆菌S12的筛选鉴定及拮抗机制的分析.南京农业大学学报,2015,38(3):402-408.Li Q S,Xie Z M,Zhang G L,et al.Screening and identification of antagonistic spore bacterium S12 against cotton Verticillium wilt and preliminary study on its antagonistic mechanisms.Journal of Nanjing Agricultural University,2015,38(3):402-408.(in Chinese)
[17]刘振华,罗远婵,张道敬,等.农用微生物杀菌剂剂型研究进展.农药学学报,2014,16(5):497-507.Liu Z H,Luo Y C,Zhang J D,et al.Research progress and prospects of microbial pesticide formulation for plant disease control.Chinese Journal of Pesticide Science,2014,16(5):497-507.(in Chinese)
[18]邵华伟,孙九胜,胡伟,等.新疆盐碱地分布特点和成因及改良利用技术研究进展.黑龙江农业科学,2014(11):160-164.Shao H W,Sun J S,Hu W,et al.Research progress on distribution characteristics,causes and improved utiliza tion technology of saline-alkali land in Xinjiang.Hei longjiang Agricultural Sciences,2014(11):160-164.(in Chinese)
[19]王娜,许雷.棉花黄萎病、枯萎病拮抗细菌的筛选及其生长特性的研究.植物保护,2007,33(6):39-43.Wang N,Xu L.Screening of antagonistic bacteria against cotton Verticillium wilt and Fusarium wilt and the characteristics of its growth.Plant Protection,2007,33(6):39-43.(in Chinese)
[20]周小江,马湘君,张久明,等.两株海洋极端生境微生物防治番茄灰霉及促进抗盐抗寒作用研究.中国生物防治学报,2016,32(02):244-250.Zhou X J,Ma X J,Zhang J M,et al.Effects of two ma rine microorganisms on tomato leaf mold and their resis tance to salt and cold.Chinese Journal of Biological Con trol,2016,32(02):244-250.(in Chinese)
[21]赵新林,赵思峰.枯草芽孢杆菌对植物病害生物防治的作用机理.湖北农业科学,2011,50(15):3025-3028.Zhao X L,Zhao SF.Research advance in controlling plant diseases by bacillus subtilis.Hubei Agricultural Sciences,2011,50(15):3025-3028.(in Chinese)
[22]ElSAYED WS,AKHKHA A,ElNAGGAR MY,et al.In vitro antagonistic activity,plant growth promoting traits and phylogenetic affiliation of rhizobacteria associated with wild plants grown in arid soil.Frontiers in Microbi ology,2014,5(651):1-11.
[23]畅涛,杨成德,薛莉,等.珠芽蓼内生菌ZA1对马铃薯的防病促生研究.草业学报,2015,24(12):83-91.Chang T,Yang CD,Xue L,et al.Effects of disease control and growth promotion of Polygonum viviparum endophytic bacteria Bacillus mojavensis on potato.Acta Prataculturae Sinica,2015,24(12):83-91.(in Chinese)
[24]陶晶,李晖,李春.芽孢杆菌组合BCL-8的筛选及其促生抗病效果.植物保护学报,2009,36(2):123-128.Tao J,Li H,Li C.Screening of bacillus sp.combination BCL-8 for growth-promotion and disease control.Acta Phytophylacica Sinica,2009,36(2):123-128.(in Chi nese)
[25]易有金,肖浪涛,王若仲,等.内生枯草芽孢杆菌B-001对烟草幼苗的促生作用及其生长动态.植物保护学报,2007,34(6):619-623.Yi Y J,Xiao L T,Wang R Z,et al.Growth effect of en dophyte B-001(Bacillus subtilis)on tobacco seedling and its fluctuation.Acta Phytophylacica Sinica,2007,34(6):619-623.(in Chinese)
[26]朱明妍,刘姣,杜春梅.芽孢杆菌生物防治植物病害研究进展.安徽农业科学,2012,40(34):16635-16638.Zhu M Y,Liu J,Du C M.Research progress of biological control in plant diseases by bacillus spp.Journal of Anhui Agricultural Sciences,2012,40(34):16635-16638.(in Chinese)
[27]张艳军.杨树溃疡病菌拮抗菌发酵液抗菌谱及稳定性研究.浙江农业学报,2014,26(4):981-985.Zhang Y J.The study of antimicrobial spectrum and stability of fermentation broth produced by antagonistic strain against Dothiorela gregaria.Acta Agriculturae Zhejiangensis,2014,26(4):981-985.(in Chinese)

