我国小反刍兽疫病毒H基因序列分析
李飞+李岳洋+张路瑶+马海璐+张保军+蒋秀梅+马世强+赵丽+刘永宏
摘要:为了分析我国小反刍兽疫疫情的特点,从GenBank下载我国和其他国家小反刍兽疫病毒(PPRV)毒株H基因全序列,应用分子生物学软件DNAStar进行序列分析。结果显示,始于2007年的我国首次PPR疫情中,我国西藏地区PPRV 各毒株间H基因核苷酸同源性介于99.6%~100.0%之间,我国西藏与其他国家PPRV毒株核苷酸同源性介于86.7%~983%之间;我国西藏地区PPRV毒株间氨基酸序列同源性介于99.7%~100.0%之间,我国西藏与其他国家PPRV毒株氨基酸序列同源性介于89.3%~98.4%之间。始于2013年年底的我国又一次PPR疫情中,我国PPRV毒株间核苷酸同源性介于99.7%~99.8%之间,我国与其他国家PPRV毒株核苷酸同源性介于87.2%~975%之间;我国PPRV毒株间氨基酸序列同源性介于99.2%~99.8%之间,我国与其他国家PPRV毒株氨基酸序列同源性介于89.0%~984%之间。H基因进化树分析结果显示,我国的9株PPRV划分为基因Ⅳ系。我国PPRV毒株与印度毒株及土耳其毒株同源性最高,可能由这2个国家传入我国。
关键词:小反刍兽疫;H基因;序列分析;核苷酸同源性;氨基酸同源性
中图分类号: S855.3文献标志码: A文章编号:1002-1302(2017)07-0149-04
小反刍兽疫(peste des petits ruminants,简称PPR)是由小反刍兽疫病毒(peste des petits ruminants virus,简称PPRV)感染小反刍动物(绵羊、山羊、鹿、长角大羚羊和骆驼等)引起的的一种急性、高度接触性传染病,临床以高热、口炎、肠炎和肺炎为特征。
PPR最初报道于非洲西部象牙海岸的科特迪瓦[1],随后传播到西非国家。1987年出现了跨洲传播,由非洲传入亚洲国家。1993—1995年间在阿拉伯半岛、中东地区及南亚次大陆地区逐渐流行[2-5]。2006年初,我国周边国家暴发了大规模PPR疫情[6];2007年7月,我国西藏阿里地区首次暴发PPR疫情;2010年赞比亚、不丹相继暴发PPR疫情;2015年7月摩洛哥、赞比亚暴发PPR疫情;2016年2月格鲁吉亚暴发PPR疫情。
依据我国农业部消息,2003年我国周边国家频频发生PPR疫情[7]。2007年7月9日西藏自治区阿里地区日土县龙门卡村首次发现PPR疫情[8]。2007年11月15日,先后在西藏自治区阿里地区改则、札达、日土、革吉等4个县发现疫情。2010年5月14日,西藏自治区阿里地区日土县乌江村发生1起PPR疫情。2013年,我国农业部报道新疆多地区发生疫情,并呈现由边境逐渐向内传播的趋势[9]。2013年11月30日,新疆伊犁霍城县发生PPR疫情[10]。2013年12月份,新疆哈密、轮台、库车、柯坪等县发生了PPR疫情。2014年1月份在我国新疆、西藏等地发生5起疫情,甘肃省武威市古浪县于1月22日发生PPR疫情[11]。2014年2月宁夏、内蒙古等地区发生PPR疫情;2月10日,内蒙古自治区巴彦淖尔市杭锦后旗团结镇建设村、乌拉特后旗乌盖苏木和丰村发生PPR疫情[12];3月初,修水县发生PPR疫情[13]。2014年3月17日,辽宁省锦州市发生PPR疫情[14]。2014年3月18日,黑山县白厂门镇闫屯村发生PPR疫情[15]。2014年5月2日南宁市某养殖场羊群经确诊为PPRV感染,出现PPR疫情[16]。
PPRV分子属副黏病毒科麻疹病毒属,基因组为单股负链RNA,病毒大小为15 948 nt,基因组包括6个基因,分别编码8种蛋白,即N蛋白、P蛋白、基质蛋白(M)、融合蛋白(F)、血凝素蛋白(H)、大蛋白(L)和C、V非结构蛋白[17]。H蛋白是副黏病毒表面的一种糖蛋白,基因全长1 852 bp,该蛋白由609个氨基酸构成,分子量为70 ku。H蛋白是PPRV编码的8种蛋白中最不保守的蛋白,是一种跨膜蛋白。H糖蛋白具有血凝素和神经氨酸酶活性,能引起细胞病变(CPE),但是对山羊、绵羊、猴、猪、牛、马、犬等大多数哺乳动物和禽类的红细胞不具有凝集性[18]。研究发现,H蛋白存在多个翻译后的修饰位点,包括6个糖基化位点G1~G6(G5和G6未被糖基化),不同麻疹病毒及同一病毒的不同菌株之间糖基化位点的数目有所不同,糖基化对血凝素神经氢酸酶(HN)的翻译后加工、神经氨酸酶活性以及稳定性等起着重要的作用。
1材料与方法
1.1试验材料
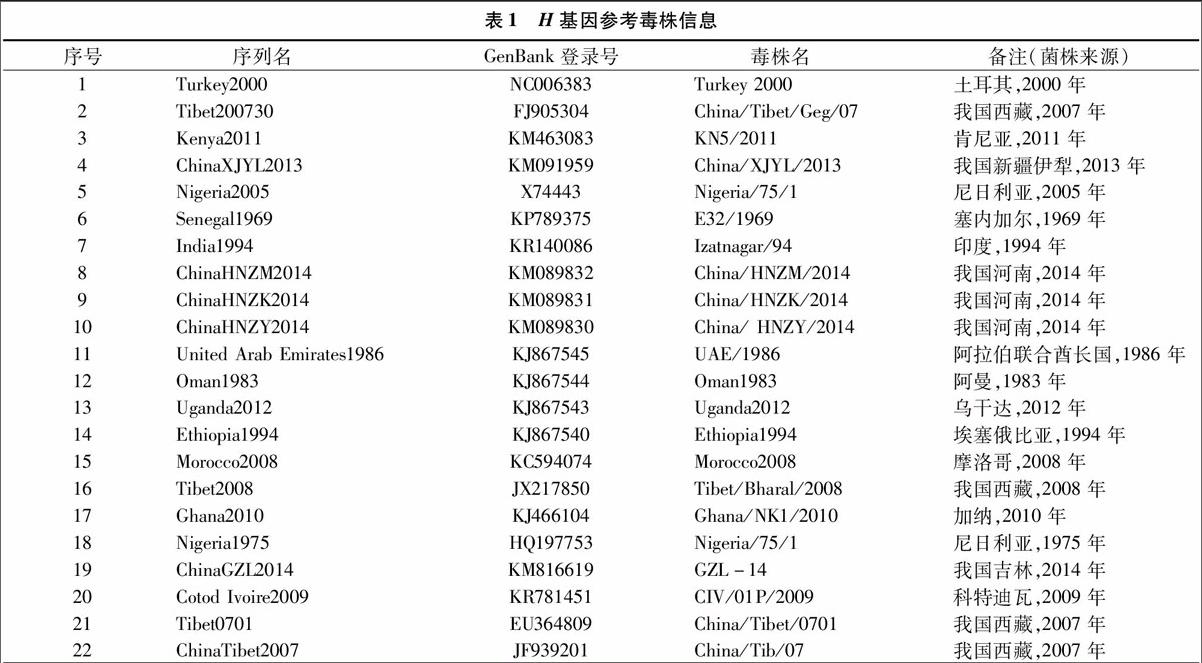
从GenBank下载我国和世界各PPR发病国家已登录的PPRV H基因全序列、GenBank登录号和毒株名称等信息(表1)。
1.2试验方法
下载的氨基酸和核苷酸序列用DNAStar分子生物学软件包EditSeq程序分别生成“*.Pro”和“*.Seq”格式文件,首先利用DNAStar软件包MegAlign程序中File菜单下的 Enter sequences将需要比对的基因序列添加进来,然后利用Align菜单下的Clustal W Method进行多重比对,最后用Veiw菜单下的Sequence Distance程序和Phylogenetic Tree程序进行序列比对和进化树构建。结合毒株年代和地域分布特点,分析我国PPRV毒株的进化规律。
2结果与分析
2.1PPRV H基因核苷酸同源性
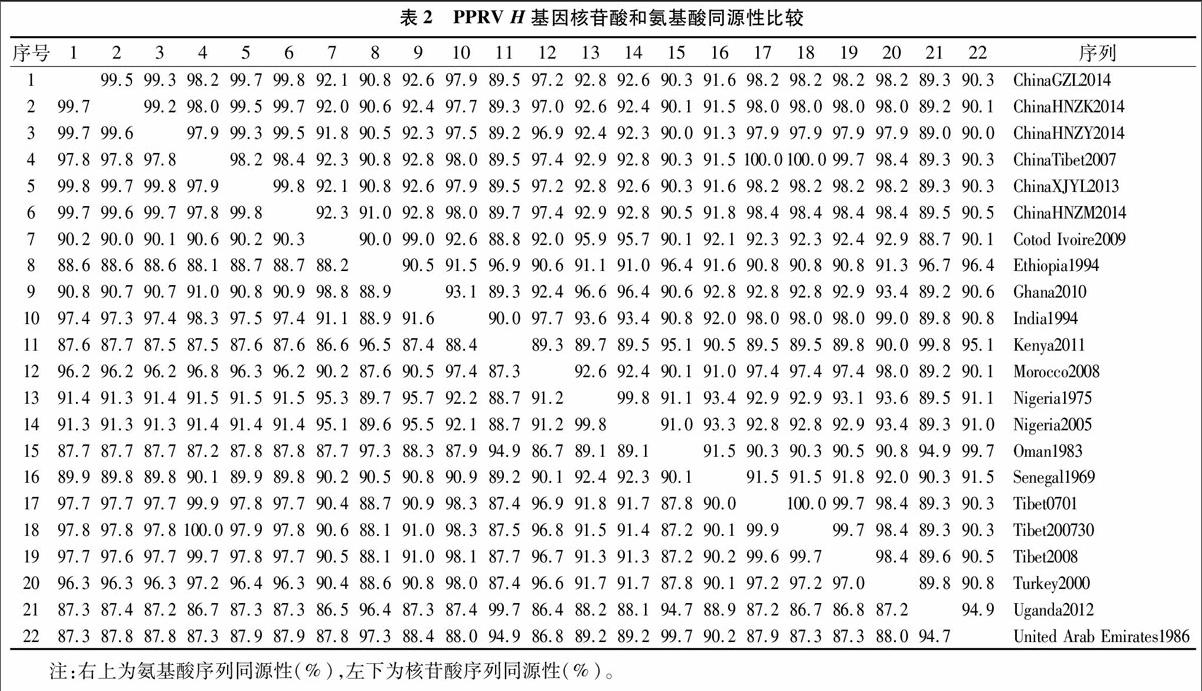
将22个来源不同的PPRV毒株H基因全序列进行核苷酸同源性比较,由表2可知,2007年PPR疫情初次传入我国时,我国西藏地区各毒株间H基因核苷酸同源性介于 99.6%~100.0%之间;我国西藏China/Tibet/Geg/07与China/Tib/07毒株的核苷酸同源性为100.0%,China/Tibet/0701与China/Tib/07毒株的核苷酸同源性为99.9%,那曲地区Tibet/Bharal/2008与阿里地区China/Tib/07毒株的核苷酸同源性为99.7%。我国西藏毒株与其他国家毒株核苷酸同源性介于86.7%~98.3%之间,同源性最高的为印度1994年毒株,同源性最低的为乌干达2012年毒株。2013年当PPR疫情再次传入我国时,我国各毒株间核苷酸的同源性介于99.7%~99.8%之间;我国新疆伊犁China/XJYL/2013毒株与吉林省GZL-14毒株、河南省China/HNZM/2014毒株的同源性最高,为99.8%。我国毒株与其他國家毒株核苷酸同源性介于87.2%~97.5%之间,同源性最高的为印度1994年毒株,同源性最低的为乌干达2012年毒株。
2.2PPRV H蛋白氨基酸序列同源性
将22个来源不同的PPRV毒株H蛋白全序列进行氨基酸序列同源性比较,由表2可知,2007年我国PPR疫情暴发初期,我国西藏地区各毒株间的氨基酸序列同源性介于997%~100.0%之间;我国西藏阿里地区的3株毒株氨基酸序列同源性为100.0%,那曲地区Tibet/Bharal/2008和阿里地区China/Tib/07毒株的氨基酸序列同源性为99.7%。我国西藏毒株与其他国家毒株氨基酸序列同源性介于 89.3%~98.4%之间,同源性最高的为土耳其2000年毒株,同源性最低的为乌干达2012年毒株。2013年当PPR再次传入我国时,我国各毒株的氨基酸序列同源性介于99.2%~99.8%之间,河南省China/HNZM/2014毒株、新疆伊犁 China/XJYL/2013 毒株和吉林省GZL-14毒株的同源性最高,为99.8%。我国毒株与其他国家毒株氨基酸序列同源性介于89.0%~98.4%之间,同源性最高的为土耳其2000年毒株,同源性最低的为乌干达2012年毒株。
2.3PPRV H基因核苷酸进化树
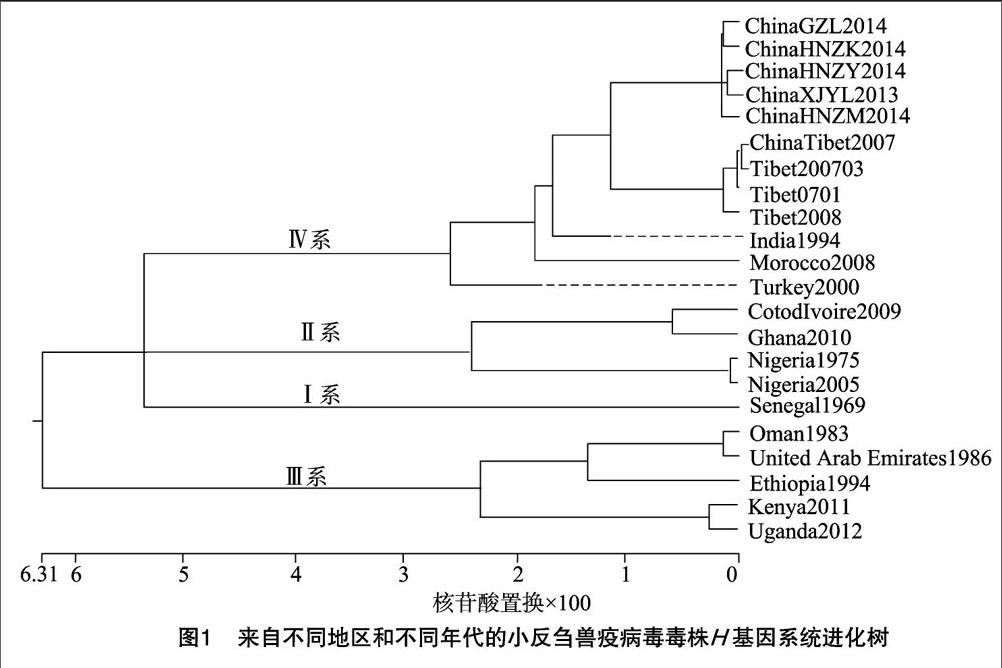
有文献报道,根据F基因或N基因进行遗传变异分析和分子流行病学研究可将全球PPRV的流行株分成Ⅰ~ Ⅳ 4个谱系。将22个来源不同的PPRV毒株H基因核苷酸全序列进行进化树分析,结果显示,来自塞内加尔的1个毒株单独构成1个分支(Ⅰ系);分离自西非科特迪瓦的1个毒株及尼日利亚的2个毒株和非洲西部加纳的1个毒株共同构成了1个分支(Ⅱ系);来自亚洲阿曼、阿拉伯联合酋长国和非洲东北部埃塞俄比亚、非洲东部肯尼亚及非洲中部乌干达的毒株构成了1个分支(Ⅲ系);11个亚洲毒株(包含9个我国毒株)和1个非洲西北部摩洛哥的毒株构成了1个分支(Ⅳ系)。我国分离的9株毒株与印度1994年的毒株进化关系最近,与阿曼、阿拉伯联合酋长国、埃塞俄比亚、肯尼亚和乌干达的毒株进化关系最远。而我国新疆伊犁地区China/XJYL/2013毒株和河南省China/HNZY/2014毒株进化关系最近,我国吉林省GZL-14毒株与河南省China/HNZK/2014毒株进化关系最近(圖1)。
3讨论
2007年PPR疫情初次传入我国时,将我国西藏毒株与世界其他国家毒株的PPRV H基因核苷酸进行同源性比较发现,我国西藏毒株与其他国家毒株核苷酸同源性最高的为印度1994年毒株,同源性最低的为乌干达2012年毒株,推测造成该现象的原因有以下几点:首先从地理位置来看,我国西藏东南部与印度接壤,疫情最有可能从印度传入西藏地区;其次我国周边国家中印度的PPR疫情最为严重,有研究表明我国西藏的毒株与印度等国流行毒株遗传进化关系最近[19],所以说同源性最高很有说服力。2013年PPR疫情再次传入我国新疆伊犁,根据GenBank数据库中已登录的我国吉林省、河南省的毒株进行核苷酸同源性比对,结果显示我国新疆伊犁China/XJYL/2013毒株和吉林省GZL-14毒株的同源性最高,推测造成这一现象的原因可能是利益驱动下的羊群交易,导致疫病从新疆通过病羊、隐性感染羊、交通运输车辆等传到吉林省。我国毒株与其他国家毒株核苷酸同源性最高的为印度1994年毒株,同源性最低的为乌干达2012年毒株。由于疫病的流行遵循“三间”分布的原则(即时间、地区间、畜禽群间),从时间分布来看我国西藏阿里地区最早暴发PPR疫情,从地区分布来看印度与我国西藏周邻,PPR很有可能跨越喜马拉雅山传入我国西藏地区,畜禽间主要感染绵羊、山羊和羚羊等小反刍动物,而我国和印度边境地区野生小反刍动物的频繁接触也可以导致疫病的传播,同样可以说明我国与印度1994年毒株关系最近。
通过氨基酸序同源性比较发现,2007年我国PPR疫情暴发初期,通过我国西藏毒株与其他国家毒株的PPRV H蛋白氨基酸序列同源性比较发现,我国西藏地区各毒株间氨基酸序列的同源性介于99.7%~100.0%之间,我国西藏毒株与其他国家毒株氨基酸序列同源性最高的为土耳其2000年毒株,同源性最低的为乌干达2012年毒株。1993—1995年,PPR在阿拉伯半岛、中东地区及印度次大陆及南亚次大陆部分地区逐渐流行,包括阿联酋、伊朗、伊拉克、叙利亚和土耳其均发现PPR疫情的存在。由于土耳其周边国家都有PPR疫情的发生,推测PPR可能是从土耳其传播到伊朗、巴基斯坦和印度然后传入我国。因此,氨基酸序列同源性最高也很有可能。2013年PPR疫情再次传入我国新疆伊犁,通过新疆伊犁毒株与我国吉林省、河南省的毒株氨基酸同源性比对发现,我国新疆伊犁China/XJYL/2013毒株与河南省China/HNZM/2014毒株的氨基酸同源性最高。我国毒株与其他国家毒株氨基酸同源性最高的为土耳其2000年毒株,同源性最低的为乌干达2012年毒株,与2007年我国西藏第1次疫情氨基酸的比对结果一致。
有文献报道,根据F基因或N基因进行遗传变异分析和分子流行病学研究,可将全球的流行株分为Ⅰ~ Ⅳ谱系,Kwiatek等利用PPRV N基因1 253~1 507位核苷酸序列进行系统进化分析,将来源不同的PPRV毒株划分为4个系,其中基因Ⅰ系由分离自西非的病毒组成,基因Ⅱ系由来源于尼日利亚、加纳、马里的病毒构成,基因Ⅲ系病毒来自阿拉伯半岛南部和东非,基因Ⅳ系的病毒全部来源于亚洲[20]。本研究利用PPRV H基因全序列进行系统进化树分析,将22个来源不同的PPRV毒株划分基因系,结果显示我国西藏2007年和2008年、新疆伊犁2013年、河南省2014年、吉林省2014年、印度1994年、土耳其2000年以及摩洛哥2008年的流行毒株均可划分到第Ⅳ谱系,与Kwiatek等利用PPRV N基因的核苷酸系统进化分析所划分的谱系[20]一致。我国的9个毒株均被划分到第Ⅳ谱系,与Kwiatek等的研究相符合。由于摩洛哥是非洲西北部的一个国家,按照Kwiatek等的划分依据应将其划分到第Ⅰ谱系,本研究将其划分到第Ⅳ谱系,所以与Kwiatek等的研究结果[20]产生了矛盾,而之前刘永宏等通过PPRV F和N基因同源性比较也证明了摩洛哥2008年毒株被划分到了第Ⅳ谱系[21]。阿曼、阿拉伯联合酋长国和非洲东北部埃塞俄比亚、肯尼亚和乌干达的毒株构成了1个分支(Ⅲ系)与Kwiatek等的结果[20]一致,尼日利亚、科特迪瓦和加纳的毒株被划分到了第Ⅱ谱系,与Kwiatek等的结果[20]相符,来自塞内加尔的1个毒株被划分到第Ⅰ谱系,这与 Kwiatek 等的结论[20]相符。
PPRV在动物体内繁殖期间是否会传播病毒还不确定,存在散毒和毒力返强风险;血清学检测也不能区分自然感染(感染抗体)和疫苗免疫(免疫抗体)的动物。目前世界动物卫生组织(OIE)规定的PPR抗原检测方法为PCR和酶联免疫吸附测定(ELISA)。建议我国与PPR发生国相邻的省份加强活羊调运和进出口疫病检测工作,尤其是新疆、西藏2个地区是我国疫病最难以控制的地区。2013年新疆伊犁再次暴发PPR疫情,我国农业部将新疆和西藏定为强制免疫的地区。新疆历史上从来没有PPR疫情报道,2013年新疆伊犁PPR疫情的发生存在2种可能:(1)当PPR可以跨越喜马拉雅山传入我国西藏地区时,可以推测存在新疆伊犁暴发的PPR是由西藏通过昆仑山脉传入的可能性;(2)我国新疆伊犁地区的PPR也可能由于活羊调运时病羊、隐性感染羊、交通运输车辆等携带的病原传播导致的。自从2013年我国新疆伊犁暴发PPR以来疫情由北疆迅速传播至南疆多地,此后疫情迅速播至全国20多个省(区),而造成PPR的傳播这一现象的原因大多数也是由于活羊调运机制的不完善。2014年10月,我国农业部研究起草了《全国小反刍兽疫消灭计划(征求意见稿)》,提出到2020年全国消灭PPR的目标[22]。2015年欧洲食品安全局(EFSA)发布了PPR传入欧盟和邻近国家的风险评估报告[23],可见PPR对我国及世界各地养殖业所造成的危害程度之大。建议各地加强PPR疫病防控的宣传力度,加强动物疫病预防控制机构、实验室建设,且实验室工作人员具备疫病病原学检测能力;强化边境地区防控,重点要做好公路、铁路口岸和港口进口易感动物及其动物性产品的监督检查工作,严防疫情传播。
参考文献:
[1]Banyard A C. Global distribution of peste des petits ruminants virus and prospects for improved diagnosis and control[J]. Journal of General Virology,2010,91(12):2885-2897.
[2]Nanda Y P,Chatterjee A,Purohit A K,et al. The isolation of peste des petits ruminants virus from northern India[J]. Veterinary Microbiology,1996,51(3/4):207-216.
[3]Shaila M S,Peter A B,Varalakshmi P,et al. Peste des petits ruminants in Tamilnadu goats[J]. Indian Veterinary Journal,1996,73(5):587-588.
[4]Shaila M S,Shamaki D,Forsyth M A,et al. Geographic distribution and epidemiology of peste des petits ruminants virus[J]. Virus Research,1996,43(2):149-153.
[5]Singh V P,Chum V K,Mondhe K S. Peste des petitis ruminants:an outbreak in sheep in Rajasthan[J]. Indian Veterinary Journal,1996,73(4):466-467.
[6]Hopewell-Smith A. Peste des petits ruminants in goats in Pakistan[J]. Veterinary Record,1996,139(5):118-119.
[7]农业部关于做好小反刍兽疫防范工作的紧急通知[J].饲料广角,2003(19):18.
[8]陆则基,王志亮,刘雨田,等. 西藏阿里地区小反刍兽疫流行病学调查研究[J]. 中国动物检疫,2008,25(12):44-47.
[9]Wang Z,Bao J,Wu X,et al. Peste des petits ruminants virus in Tibet,China[J]. Emerging Infectious Diseases,2009,15(2):299-301.
[10]中华人民共和国农业部.新疆伊犁州霍城县发生一起小反刍兽疫疫情[EB/OL]. (2013-12-05)[2016-03-10]. http://www.moa.gov.cn/zwllm/yjgl/yqfb/201312/t20131205_3699251.htm.
[11]中华人民共和国农业部.小反刍兽疫[EB/OL]. (2014-02-17)[2016-03-10]. http://www.moa.gov.cn/zwllm/pjgl/pqfh/201402/ t20140217-3764785.htm.
[12]中华人民共和国农业部.内蒙古巴彦卓尔发生小反刍兽疫疫情[EB/OL]. (2014-02-17)[2016-03-10]. http://www.gov.cn/jrzg/2014-02/17/content_2609621.htm
[13]刘素曼,罗明华,吴平山. 一起小反刍兽疫疫情的诊断报告[J]. 江西畜牧兽医杂志,2014,12(4):54.
[14]辽宁锦州发生一起小反刍兽疫疫情[EB/OL]. [2016-02-11]. http://news.sina.com.cn/c/2014/03/21/162629762701.shtml.
[15]史学波,苏成石. 黑山县小反刍兽疫科学防控体会[J]. 畜牧兽医科技信息,2014(10):63-64.
[16]张兵. 依法处置一起输入性小反刍兽疫疫情[J]. 广西畜牧兽医,2014,30(5):276-277.
[17]刘玉洪,徐自忠,花群义,等. 小反刍兽疫病毒分子生物学研究进展[J]. 动物医学进展,2006,27(12):1-6.
[18]南文金,王清华,赵永刚,等. 携带小反刍兽疫病毒H基因的重组山羊痘病毒构建和鉴定[J]. 中国动物检疫,2011,28(7):33-35.
[19]Mcginnes L W,Morrison T G. Disulfide bond formation is a determinant of glycosylation site usage in the hemagglutinin-neuraminidase glycoprotein of Newcastle disease virus[J]. Journal of Virology,1997,71(4):3083-3089.
[20]Kwiatek O,Minet C,Grillet C,et al. Peste des petits ruminants (PPR) outbreak in Tajikistan[J]. Journal of Comparative Pathology,2007,136(2/3):111-119.
[21]劉永宏,曹胜波,赵丽,等. 中国小反刍兽疫疫情分析[J]. 西北农业学报,2014,23(9):19-26.
[22]中华人民共和国农业部.农业部办公厅关于推进做好小反刍兽疫防控工作的通知[EB/OL].(2014-04-10)[2016-03-10]. http://www.moa.gov.cn/govpublic/SYJ/201404/t20140411_3847701. htm.
[23]EFSA Panel on Animal Health and Welfare. Scientific opinion on peste des petits ruminants[J]. EFSA Journal,2015,13(1):3985.

