海水酸化条件下铅胁迫对近江牡蛎过氧化氢酶活性的影响
李晓梅+郭体环+张来军+李由明

摘要:为了研究在未来海洋酸化背景下重金属对贝类免疫的影响,在实验室条件下,设置0.05、0.50、5.00 mg/L 3种硝酸铅浓度,以0.00 mg/L作为对照,比较正常海水(pH值8.0)、酸化海水(pH值7.6)背景下铅胁迫对近江牡蛎鳃组织过氧化氢酶(CAT)活性的影响。结果表明:在正常海水(pH值8.0)条件下,铅浓度为0.00、0.05、0.50 mg/L时,对近江牡蛎CAT活性表现为诱导效应,且诱导效应随铅浓度升高、胁迫时间延长而增强,至20 d时,各组间即表现出显著差异(P<0.05);铅浓度为5.00 mg/L时,对近江牡蛎CAT活性的诱导效应快而强烈,至10 d时,近江牡蛎CAT活性远高于其他各组(P<0.05),但随后又逐渐减弱,至25 d时,与0.05 mg/L组相当,已显著低于0.50 mg/L组(P<0.05)。酸化海水(pH值7.6)条件下,短期内无论铅浓度高或低,均对近江牡蛎CAT活性呈现诱导效应,且铅浓度越高,诱导效应越强;随着胁迫时间延长,诱导效应呈下降趋势,铅浓度越高,CAT活性下降越快,至后期高浓度铅对近江牡蛎CAT活性表现出抑制效应;至30 d时,0.00、0.05、0.50 mg/L组近江牡蛎CAT活性与对照组(pH值7.6、0.00 mg/L)相近,且3组间无明显差异,但5.00 mg/L组近江牡蛎CAT活性显著低于对照组(P<0.05)。由研究结果可见,酸化和铅对近江牡蛎CAT的影响具有协同作用,当铅浓度较低时,近江牡蛎CAT活性主要受pH值影响,当铅浓度达到一定值(5.00 mg/L)后,近江牡蛎CAT活性主要受铅浓度影响,双重胁迫会增加近江牡蛎受损的程度。
关键词:海洋酸化;铅;鳃;CAT;近江牡蛎;健康养殖;过氧化氢酶活性
中图分类号: S917.4;S968.31+6.9文献标志码: A文章编号:1002-1302(2017)07-0165-04
重金属是一类典型的环境污染物,环境中重金属污染的来源主要是化工、采矿、金属冶炼及加工、电镀、轮船制造等行业,以及农用杀虫剂、生活污水和垃圾渗出液等。对于生物体而言,组织内含有较低浓度铅时就能对有机体产生显著的毒性[1],生物体会产生氧化应激反应,影响细胞的结构和功能[2],因此需要抗氧化系统来对抗可能产生的细胞损伤。
过氧化氢酶(CAT)是机体抗氧化体系中非常关键的一种非特异抗氧化酶,能够清除超氧化物歧化酶(SOD)催化活性氧自由基所产生的H2O2,使它转化为对机体无毒的H2O、O2,后者和SOD共同作用可使机体免受氧自由基的攻击[3]。
海洋酸化已被广泛确认是CO2上升导致的又一重大环境问题[4]。化石燃料的使用等人类活动导致大气中CO2浓度不断升高,可能已经导致全球变暖和气候异常等[5],海洋不断从大气中吸收CO2,对缓解全球变暖起着重要的作用[6]。然而,自工业革命以来,海洋大量吸收人类排放的CO2,已导致上层海水pH值下降了0.1[7]。根據联合国政府间气候变化专门委员会(IPCC)预测模型(A1F1)的推测,至2100年大气CO2浓度会升至800~1 000 μL/L,表层海水pH值将下降0.3~0.4,这种酸化速度在过去3亿年间的任何一个时期都未有过[8]。海洋酸化引起的海洋化学变化(碳酸盐系统及物质形态),正在改变海洋生物赖以生存的化学环境,海洋生物的代谢过程会受到影响,海洋生态的稳定性会发生变化[9]。海洋酸化引起的海水pH值的降低会改变海洋生物的多项生理功能,使海洋生物抵抗不良环境胁迫与疾病等能力降低,致使胁迫或疾病对海洋生物造成的损伤更严重,甚至在较低胁迫强度下造成生物个体死亡[10]。
近江牡蛎(Crassostrea rivularis)是我国主要牡蛎养殖种类之一,属于半咸水种类,主要分布在华南沿海众多河口地带。由于近江牡蛎生活在河口区域,不断有淡水经此流入海洋,再加上潮汐、海浪等的影响,近江牡蛎的生活环境经常发生剧烈变化,而且近江牡蛎不像其他海洋生物可以移动,可以趋利避害,而是固定在岩石或其他物体上生活,由此近江牡蛎自身形成了一系列应对环境胁迫的适应机制,是用于研究环境胁迫响应的很好的材料。目前,有关海洋酸化和铅对贝类的生物学影响研究多是单一因素的,包括海洋酸化对贝类受精、发育、免疫、摄食和繁殖的影响[11-13],以及铅对贝类抗氧化酶活性的影响[2,14]等,很少有关于铅和海洋酸化复合胁迫对贝类的影响研究。本研究探讨了海水酸化和铅复合胁迫对近江牡蛎CAT活性的影响,以期为近江牡蛎的健康养殖、栖息地环境检测、防治污染和海洋环境保护等提供参考依据。
1材料与方法
1.1材料
本试验所用近江牡蛎于2015年3月购自海南昌化,采捕后立即送至试验场地,洗刷干净后置于4 m×4 m×1.5 m的室内水泥池内暂养7 d,经测定,近江牡蛎采集地和试验地海水中铅含量均低于0.01 mg/L,无显著性差异。暂养期间采用静态换水法,每天换水1次,养殖用水为过滤海水,主要水环境因子按采样地调控,水温(27±1) ℃,pH值8.0,盐度30‰,以金藻、青岛大扁藻作为饵料,24h连续充氧。暂养结束后,死亡率<1%,符合试验要求,挑选大小均匀[(10.36±183)g/只]的近江牡蛎个体作为受试生物。
以硝酸铅作为污染物,将硝酸铅(分析纯,天津市致远化学试剂有限公司)配制成 10 mg/mL的母液。按需要稀释到相应的浓度,进行铅胁迫试验。
1.2海水处理
试验前使用乙酸调配试验所需酸化海水(pH值7.6),为防止调配好的海水在使用过程中pH值升高,经过反复试验,最终采用输液管匀速缓慢向试验容器中滴加乙酸的方法稳定水体pH值。试验以正常海水作为对照(pH值8.0)。
1.3试验分组
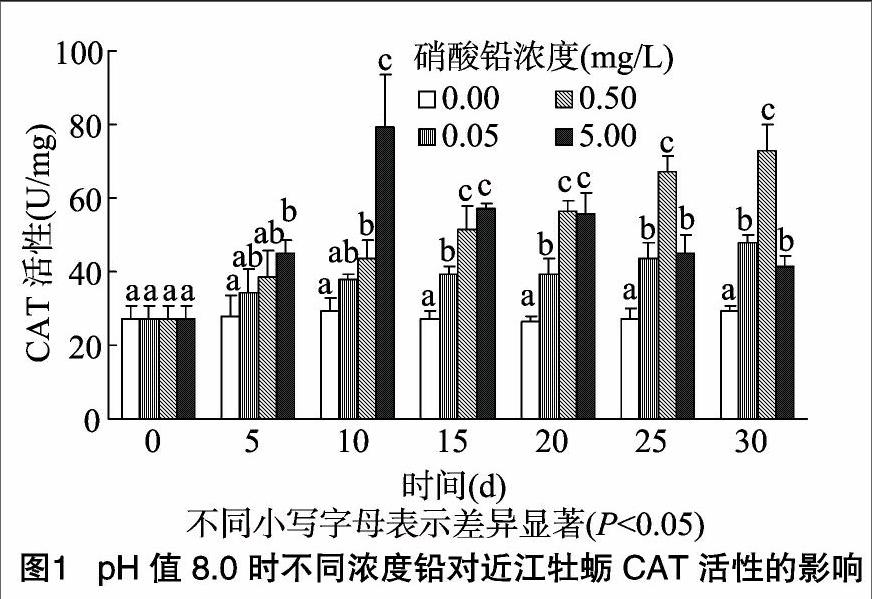
GB 3097—1997《海水水质标准》中的4类海水和NY5052—2001《无公害食品 海水养殖用水水质》中规定铅含量≤0.05 mg/L。已有试验表明,铅对近江牡蛎的96 h LC50为43.55 mg/L,本试验以此为依据,按等比数列设计硝酸铅浓度分别为0.05、0.50、5.00 mg/L的3个浓度组,以0.00 mg/L作为对照组(CK),每组均设置3个平行,各试验组海水pH值及硝酸铅浓度见表1。试验在150 L塑料桶中进行,每桶加 100 L 试验溶液,每组放入经暂养的近江牡蛎 50 只。试验期间每24 h更换1次试液,以金藻、青岛大扁藻作为饵料,试验期间控制水温(27±1) ℃,盐度30‰,24h连续充氧。
1.4样品制备
试验开始的当天记为0 d,试验开始后的5、10、15、20、25、30 d,从各桶随机取3只近江牡蛎,每组9只,取鳃组织,称质量,按1 ∶9(质量体积比)的比例添加预冷的生理盐水,冰上匀浆,4 ℃、5 000 r/min离心10 min,取上清液,置于 -80 ℃ 超低温冰箱内保存备用。
1.5CAT活性测定
CAT活性测定使用南京建成生物工程研究所研制的CAT检测试剂盒(A007-1),按照试剂盒使用说明操作,每个待测样品测试3次。
1.6数据分析
试验数据用“平均值±标准差”表示。用Excel、SPSS等软件进行单因素方差分析和图表制作。
2结果与分析
2.1pH值为8.0时铅对近江牡蛎CAT活性的影响
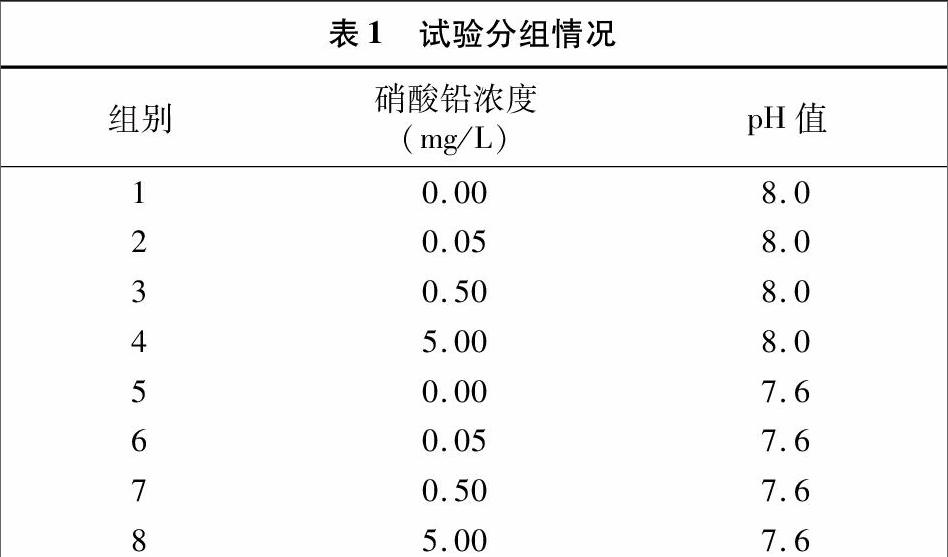
由图1可见,正常海水(pH值8.0)条件下,铅对近江牡蛎CAT活性的影响表现为在整个试验期内,0.00、0.05、0.50 mg/L 3个处理组铅对近江牡蛎CAT活性一直表现为诱导效应,而且诱导效应在一定范围内随铅浓度升高、胁迫时间延长而增强,各组间差异也随之增大;自15 d起,部分组间即表现出显著差异(P<0.05),直至试验结束;5.00 mg/L处理组在试验前期诱导效应非常强,至10 d时近江牡蛎CAT活性显著高于其他各组(P<0.05),而自15 d开始,5.00 mg/L处理组诱导效应逐渐减弱,15、20 d,5.00 mg/L组近江牡蛎CAT活性与 0.50 mg/L 组无明显差异,随着胁迫时间延长,5.00 mg/L 组近江牡蛎CAT活性继续降低,至25 d时与 0.05 mg/L 组相当,已显著低于0.50 mg/L组(P<0.05)。
试验结果表明,在正常海水(pH值8.0)中,低浓度铅对近江牡蛎CAT活性的诱导效应显现得缓慢,但一直保持上升的趋势;高浓度铅对近江牡蛎CAT活性的诱导效应显现得快而强烈,但随后又逐渐减弱。
2.2pH值为7.6时铅对近江牡蛎CAT活性的影响
由图2酸化海水(pH值7.6)条件下铅对近江牡蛎CAT活性的影响可见:在试验开始后的前10 d,无论浓度高低的铅对近江牡蛎CAT活性均表现为较强的诱导效应,且随铅浓度增大、胁迫时间延长,诱导效应逐渐增强;自15 d开始,各铅浓度组的诱导效应均开始降低,铅浓度越高降幅越大,至试验结束时,0.00、0.05、0.50 mg/L组近江牡蛎CAT活性几乎恢复至初始值,且3组间无显著差异,仅5.00 mg/L组近江牡蛎CAT活性显著低于起始值(P<0.05)。
试验结果表明,在酸化海水(pH值7.6)中,短期内无论铅浓度高低均对近江牡蛎CAT活性呈现诱导效应,铅浓度越高,诱导效应越强;随着胁迫时间延长,诱导效应呈下降趋势,铅浓度越高,CAT活性下降越快,至后期高浓度铅对近江牡蛎CAT活性表现出抑制效应。
2.3不同pH值对近江牡蛎CAT活性的影响
为说明pH值对近江牡蛎CAT活性的影响,将不同铅浓度条件下正常海水(pH值8.0)组和酸化海水(pH值7.6)组近江牡蛎CAT活性进行比较。
由图3-a可见,当铅浓度为0.00 mg/L时,正常海水组CAT活性基本保持不变,而酸化海水组CAT活性随处理时间的延长出现较大波动,总体表现为先升高后降低,至5 d时,略高于正常海水组;随后,酸化海水组CAT活性快速增强,至10 d时,二者表现出极显著差异(P<0.01);10 d后,酸化海水组CAT活性随处理时间延长逐渐降低,至30 d时,与正常海水组基本相同。
由图3-b可见,当铅浓度为0.05 mg/L时,正常海水组CAT活性随处理时间延长而缓慢增强;酸化海水组CAT活性则表现为先升后降的变化趋势;二者在10、15 d呈极显著差异(P<0.01),酸化海水组的CAT活性高于正常海水组;30 d时,正常海水组的CAT活性极显著高于酸化海水组(P<001)。
由图3-c可见,铅浓度为0.50 mg/L时,正常海水组CAT活性随处理时间延长而迅速升高;酸化海水组CAT活性则表现为先升后降的变化趋势;前期酸化海水组的CAT活性升高较快,二者在10 d时差异极显著(P<0.01),且酸化海水组的CAT活性高于正常海水组;15 d时正常海水组CAT活性继续上升,而酸化海水组开始下降,二者差异显著(P<005);15 d后,正常海水组CAT活性继续上升,而酸化海水组继续下降,并且差异一直极显著(P<0.01)。
由图3-d可见,当铅浓度为5.00 mg/L时,正常海水组和酸化海水组CAT活性均表现为先升后降的变化趋势,前 15 d 均无显著差异,自20 d开始酸化海水组CAT活性下降速度比正常海水组快,二者差异极显著(P<0.01)。
在本试验中,酸化海水(pH值7.6)组近江牡蛎的CAT活性无论铅浓度高低,均呈现先升后降的趋势,而正常海水(pH值8.0)组并不如此,当铅浓度为0.00~0.50 mg/L时,近江牡蛎CAT活性逐渐升高,只有当铅浓度为5.00 mg/L時,才呈现先升后降的变化趋势。
以上试验结果说明,当铅浓度较低时,近江牡蛎CAT活性主要受pH值影响;随着铅浓度增加,铅、pH值对近江牡蛎的影响出现协同作用;当铅浓度达到一定值(5.00 mg/L)后,近江牡蛎CAT活性主要受铅浓度影响,pH值对CAT活性的影响减弱。
3讨论
已有研究表明,重金属在海洋生物体内富集可诱导产生大量的活性氧自由基,如H2O2、O2-、·OH等,用以帮助机体清除进入体内的病原,但是过量的活性氧会导致生物体内细胞膜的脂质化程度加快,破坏生物体内的活性氧平衡,进而引起生物体的氧化损伤[15-16]。此时,生物体为避免活性氧对自身细胞的伤害,会自动激活体内的氧化应激系统——抗氧化防御系统,机体抗氧化防御系统是保障重金属污染胁迫造成的活性氧平衡的重要调节体系,因而常被用作监测海洋重金属污染物的候选生物标记物[17]。Regoli等指出,海洋生物的氧化应激通路中,CAT是防止活性氧分子形成必不可少的分子[16]。CAT的主要作用就是催化H2O2分解为H2O、O2,使得H2O2不至于与O2在铁螯合物作用下反应生成非常有害的·HO。
本研究表明,在正常海水中,低浓度铅对近江牡蛎CAT活性的诱导效应显现得缓慢而持久,高浓度铅对近江牡蛎CAT活性的诱导效应显现得快,但随后又出现抑制效应。铅胁迫下近江牡蛎鳃组织的CAT活性表现为浓度依赖性、时间依赖性,这种在低剂量表现为刺激效应,而高剂量则表现为抑制效应的模式称为“毒物兴奋效应”[18]。
在本研究中,酸化胁迫使近江牡蛎CAT活性呈现先升后降的趋势,说明近江牡蛎对短期的酸化胁迫可以通过启动应激防御系统来降低自身受到的伤害,但是随着胁迫时间延长,酸化造成的伤害已超过近江牡蛎防御能力范围,导致其受到损伤,酶合成能力降低,进一步将影响近江牡蛎的正常生理活动。很多生理学研究表明,双壳贝类、棘皮动物等可能最容易受到海洋酸化的影响,因为在它们体内几乎没有能力来缓冲酸化影响[9,11,19-20]。由酸化产生的结果是广泛而深远的,可能导致新陈代谢抑制[21]、能量存储和生长率降低[22]。贝类等海洋生物生理相关功能的改变已经被用来评估海洋酸化的生态影响[23]。
本研究还显示,酸化和铅对近江牡蛎CAT活性的影响具有协同作用,在它们单独存在都会对近江牡蛎造成一定损害的前提下,双重胁迫会增加近江牡蛎受损的程度。本试验仅揭示了酸化和铅对近江牡蛎的影响,而海洋中还存在大量如铜、镉等其他有毒有害的重金属,它们之间是否也存在类似的协同效应,尤其值得关注。一个更大的隐忧是海洋酸化将使越来越多的重金属从海洋沉积物中释放出来,酸化越严重,重金属释放得也越多,对海洋生物的毒害就越深。因此,建立全面系统的海洋酸化-重金属污染评估体系是急迫且必要的。
参考文献:
[1]孙翰昌,徐敬明,甘桂云. 4种重金属对禾花鱼胚胎的毒性效应[J]. 水生态学杂志,2013,34(1):92-95.
[2]于庆云,王悠,徐彦,等. 镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响[J]. 生态毒理学报,2013,8(4):504-512.
[3]Sarkar S,Yadav P,Trivedi R,et al. Cadmium-induced lipid peroxidation and the status of the antioxidant system in rat tissues[J]. Journal of Trace Elements in Medicine and Biology,1995,9(3):144-149.
[4]Doney S C,Fabry V J,Feely R A. Ocean acidification:the other CO2 problem[J]. Annual Review of Marine Science,2009,1(1):169-192.
[5]Solomon S,Plattner G K,Knutti R A. Irreversible climate change due to carbon dioxide emissions[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(6):1704-1709.
[6]Sabine C,Feely R,Gruber N,et al. The oceanic sink for anthropogenic CO2[J]. Science,2004,305(5682):367-371.
[7]Orr J,Fabry V,Aumont O,et al. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms[J]. Nature,2005,437(759):681-686.
[8] Hnisch B,Ridgwell A,Schmidt D N,et al. The geological record of ocean acidification[J]. Science,2012,335(6072):1058-1063.
[9]Fabry V J,Seibel B A,Feely R A,et al. Impacts of ocean acidification on marine fauna and ecosystem processes[J]. ICES Journal of Marine Science,2008,65(3):414-432.
[10]韋晓慧,慕芳红,孙艳桃,等. 海洋酸化条件下铜、镉对日本虎斑猛水蚤的急性毒性效应[J]. 生态学报,2014,34(14):3879-3884.
[11]Kurihara H,Asai T,Kato S,et al. Effects of elevated pCO2 on early development in the mussel Mytilus galloprovincialis[J]. Aquatic Biology,2009,4(3):225-233.
[12]Talmage S C,Gobler C J. The effects of elevated carbon dioxide concentrations on the metamorphosis,size,and survival of larval hard clams (Mercenaria mercenaria),bay scallops (Argopecten irradians),and Eastern oysters (Crassostrea virginica)[J]. Limnology and Oceanography,2009,54(6):2072-2080.
[13]何盛毅,林傳旭,何毛贤,等. 海洋酸化对马氏珠母贝胚胎和早期幼虫发育的影响[J]. 生态学杂志,2011,30(4):747-751.
[14]江天久,牛涛.重金属Cu2+,Pb2+和Zn2+胁迫对近江牡蛎SOD活性的影响研究[J]. 生态环境,2006,15(2):289-294.
[15]Luna-Acosta A,Kanan R,Le Floch S,et al. Enhanced immunological and detoxification responses in Pacific oysters,Crassostrea gigas,exposed to chemically dispersed oil[J]. Water Research,2011,45(14):4103-4118.
[16]Regoli F,Giuliani M E. Oxidative pathways of chemical toxicity and oxidative stress biomarkers in marine organisms[J]. Marine Environmental Research,2014,93(1):106-117.
[17]Winston G W,Giulio R T D. Prooxidant and antioxidant mechanisms in aquatic organisms[J]. Aquatic Toxicology,1991,19(2):137-161.
[18]顾海龙,沈伟良,孙长森,等. 低浓度Cd2+长期胁迫对泥蚶抗氧化防御系统及MDA含量的影响[J]. 海洋环境科学,2013,32(5):741-745.
[19]Dupont S,Ortega-Martínez O,Thorndyke M. Impact of near-future ocean acidification on echinoderms[J]. Ecotoxicology,2010,19(3):449-462.
[20]Widdicombe S,Spicer J I. Predicting the impact of ocean acidification on benthic biodiversity:What can animal physiology tell us?[J]. Journal of Experimental Marine Biology and Ecology,2008,366(1/2):187-197.
[21]Miles H,Widdicombe S,Spicer J,et al. Effects of anthropogenic seawater acidification on acid-base balance in the sea urchin Psammechinus miliaris[J]. Marine Pollution Bulletin,2007,54(1):89-96.
[22] Beniash E,Ivanina A,Lieb N S,et al. Elevated level of carbon dioxide affects metabolism and shell formation in oysters Crassostrea virginica(Gmelin)[J]. Marine Ecology Progress Series,2010,419(6):95-108.
[23]Guinotte J,Fabry V. Ocean acidification and its potential effects on marine ecosystems[J]. Annals of the New York Academy of Sciences,2008,1134(1):320-342.

