辣椒疫霉菌SSR—PCR反应体系的建立及优化
陶丽婷+杨世鹏+王丽慧+李屹+李莉


摘要:为快速有效地确定辣椒疫霉菌SSR-PCR反应体系,采用正交优化设计方法,对影响辣椒疫霉菌SSR-PCR反应体系的4个主要因素(模板DNA、引物、dNTPs、Taq酶)在4个水平上进行优化。结果表明,不同因素下各水平浓度对SSR-PCR的反应结果均有显著性影响,最佳反应体系(20 μL)为:1.0 ng模板DNA,0.8 μmol/L引物,0.5 μmol/L dNTPs,1.0 U Taq酶。PCR扩增程序为:94 ℃预变性2 min;94 ℃变性15 s,58.4 ℃退火30 s,36个循环,72 ℃延伸 2 min,最佳循环数为36。利用该体系对12份辣椒疫霉菌进行验证,证明该体系稳定可靠,本试验为辣椒疫霉菌遗传多样性分析研究及分子育种奠定了理论基础。
关键词:辣椒疫霉菌;SSR-PCR;正交设计;体系优化
中图分类号: S436.418文献标志码: A文章编号:1002-1302(2017)07-0080-04
辣椒疫霉菌(Phytophthora capsici Leonian)是引起辣椒疫病的霜霉属真菌,危害作物根、茎、叶,卵孢子可在土壤中越冬。由于疫病是土传病害,传播速度快、途径广,给辣椒生产带来巨大的经济损失[1]。目前,种植抗病品种是防治辣椒疫病的有效方法之一,然而,辣椒疫霉菌具有很高的变异性[2],基于SSR标记具有位点多态性高的特点,可以揭示这些变异并发现不同种间的多态性[3]。因此,对辣椒疫霉菌遗传多样性的深入研究对辣椒抗病育种及群体结构分析具有重要意义。
简单重复序列(simple sequence repeats,SSR)又称微卫星DNA(microsatellite DNA)是以1~6个核苷酸多次串联重复的DNA序列[4],具有数量丰富、多态性高、对DNA质量要求不高且重复性好、可靠性高等特点[5]。SSR位点的多态性对基因及基因组的遗传变异具有重要作用,可用于研究真菌种群的遗传结构多样性[6],但相关疫霉菌的报道较少[7]。蔺宇等通过对大豆疫霉菌EST开发新的SSR标记,来研究大豆疫霉菌的遗传变异[8]。孙文秀等对7个不同区域的辣椒疫霉菌进行RAPD分析,探索了不同区域辣椒疫霉菌的遗传分化关系[9]。姚国胜等用SSR对马铃薯致病疫霉群体结构进行分析并完善了其分子标记体系[10]。
本研究对Taq酶、模板DNA、dNTP、引物等4個因素,在4个不同浓度水平下进行正交试验设计,进行扩增体系的优化,并对退火温度进行优化, 以期确定辣椒疫霉菌SSR-PCR反应的最优体系,为后续群体遗传多样性分析等奠定基础。
1材料与方法
1.1材料与试剂
本试验所用材料为青海省农林科学院园艺研究所采集的来自青海省海东市乐都区、循化县、大通县、互助县、贵德县等5个地区的12株辣椒疫霉菌。菌株信息如表1所示。
试验所用Taq酶、dNTPs、DNA Marker(D2000)、Mg2+、10×PCR buffer均购自天根生化科技(北京)有限公司。SSR引物根据GeneBank所公布的辣椒疫霉菌全序列基因,利用引物设计软件Primer 5设计而成,引物由北京华大基因有限公司合成。
核酸检测仪(2000C,购自Thermo);PCR仪(Eppendorf Mastercycler pro,购自上海研域仪器设备有限公司);电泳仪(DYY-6C型,购自北京市六一仪器厂);凝胶成像仪(ImageQuant300/350/RTECL,购自Bio-RAD)。
1.2基因组DNA提取与检测
采用生工UNIQ-10柱式真菌基因组DNA抽提试剂盒提取辣椒疫霉菌基因组DNA。用核酸检测仪确定DNA浓度与纯度,并将样品DNA稀释到所需浓度,用1%浓度的琼脂糖凝胶电泳检测DNA提取效果,并在凝胶成像仪上分析与拍照,最后于-80 ℃保存。
1.3PCR反应体系正交试验
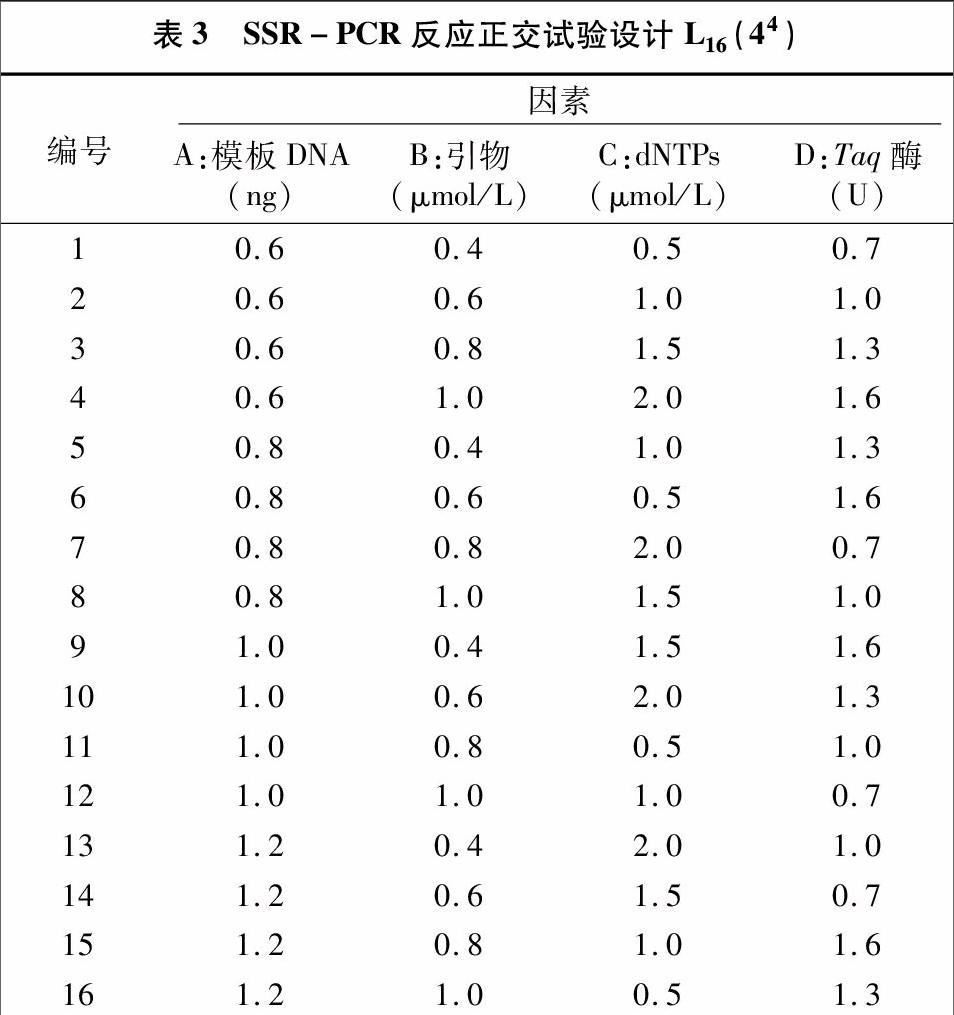
以采集自青海省海东市乐都区的辣椒疫霉菌(LL04)为试验材料,BJP05号引物(5′-3′:GACTCGGACTCGGACGAC,3′-5′:CTCCTGCTCATCTTTCAGGC)为试验引物,SSR-PCR反应体系的4个因素分别为模板DNA、dNTPs、引物、Taq酶的浓度,采用L16(44)正交试验设计进行4因素4水平筛选分析,方案如表2、表3所示。设试验总体系为20 μL,按照表2中要求加入,另加4 μL 10×PCR buffer、2 μL Mg2+,用ddH2O补足 20 μL。SSR-PCR扩增程序为:94 ℃预变性2 min;94 ℃变性15 s,58.4 ℃退火30 s,36个循环,72 ℃延伸 2 min,4 ℃保存。所得PCR扩增产物加5 μL 6×Loading buffer,充分混匀后,取10 μL在1%琼脂糖凝胶上120 V恒压下电泳30 min,电泳结束后在凝胶成像系统上观测拍照。
1.4正交试验数据分析
本试验数据统计参照申洁等的方法[11],统计可识别条带,同时参考条带明亮程度及背景清晰度,进行数据分析。数据采用极差、方差和多重比较方法分析各个处理结果,结果如表4所示。
1.5退火温度优化
PCR反应体系中,每对引物都有其最适宜的退火温度。对同一模板、引物,设退火温度梯度进行PCR扩增反应,以引物的参考退火温度±4 ℃上下浮动[12],以期获得该反应体系下最佳退火温度。依据上述试验的最优反应体系对退火温度进行优化。采用梯度PCR模式,自动设定温度为54.4~61.4 ℃,生成温度梯度54.4、55.6、56.4、57.2、58.4、59.0、60.5、61.2 ℃。其他反应程序与PCR正交试验设计的扩增程序相同。
1.6扩增体系稳定性验证
利用优化的体系,以BJP05号引物随机选取12份辣椒疫霉菌DNA模板分别进行SSR-PCR扩增,进行辣椒疫霉菌SSR-PCR反应体系的稳定性检测。
2结果与分析
2.1基因组DNA提取与检测
本试验利用生工真菌基因組DNA抽提试剂盒提取12份辣椒疫霉菌模板DNA,用核酸检测仪检测模板DNA浓度及纯度,其D260 nm/D280 nm值在1.80~1.92之间,DNA浓度平均为320 ng/μL,加ddH2O稀释至所需浓度,-80 ℃保存。
2.2SSR-PCR扩增结果
利用正交优化设计L16(44),PCR扩增产物电泳结果如图1所示,16个处理结果均有条带出现。从图1可以看出,4个因素在不同水平处理下其扩增结果存在明显差异。处理2、6、9、10、11、13、15的扩增条带数多且清晰,其中9、10、11处理主条带较明显,因此可认为这3个组合——9(A3B1C3D4)、10(A3B2C4D3)、11(A3B3C1D2)是16个正交试验处理中较适合辣椒疫霉菌SSR-PCR扩增的组合。2.3正交试验数据分析
组合9、10、11是16个正交试验处理中较优的组合,根据所得试验数据对各因素进行数据分析,以确定最佳组合。极差越大,离散程度越大,也说明该因素对试验结果影响最大[13-14]。由表4可知,影响辣椒疫霉菌SSR-PCR反应体系的4个因子中,模板DNA浓度影响最大,其次是引物浓度,再次是Taq酶浓度,影响最小的是dNTPs浓度。由此判断出,SSR-PCR扩增结果特异性条带多且亮的3个组合中最优的反应体系是组合11(A3B3C1D2)。
为验证以上结果,对表4中各组合下扩增片段数据进行方差分析,结果如表5所示,4因素F值的大小顺序为模板DNA>引物>Taq酶>dNTPs,说明模板DNA浓度对辣椒疫霉菌SSR-PCR扩增结果影响最大,其次是引物浓度和Taq酶浓度,dNTPs浓度对扩增反应结果影响最小。其中,模板DNA、引物、Taq酶各浓度水平对PCR扩增结果均有显著性差异,且模板DNA各水平对扩增结果具有极显著性差异。方差分析结果与极差分析结果一致,则证明正交优化设计表中第11组处理是辣椒疫霉菌SSR-PCR反应体系的最优处理,即影响辣椒疫霉菌SSR-PCR反应体系的4因素最佳浓度水平分别为1.0 ng模板DNA、0.8 μmol/L引物、0.5 μmol/L dNTPs、1.0 U Taq酶。
2.4PCR退火温度筛选
PCR反应中,退火温度可能直接影响模板与引物的特异性结合。如图2所示,8个退火温度下均可扩增出特异性条带,在退火温度低时,非特异性条带增多,且条带模糊不清晰,在退火温度高时,条带较暗。第1、2、3退火温度处理条带扩增弥散严重,背景较深,出现非特异性条带且主带亮度较弱;随着退火温度的升高,第6、7、8退火温度处理条带弥散减少,扩增不稳定且主带缺失;当退火温度为57.2~58.4 ℃时, 扩增条带清晰,重复性好且主条带亮,但以58.4 ℃时扩增效果最佳。因此确定该引物的最佳退火温度为58.4 ℃。
2.5SSR-PCR最佳反应体系稳定性检测结果
采用上述最佳反应体系结果,用BJP05号引物,对来自青海省海东市乐都区、互助县、大通县、循化县、贵德县的12份辣椒疫霉菌DNA进行SSR扩增。结果如图3所示,引物对每份DNA样品均扩增出清晰的、多态性高且重复性好的目的条带,说明该体系稳定性较好,适用于辣椒疫霉菌的SSR反应。
3讨论
由于SSR标记易受到反应体系和扩增程序的影响,且各因素间又存在互作效应[15],因此确定辣椒疫霉菌SSR-PCR最佳反应体系能够迅速获得试验结果,为辣椒疫霉菌遗传多样性研究的顺利进行节省时间与成本[16]。本试验采用 L16(44) 正交试验设计,确立最佳组合,通过方差分析确定各个因素在4个浓度水平下对SSR-PCR反应影响的大小。
在PCR反应标准体系中,影响PCR结果的5个因素为Taq酶、Mg2+、DNA、dNTPs、引物。Mg2+是影响PCR结果的重要变量之一,高浓度的Mg2+,使非特异性条带增多,浓度过低,影响酶活性。在前人研究中,Mg2+的用量浮动不大[17],其浓度在1.5~2.0 μmol/L之间浮动,本试验在20 μL体系中加2 μL Mg2+,使其终浓度保持在分子克隆标准体系的较低水平,因此,本试验未对Mg2+浓度作相关分析。dNTPs是PCR反应的底物[18],高浓度的dNTPs会与酶竞争游离的Mg2+,降低其活性,引起错配,低浓度则会影响扩增效率。Taq酶是对Mg2+依赖的酶,浓度过高产生非特异性扩增,浓度过低会引起反应灵敏度差,使条带弥散。DNA是PCR反应的基础,前人研究认为DNA的波动范围较广,其浓度在 1.0~6.0 ng/μL之间对反应影响不大[19]。DNA浓度过高使模板之间配对概率增加,相对减少了引物与模板的配对机会,降低引发效率,易产生非特异性扩增[20]。本试验结果表明模板DNA对PCR反应影响最大,引物、Taq酶次之,dNTP浓度影响最小。退火温度决定PCR特异性和产量,温度过高引物不能与模板牢固结合,过低则容易使引物和模板错配,非特异性产物增加。可通过设置一系列梯度,以确定某些反应的特定退火温度,本试验设置8个梯度,筛选出最佳退火温度为58.4 ℃。
综上所述,不同物种对SSR-PCR扩增体系影响各不相同,因此,采用SSR-PCR的方法研究遗传多样性之前对反应体系的优化是必不可少的,不但减少试验工作量节省成本,而且将增加对遗传多样性研究的多态性,提供试验的可重复性。
参考文献:
[1]郑小波. 疫霉菌及其研究技术[M]. 北京:中国农业出版社,1997.
[2]Kirk P M,Cannon P F,Minter D W,et al. Ainsworth & bisbys dictionary of the fungi[M]. 10th ed. Wallingford:CAB International,2008.
[3]梁玉琴,李芳东,傅建敏,等. 正交设计优化柿属植物SSR-PCR反应体系[J]. 经济林研究,2011,29(4):17-22.
[4]谢晶晶,姜华,毛雪琴,等. 利用SSR技术研究浙江省稻瘟病菌群体的遗传多样性[J]. 浙江农业学报,2015,27(10):1781-1788.
[5]郑成木. 植物分子标记原理与方法[M]. 长沙:湖南科学技术出版社,2003.
[6]Litt M,Luty J A. A hypervariable microsatellite revealed by in vitro amplification of a dinucleotide repeat within the cardiac muscle actin gene[J]. American Journal of Human Genetics,1989,44(3):397-401.
[7]Wu K S,Tanksley S D. Abundance,polymorphism and genetic mapping of microsatellites in rice[J]. Molecular Genetics and Genomics,1993,241(1):225-235.
[8]藺宇,朱振东,王晓鸣,等. 大豆疫霉菌鉴定和检测的特异性SSR标记建立[C]//中国植物病理学会. 中国植物病理学会2006年学术年会论文集. 北京:中国农业科学技术出版社,2006.
[9]孙文秀,张修国,贾永健,等. 不同地区辣椒疫霉菌遗传多样性的RAPD分析[J]. 植物病理学报,2005,35(4):340-344.
[10]姚国胜,王俊山,杨英茹,等. 河北省和黑龙江省马铃薯晚疫病菌SSR基因型分析[J]. 科技导报,2008,26(5):35-39.
[11]申洁,侯思宇,孙朝霞,等. 正交优化枣树ISSR-PCR反应体系的研究[J]. 华北农学报,2010,25(2):116-120.
[12]李亚利,陈书霞,孟焕文,等. 利用正交设计优化黄瓜的SSR-PCR反应体系[J]. 西北农业学报,2008,17(3):280-284.
[13]郭海林,王志勇,薛丹丹,等. 结缕草属植物SSR反应体系的优化及其应用[J]. 植物遗传资源学报,2008,9(2):138-143.
[14]叶青雷,王玲玲,藏楠,等. 槲树DNA SSR-PCR反应体系的正交优化[J]. 蚕业科学,2008,34(2):307-311.
[15]苏辉,李志刚,宋书宏. 正交设计优化大豆SSR-PCR反应体系及引物筛选[J]. 华北农学报,2009,24(2):99-102.
[16]王欢欢,姜晶,王慧,等. 正交设计优化番茄基因组DNA SSR-PCR反应体系[J]. 江苏农业科学,2009(2):48-50.
[17]张崎峰,靳学慧,张亚玲,等. 正交设计优化稻瘟病菌SSR-PCR反应体系[J]. 安徽农业科学,2009,37(22):10426-10428.
[18]杨传平,王艳敏,魏志刚. 利用正交设计优化白桦的SSR-PCR反应体系[J]. 东北林业大学学报,2006,34(6):1-3.
[19]龙萄,黄春琼,刘国道. 正交设计优化狗牙根SSR-PCR反应体系[J]. 基因组学与应用生物学,2016,35(1):198-205.
[20]张卿哲,孟金贵,张应华,等. 用正交设计法优化辣椒ISSR-PCR反应体系[J]. 西南农业学报,2011,24(3):1034-1038.

