秘鲁番茄高效再生体系的研究
薛其勤


摘要:以秘鲁番茄的叶片和茎段为外植体,研究不同外植体种类、激素配比对秘鲁番茄愈伤组织诱导、分化和不定芽生根的影响,以期建立秘鲁番茄组织培养高效再生体系。结果表明:秘鲁番茄的叶片较茎段更适宜愈伤组织诱导与分化,以叶片为外植体时,最佳愈伤组织诱导培养基为MS+2.0 mg/L ZT+0.2 mg/L IAA,愈伤组织诱导率高达1000%;愈伤组织分化的最佳培养基为MS+2.0 mg/L ZT+0.2 mg/L IAA,不定芽的分化率高达92.4%。以茎段为外植体时,最佳诱导愈伤培养基为MS+2.0 mg/L ZT+0.1 mg/L IAA,愈伤组织诱导率高达95.8%;愈伤组织分化的最佳培养基为MS+2.0 mg/L ZT+0.2 mg/L IAA,不定芽的分化率高达86.5%。不定芽最适宜的生根培养基为MS+1.0 mg/L NAA,生根率达100.0%。采用草炭土+珍珠岩(体积比1 ∶1)的混合基质作为移栽基质,移栽成活率可达90%以上。
关键词:秘鲁番茄;愈伤组织;植株再生;驯化
中图分类号:S641.204+.3 文献标志码: A文章编号:1002-1302(2017)07-0037-03
番茄(Lycopersion esculentum Mill.)是一种重要的蔬菜作物,其营养丰富,在我国蔬菜周年供应中占有非常重要的位置。随着育种技术的不断发展,番茄品种不断丰富,番茄产量不断提高,但随着设施番茄种植面积的不断增加,番茄病害的发生也逐步加重,特别是番茄病毒病经常呈暴发趋势[1-3],对番茄生产造成了严重危害,并且病害發生时往往以复合侵染的形式危害。现有番茄品种的抗性已不能满足现实的生产需求。同时,番茄属于严格的自花授粉作物[4],经过人类长期的驯化和选育,其栽培种的遗传背景已经变得越来越狭窄,仅依靠现有栽培种已很难满足育种要求。
与栽培番茄资源匮乏相反,番茄属野生种番茄及番茄近缘野生种类番茄(Solanum lycopersicoides)中却拥有丰富的优良遗传性状[5],能抗多种病虫害,有较高的抗旱性、耐盐性和可溶性固形物含量等。秘鲁番茄(L. peruvianum)是栽培番茄的一种近缘野生种,对番茄的多种病害均表现出较强的抗性或免疫性[6],在改良番茄抗性方面具有重要的利用价值,但秘鲁番茄与栽培番茄的有性不亲和障碍问题迄今尚未得到很好解决[7]。通过原生质体融合等远缘体细胞杂交技术,可以将野生番茄属植物或者近缘种的遗传物质转入到番茄栽培种中,创造出具有多抗、高品质的优良性状种质资源,而建立秘鲁番茄高效再生体系是利用体细胞杂交的基础。本试验以秘鲁番茄的叶片和茎段作为外植体,通过添加不同浓度和配比的激素,建立其高效再生体系,为充分利用秘鲁番茄的优异性状奠定基础。
1材料与方法
1.1试验材料
秘鲁番茄植株由东北农业大学李景富教授番茄育种课题组提供。田间取秘鲁番茄的腋芽,进行表面消毒处理后接种于MS基本培养基获得无菌苗。
1.2试验方法
1.2.1外植体的消毒处理田间取刚吐出的秘鲁番茄腋芽,先用洗洁精清洗腋芽,除去表面尘土,自来水冲洗20~30 min,用滤纸吸干水分。移入超净工作台后,先用75%乙醇浸泡15 s,再用0.1% HgCl2浸泡8 min,无菌水冲洗5~6次,无菌滤纸吸干水分,接种于MS基本培养基。
1.2.2愈伤组织诱导将获得的秘鲁番茄无菌苗的叶片切成1 cm×1 cm的小块,将其茎段切成1.0~1.5 cm左右的小段,将这2种外植体分别接种到添加不同浓度ZT(1.0、2.0、3.0 mg/L)和IAA(0.05、0.1、0.2、0.3 mg/L)的培养基上进行诱导培养。
1.2.3愈伤组织的分化将诱导出的愈伤组织转接到添加不同浓度ZT(1.0、2.0、3.0 mg/L)和IAA(0.05、0.1、0.2、0.3 mg/L)的培养基上诱导不定芽的产生。
1.2.4激素对秘鲁番茄生根培养的影响将高1~2 cm的不定芽分切下来,分别转入附加不同浓度IAA(0.5、1.0、1.5 mg/L)和NAA(0.5、1.0、1.5 mg/L)的MS生根壮苗培养基中,以MS基本培养基为对照,20 d后观察统计生根率。
1.2.5幼苗移栽将高5 cm以上、根系发达的健壮幼苗炼苗移栽,每天逐渐打开瓶盖,3 d后完全打开瓶盖,置于通风明亮的常温房间里保持3 d,每天早、中、晚各喷水1次,洗净附着在根系的培养基,移植在草炭土+珍珠岩(体积比1 ∶1)栽培基质上,淋水、罩上透明塑料薄膜保持湿度,7 d后打开保湿罩,20 d后统计成活率。
2结果与分析
2.1秘鲁番茄愈伤组织的诱导
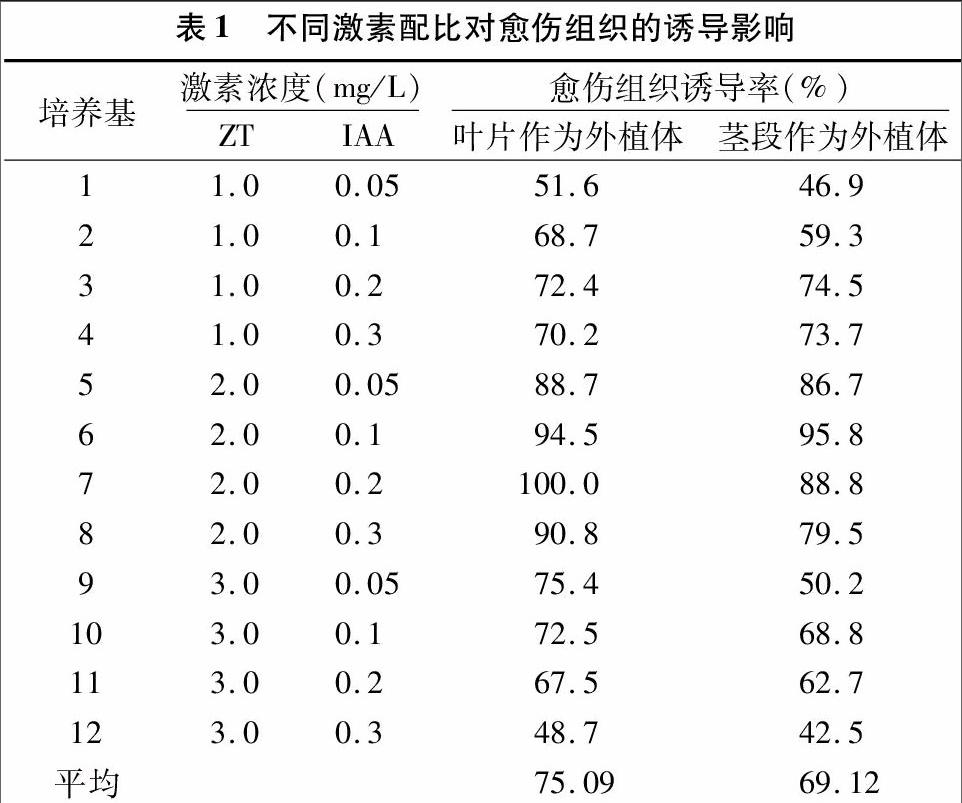
将叶片和茎段2种外植体接种于表1所列的培养基上,接种5 d左右,叶片伤口边缘陆续膨大,叶片出现卷曲,茎段两端迅速膨大,逐渐形成愈伤组织(图1-A)。由表1可见,不同的激素浓度和配比对秘鲁番茄愈伤组织诱导具有较大影响,以叶片作为外植体,当ZT浓度一定时,随着IAA浓度的逐渐提高,愈伤组织诱导率基本呈现先提高后降低的趋势;当IAA浓度一定时,随着ZT浓度的增加,愈伤组织诱导率总体也呈先提高后降低的趋势,但以叶片和茎段作外植体的诱导愈伤率有一定差异,以叶片为外植体时,平均愈伤组织诱导率达75.09%,最佳诱导愈伤培养基为MS+2.0 mg/L ZT+0.2 mg/L IAA,愈伤组织诱导率高达100.0%,愈伤组织结构紧密,颜色浓绿,而以茎段为外植体时,平均愈伤组织诱导率达69.12%,最佳诱导愈伤培养基为MS+2.0 mg/L ZT+0.1 mg/L IAA,愈伤组织诱导率达95.8%,可见秘鲁番茄以叶片作为外植体更易诱导愈伤组织。
2.2秘鲁番茄愈伤组织分化
将生长旺盛的愈伤组织转移至相同的培养基上继续培养,8 d左右愈伤组织上开始出现绿色芽点(图1-B、1-C),接种4周后统计愈伤组织分化率。试验结果表明,不同浓度配比的ZT、IAA对愈伤组织的分化率具有较大影响,采用叶片和茎段作为外植体的愈伤组织分化率也有一定差异。愈伤组织分化的最佳培养基为MS+2.0 mg/L ZT+0.2 mg/L IAA,以叶片为外植体时,不定芽的分化率高达92.4%,平均分化率为70.97%;以茎段为外植体时,不定芽分化率最高达86.5%,平均分化率为64.52%(表2)。
2.3激素对秘鲁番茄生根培养的影响
将高2 cm的不定芽分切下来,分别转入附加IAA和NAA的MS生根壮苗培养基中。秘鲁番茄不定芽生根相对较容易,在不添加激素的MS培养基上生根率达56.7%,但添加IAA或者NAA对生根率具有明显的影响,特别是添加NAA后,生根率明显提高,根系数量多且粗壮,最佳生根培养基为MS+1.0 mg/L NAA,生根率达100.0%,平均生根数达12.9条(表3),根系粗壮,叶色浓绿,植株健壮,适宜移栽驯化(图1-D、1-E)。
2.4试管苗的驯化移栽
选取植株健壮、根系发达的秘鲁番茄试管苗进行炼苗驯化,炼苗后移栽到草炭土 ∶珍珠岩体积比=1 ∶1的花盆中,移栽前应对基质进行消毒。移栽后注意保湿遮阴,开始时可罩上1层塑料薄膜,1周后除去薄膜。通过以上措施,秘鲁番茄试管苗的移栽成活率可达90%以上(图1-F)。
3结论与讨论
普通栽培番茄组织培养中的外植体一般采用子叶、下胚轴、叶片、叶柄等,尤其以子叶作为外植体的居多[8-9]。本试验过程中没有秘鲁番茄种子材料,只能取植株上的叶片和茎段作为外植体。试验结果表明,采用秘鲁番茄的叶片和茎段作为外植体均能建立其高效再生体系,但以叶片作为外植体更适合愈伤诱导和不定芽的分化。激素在植物组织培养再生体系中占有重要作用,一般采用细胞生长素和分裂素结合的方式诱导植株再生[10-11]。本试验表明,以ZT和IAA的激素组合对建立秘鲁番茄再生体系具有较好的作用,以叶片作为外植体时,最佳的愈伤组织诱导培养基为MS+2.0 mg/L ZT+0.2 mg/L IAA,愈伤组织诱导率高达100.0%,愈伤组织结构紧密,颜色浓绿;愈伤组织分化的最佳培养基为MS+2.0 mg/L ZT+0.2 mg/L IAA,不定芽的分化率高达92.4%,平均分化率为70.97%。
番茄不定芽一般生根较容易[12],在不添加激素的MS培养基上也能生根,但所生的根系细长,生根数量也较少,移栽不易成活。本试验也发现,在MS基本培养基上,秘鲁番茄的生根率低,根系数量少,平均仅为3.8条。番茄组织培养中,最常用的诱导生根激素为NAA和IAA。于明礼等发现,在添加IAA的培养基上,栽培番茄不定芽诱导生根的效果最好[10];裴华丽等发现,在添加NAA的MS培养基上,3个栽培番茄品种均达到了最佳生根效果[9]。本试验比较了不同浓度的NAA和IAA对秘鲁番茄不定芽诱导生根的影响,发现添加NAA后的秘鲁番茄的生根效果要好于添加IAA后的生根效果。本研究所建立的秘鲁番茄再生体系为番茄体细胞杂交创新种质资源提供了一定的理论依据和技术支持。
参考文献:
[1]龚一帆. 威胁番茄生产的新病害——番茄黄化曲叶病毒病[J]. 中国蔬菜,2009(21):1-4.
[2]宋晰,师迎春,张世晨,等. 北京地区番茄黄化曲叶病病毒分离物测定及株系的初步鉴定[J]. 植物病理学报,2013,43(2):113-119.
[3]刘永光,魏家鹏,乔宁,等. 番茄褪绿病毒在山东暴发及其防治措施[J]. 中国蔬菜,2014(5):67-69.
[4]Rick C M. Germplasm resources in the wild tomato species[J]. Acta Horticulturae,1986(190):39-47.
[5]Tanksley S,Mccouch S. Seed banks and molecular maps: unlocking genetic potential from the wild[J]. Science,1997,277(5329):1063-1066.
[6]Bai Y,van der Hulst R,Huang C,et al. Mapping Ol-4,a gene conferring resistance to Oidium neolycopersici and originating from Lycopersicon peruvianum LA2172,requires multi-allelic,single-locus markers[J]. Theoretical and Applied Genetics,2004,109(6):1215-1223.
[7]吴定华,梁树南. 番茄远缘杂交的研究[J]. 园艺学报,1992,19(1):41-46.
[8]El-Bakry A A. Effect of genotype,growth regulators,carbon source,and pH on shoot induction and plant regeneration in tomoto[J]. In Vitro Cellular & Developmental Biology-Plant,2002,38(5):501-507.
[9]裴华丽,李美芹,刘永光,等. 不同基因型番茄高效组培再生体系的建立[J]. 北方园艺,2013(3):119-121.
[10]于明禮,张柱岐,张法琴. 中蔬6号番茄高频再生体系的研究[J]. 河南农业科学,2006(4):91-93.
[11]陈丽萍,张丽华,程智慧. 加工番茄离体再生体系的建立[J]. 西北农业学报,2007,16(1):162-167.
[12]陈火英,张建华,钟建江,等. 番茄下胚轴离体培养植株再生及其组织学观察[J]. 西北植物学报,2000,20(5):759-765,图版Ⅰ-Ⅱ.

