无花果酒生产中酶解条件的优化
徐兵,钱超
(常熟理工学院生物与食品工程学院,江苏常熟215500)
无花果酒生产中酶解条件的优化
徐兵,钱超
(常熟理工学院生物与食品工程学院,江苏常熟215500)
针对无花果酒酶解条件优化展开研究。以无花果酒中可溶性固形物含量为指标,通过单因素试验确定最佳pH值、酶解时间、酶解温度以及酶含量,再使用正交设计对无花果酒酶解条件进一步优化,其结果为pH值、酶解时间以及酶解温度在整个试验过程中的作用相对显著,而酶含量对整个试验的影响作用不显著,得到最佳酶解条件为pH3.5,酶解时间为40 min,酶解温度为50℃,在此条件下其可溶性固形物含量为9.4%。
无花果酒;酶解;正交试验
无花果(Ficus carica L.)又称天仙果、蜜果等,果实皮薄无核,肉质松软,风味甘甜,含糖量15%~28%,无花果含有多种对人体有益的营养成分,氨基酸含量最高达400 mg/100 g,具有清热润肠、保肝护肝的功效[1-3]。现代研究表明,无花果富含多酚、香豆、补骨脂素和多糖等具有抗癌、抗肿瘤、镇痛、抑菌作用的成分[4-8]。无花果季节性强,在常温下极不耐贮,易腐烂变质,无花果果酒的酿造,一般是以无花果为原料,通过发酵而成的低度饮料酒,既能延长保存时间,又能保留其药用价值和营养成分[9-10]。本试验对无花果酒生产工艺中涉及到的酶解条件进行优化,旨在为无花果酒生产提供理论依据。
1 材料与方法
1.1 材料与仪器
无花果鲜果:常熟神农果业有限公司;果胶酶(100 000 U/g):无锡锐阳生物技术科技公司。
打浆机(G4460112701):水田打浆机制造厂;电热鼓风干燥箱(WGL-230B):天津市泰斯特仪器有限公司;阿贝折光仪(2WAT):上海光学仪器五厂;分析天平(ATY224):上海英展机电企业有限公司;电子秤(018440):上海越平科学仪器有限公司;pH计(FE20):梅特勒-托利多仪器有限公司;水浴锅(HH-4):金坛市医疗器具场;冰箱(CSSC-SB030):江苏亚科冷链设备有限公司;电磁炉(AE-1106B):北京微讯超技仪器技术有限公司。
1.2 方法
1.2.1 无花果酒制作工艺流程
无花果鲜果→清洗→去蒂以及切分→钝酶→打浆→加入果胶酶→酶解→调整成分→接种酵母→发酵→过滤→无花果原酒→调配→杀菌→无花果果酒
1.2.2 可溶性固形物的测定方法
取5份等量的果浆5 g放入5个50 mL的小烧杯中,然后加入20 g的纯净水,并在每个烧杯中加入试验所需的果胶酶。然后调节试验所需pH值,然后将5个烧杯放入试验所需温度的水浴锅,试验时间达到试验所需后,从水浴锅中取出5个小烧杯,用阿贝折光仪测量其5个烧杯中的溶液的可溶性固形物含量,并记录下其所得的数据[11]。
1.2.3 单因素试验
1.2.3.1 pH值对无花果果胶酶解的影响
以可溶性固形物含量为指标,考察不同pH值对无花果果胶酶解的影响。pH值分别设定为2.5、3.0、3.5、4.0和4.5,酶解时间为60 min,酶解温度为50℃,酶含量为0.075 g。
1.2.3.2 酶解温度对无花果果胶酶解的影响
以可溶性固形物含量为指标,考察不同温度对无花果果胶酶解的影响。温度分别设定为40、45、50、55、60℃,酶解时间为60min,pH值为3.5,酶含量为0.075g。
1.2.3.3 酶解时间对无花果果胶酶解的影响
以可溶性固形物含量为指标,考察不同酶解时间对无花果果胶酶解的影响。酶解时间分别设定为20、40、60、80、100 min,pH值为3.5,酶解为50℃,酶含量为0.075 g。
1.2.3.4 酶含量对无花果果胶酶解的影响
以可溶性固形物含量为指标,考察不同酶含量对无花果果胶酶解的影响。酶含量分别设定为0.025、0.050、0.075、0.100、0.125 g,酶解时间为60 min,酶解为50℃,pH值为3.5。
1.2.4 无花果果胶酶解的正交试验设计
无花果果胶酶解的正交试验设计见表1
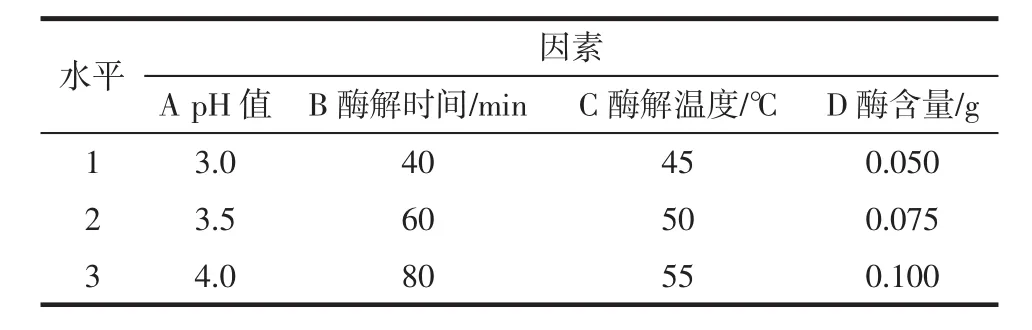
表1 正交试验因素与水平Table 1 Factors and levels of orthogonal test
2 结果分析
2.1 单因素对无花果果胶酶解的影响
2.1.1 pH值对无花果果胶酶解的影响
pH值对无花果果胶酶解的影响见图1。
由图1可知,pH值在3.5左右的时候,可溶性固形物的含量是处在一个高峰值,整个趋势呈现一个山峰状,上半部分是上升趋势,到达最高峰值的时候。随着pH值的变大,可溶性固形物也随之变少,呈现一个下降的趋势。由此可以初步的判断pH值在3.5的时候,可溶性固形物含量最高,达到7.1%。

图1 pH值对果胶酶解的影响Fig.1 The effect of pH on fig pectin enzymatic hydrolysis
2.1.2 酶解时间对无花果果胶酶解的影响
酶解时间对无花果果胶酶解的影响见图2。

图2 酶解时间对果胶酶解的影响Fig.2 The effect of time on pectin enzymatic hydrolysis
由图2可知,可溶性固形物随着酶解时间的变化而改变,一开始随着酶解时间的增加,其可溶性固形物也随之变多,在60分钟时达到峰值,为7.5%,这是因为在整个反应的过程之中。果胶酶不会一下子全部酶解,而是慢慢开始整个过程,但是酶的量是一定的,当全部的酶解结束后,随着时间的增加,其可溶性固形物慢慢降低。
2.1.3 酶解温度对无花果果胶酶解的影响
酶解温度对无花果果胶酶解的影响见图3。
由图3可知,可溶性固形物含量升高,达到酶的最适温度的时候,其可溶性固形物含量最高,温度继续升高的时候,酶失活,导致可溶性固形物降低,当温度在50℃的时候,达到酶的最适温度,酶的活性最高,其含量也最高,达到7.3%。
2.1.4 酶含量对无花果果胶酶解的影响
酶含量对无花果果胶酶解的影响见图4。
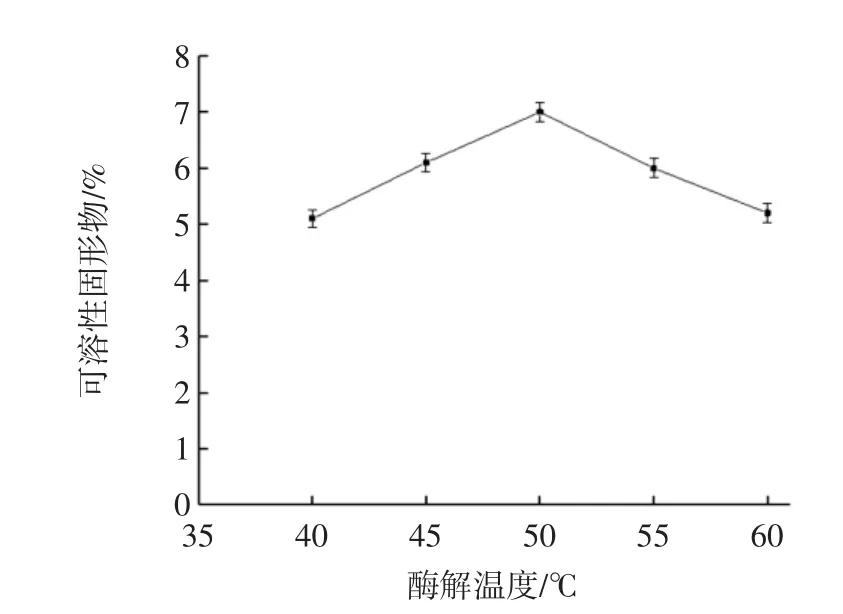
图3 酶解温度对果胶酶解的影响Fig.3 The effect of temperature on pectin enzymatic hydrolysis

图4 果胶酶含量对果胶酶解的影响Fig.4 The effect of enzyme amount pectinase content on pectin enzymatic hydrolysis
由图4可知,所加的酶的量对酶解的结果影响不大,酶的量在不同情况下,其可溶性固形物的含量忽高忽低,一直在4.8%左右,几乎不变,所以酶含量对酶解影响不大。
2.2 无花果果胶酶解的正交试验结果
无花果果胶酶解的正交试验结果见表2。酶解时间和酶解温度在整个试验过程中的作用相对显著,而酶含量对整个试验的影响作用不显著,确定了pH值、酶解时间以及酶解温度为无花果果胶酶解的关键因素,最后,得到最佳发酵条件为pH3.5,酶解时间为40 min,酶解温度为50℃,酶含量为0.050 g在此条件下其可溶性固形物含量为9.4%。
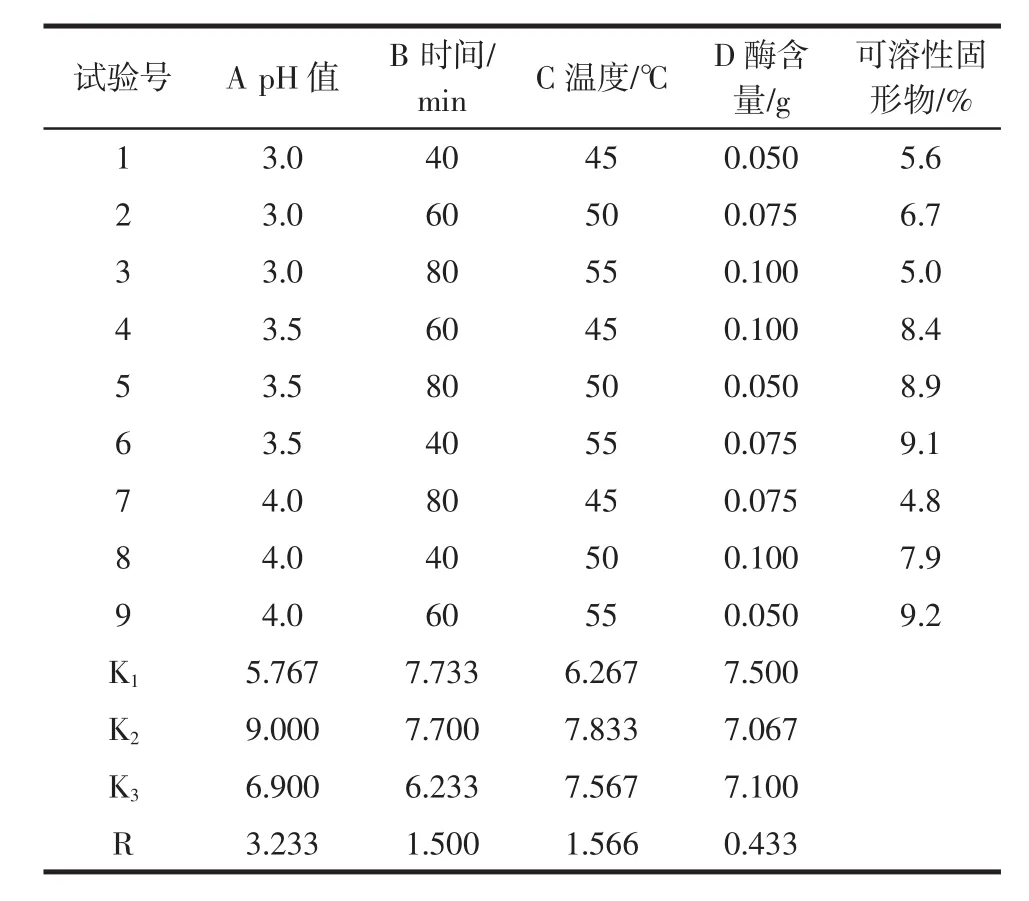
表2 正交试验方案及结果Table 2 Orthogonal experimental method and results

表3 正交试验方差分析表Table 3 Orthogonal experiment anova table
试验数据用正交试验设计软件进行分析,结果如表2所示,各因素对无花果果胶酶解的最佳条件为A2B1C2D1,即最佳酶解工艺组合为pH3.5,酶解时间为40 min,酶解温度为50℃,酶量为0.050 g。由正交试验方案的方差分析表来看,当F值>F临界值时,表示这个单因素对该反应过程的影响是显著的,当F因子>F0.01时,则称此因素的作用是高度显著的。在4个单因素的试验中,pH值、酶解时间以及酶解温度对无花果果胶酶解的影响作用为显著作用,而酶含量的影响却不显著,对整个反应的过程影响力不大。
2.3 验证试验
使用正交试验设计对无花果果胶酶解优化条件进行3组平行验证试验,当取得酶解温度50℃,pH3.5,酶解时间40 min时,酶含量0.050 g时,最终得出可溶性固形物为9.4%,的最优条件。高于正交表中可溶性固形物含量最高的第9组及其它各组处理,证实了此优化结果的可靠性。
3 结论
本试验对无花果酒酶解条件优化展开研究。以无花果酒中可溶性固形物为指标,通过单因素试验确定了最佳pH值、酶解时间、酶解温度以及酶含量再经过使用正交设计软件来研究这4个单因素之间对无花果酒酶解条件的影响作用的显著性,正交结果为:pH值、
[1] 李冰成.无花果杏果抽提物抗癌疗效显著[J].国外科技,1987(4): 32.
[2]尹卫平,陈宏明,王天欣,等.无花果抽提物抗肿瘤成分的分析[J].新乡医学院学报,1995(4):316-319
[3]苏新医学院.中药大词典[M].上海:上海人民出版社,1977:341
[4] Wang X J,Yuan S L,Wei Y Q.Cancer preventive effect and anticancer activity of p Iant Po Iypheno Is[J].Nat Prod Res Dev,2005,17 (4):508-517
[5] Mao X W,Chen Y D,Yang L,et al.Study on main composition extraction separation of Fig and application[J].J Chem Indus Forest Prod,1998(6):22-25
[6] Robert V,Mateja C,Franci S.Phenolic acids and flavonoids of fig fruit(Ficus carica L.)in the northern mediterranean region[J].Food Chemistry,2008,16(1):153-157
[7] Shai Rubnov,Yoel Kashman,Ruth Rabinowitz,et al.Suppressors of cancer cell proliferation from fig(Ficus carica)resin:Isolution and structure elucidation[J].Journal of Natural Products,2001,64(7): 993-996
[8] Agabeili R A,Kasimova T E.Antimutagenic activity of armoracia rusticana,zea mays and ficus carica plant extracts and their mixture [J].Tsitol Genet,2005,39(3):75-79
[9] 王琳,岳田利.发酵型无花果酒酿造工艺研究[J].中国酿造,2005 (10):59-62
[10]左勇,刘利平,鞠帅.无花果酒发酵条件的优化[J].食品科技,2014 (1):95-98
[11]张红域,彭志英.转谷氨酰胺酶在食品中的应用[J].食品与发酵工业,1998(3):73-76
The Optimiztion of Enzymatic Hydrolysis Condition for the Fig Wine Production
XU Bing,QIAN Chao
(College of Biology and Food Engineering,Changshu Institute of Technology,Changshu 215500,Jiangsu,China)
The study of optimization of enzymatic hydrolysis conditions of fig wine was done.As the index of soluble solids in fig wine,the optimal pH,enzymatic hydrolysis time,temperature and enzyme amount were assigned by the single-factor experiment.Through orthogonal design software,the effect of these four single factors on the enzymatic hydrolysis conditions on fig wine was studied.The results showed,pH,enzymatic hydrolysis time and temperature were in the relatively significant roles,while the enzyme amount was not related signifi-cantly.The optimum fermentation conditions was that pH 3.5,the enzymatic hydrolysis time of 40 min,the temperature of 50℃.Under this condition,the soluble solids content was 9.4%.
fig wine;enzymatic hydrolysis;orthogonal design
10.3969/j.issn.1005-6521.2017.10.024
2016-08-17
徐兵(1982—),男(汉),实验师,硕士,研究方向:食用菌学。

