低氧诱导因子-1α介导鼠胚成骨细胞凋亡的实验探讨
施华丽
(浙江医学高等专科学校, 浙江 杭州 310053)
低氧诱导因子-1α介导鼠胚成骨细胞凋亡的实验探讨
施华丽
(浙江医学高等专科学校, 浙江 杭州 310053)
目的探讨低氧诱导因子-1α参与介导的鼠胚成骨细胞凋亡实验特点。方法由本文作者与某医科大学中心实验室合成完成鼠胚成骨细胞原代培养、鉴定;行成骨细胞低氧状态下培养。结果经氯化钴处理后,低氧组Caspase-3mRNA和HIF-1α的表达呈渐趋增加表现,具统计差异(P<0.05),经观察,除第0d外,均较常氧组高(P<0.05),而各时间段常氧组变化不明显(P>0.05)。Bcl-2mRNA表达呈下降显示,除0d外,均较常氧组低(P<0.05),各时间段常氧组变化无差异(P>0.05)。结论氯化钴可对低氧状态化学模拟,使成骨细胞有大量的HIF-1α表达,其可通过对Bcl-2和Caspase-3的表达调节,对成骨细胞凋亡加以促进,且此种促进作用与细胞缺氧的时间具密切相关性。
低氧诱导因子-1α;鼠胚成骨细胞;凋亡试验
骨折愈合有众多细胞参与,机制较为复杂,所处的愈合阶段不同,参与的细胞也存在较大差异,但以一些骨系细胞为主,如破骨细胞、成骨细胞等。骨折发生后,创伤处呈低氧状态,在骨折愈合过程中,低氧诱导因子-1α起着重要的调控作用[1]。本次研究从细胞凋亡角度展开探讨,了解在氯化钴诱导的化学模拟低氧条件下,对鼠胚成骨细胞凋亡情况进行研究,探讨其凋亡途径,现回顾结果如下。
1 资料与方法
1.1 实验动物和仪器、试剂
由Gibco公司对高糖DMEM培养基提供,由大连宝生物公司对DL2000DNA Marker提供,实验动物及其余试剂由某医科大学动物中心及PCR实验室提供。
1.2 方法
(1)由本文作者与某医科大学中心实验室合成完成鼠胚成骨细胞原代培养、鉴定;(2)成骨细胞低氧状态下培养:取第3代传代培养的细胞,培养液为含125umol/L终浓度氯化钴的DMEM,行不同时间的培养,对缺氧情况化学模拟;(3)依据RNA提取盒相关操作步骤,对总RNA提取,行OD260、OD280吸光值测定,对RNA提取结果检测。(4)从GeneBank中查找 GAPDH等序列,对引物设计。利用TaKaRa一步法检测半定量RT-PCR;(3)测定PCR:取PCR产物5微摩尔,实施2%琼脂糖凝胶电泳操作,在紫外灯下实施细致观察,经凝胶扫描系统实施光密度计分扫描,计算HIF-1a等与CAPDH光密度积分比值,并完成相关定量分析。(4)抽取蛋白质及分析Western blot:对呈对数生长期的相关细胞收获,用三去污裂解液重悬细胞,并行3~5 min反复吹打,完成混匀操作后,于4度条件下,行温育20 min操作,在12000转离心操作20 min,将上清取出,作为细胞总蛋白质,在-70度分装储存。取蛋白质样品50~100 μg与等体积上样缓冲液混合,变性5 min,于8%或12%聚丙烯酰胺凝胶样品孔中加载,以恒压60 v电泳至溴酚蓝达凝胶底边,将凝胶取出,用电转仪行转移1~3 h操作,室温封闭8%脱脂奶粉2 h,分别取Caspase-3多克隆抗体、人兔抗鼠Bcl-2于4度条件下温育过液,后取酶标记的山羊抗兔IgG室温温育2 h,ECL显色,对结果观察。
1.3 统计学分析
采用spss13.0统计学软件,计数资料行χ2检验,P<0.05具统计学差异。
2 结果
经氯化钴处理后,低氧组Caspase-3mRNA和HIF-1α的表达呈渐趋增加表现,具统计差异(P<0.05),经观察,除第0 d外,均较常氧组高(P<0.05),而各时间段常氧组变化不明显(P>0.05)。Bcl-2mRNA表达呈下降显示,除0d外,均较常氧组低(P<0.05),各时间段常氧组变化无差异(P>0.05)。见表1。
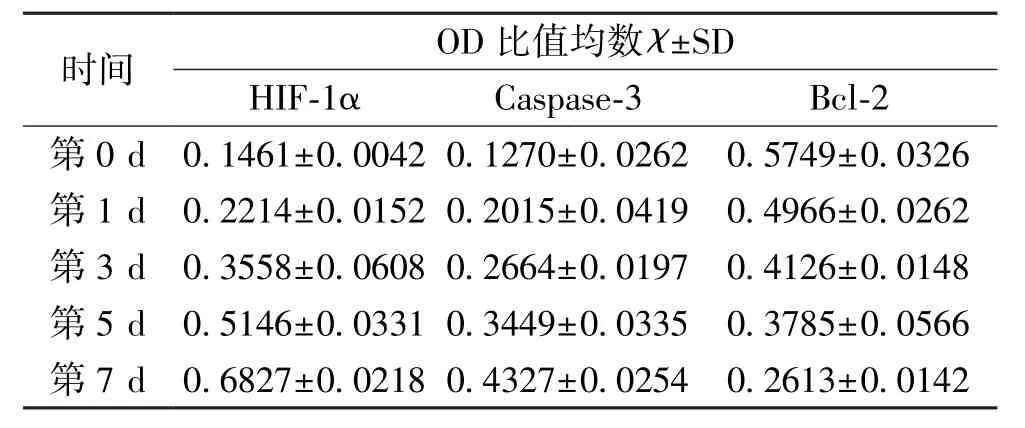
表1 各时间段RT-PCR测得的相关指标表达
3 讨论
骨折愈合病理生理过程均较复杂,骨折发生时,常造成程度不等的骨折端及附近血管、骨膜受损,促使骨折端局部呈缺氧、缺血状况,心氧分压在创伤中可呈0~2%降低[2]。后机体经各种机制,可促使骨折部位发生再血管化,使此部位血供渐趋提高,正常的氧分压得以恢复。机体需再血管化的时间通常约1~2周。但创伤发生后,在氧浓度下降时,复杂的骨再生过程即已开始。在缺氧过程中,机体会有一种由低氧信号参与调控的转录因子-HIF-1α表达。多项研究已证实,HIF-1α在骨折愈合过程中,可通过对VEGF的表达诱导,对骨折处血管生成加以促进,进而加快骨折愈合进程[3]。此外,在骨折愈合早期,在成骨细胞凋亡进程中,HIF-1α可能发挥中枢纽带价值。
细胞凋亡主要经2种途径,属细胞自身程序性死亡,一种是死亡依赖途径,由 Caspase家族的分子参与,以Caspase-3最为常见;另一种为线粒体依赖途径,由Bcl-2分子参与。Caspase-3属对凋亡有促进作用分子,而Bcl-2属对凋亡抑制的分子。据相关研究示,依据细胞类型差异,HIF-1α对细胞凋亡除有促进作用产生外,也有抑制作用产生[4-5]。如HIF-1α可经结合ARNT形成二聚体,进而对多数肿瘤细胞凋亡抑制,在肿瘤侵袭过程中发挥促进作用;相反,HIF-1α对神经元细胞、椎间盘细胞的凋亡具一定的促进作用。本次研究结果也证实,相较常氧组,低氧环境下的成骨细胞有较高的发生凋亡的比例,故低氧环境对成骨细胞的凋亡有促进作用。
综上,氯化钴可对低氧状态化学模拟,使成骨细胞有大量的HIF-1α表达,其可通过对Bcl-2和Caspase-3的表达调节,对成骨细胞凋亡加以促进,且此种促进作用与细胞缺氧的时间具密切相关性。
[1] Paveenarat Aukkarasongsup,Naoto Haruyama,Tsutomu Matsumoto,et al.Periostin inhibits hypoxia-induced apoptosis in human periodontal ligament cells via TGF-β signaling[J].BBRC,2013,441 (1):126-132.
[2] 周 年,黄 伟,廖军义,等.低氧诱导因子-1α对骨形态发生蛋白2诱导的干细胞成软骨、成骨分化的影响[J].第三军医大学学报,2014/12.
[3] 赵焕新,李晓宇,姚 红,等.低氧后处理诱导的低氧诱导因子-1α表达上调减轻H9c2心肌细胞低氧/复氧损伤[J].生理学报,2013/03.
[4] 潘星辰,周韶璋,戴 辉,等.低氧诱导因子-1α mRNA在克唑替尼诱导H2228细胞凋亡中的作用[J].广东医学,2014/13.
[5] 景绍武,赵志军,景尚华,等.低氧诱导因子-1α与鼻咽癌临床病理特征相关性Meta分析[J].中华肿瘤防治杂志,2015/07.
浙江省医药卫生科技项目项目编号:2014KYA049。
本文编辑:彭晚林
R-332
B
ISSN.2095-8242.2017.12.2373.02

