个体化补充叶酸预防新生儿缺陷性疾病的临床观察
魏海青,徐新磊,王方娜,杜洁贤
(1.石家庄医学高等专科学校药理教研室,河北 石家庄 050000;2.河北省丰宁满族自治县计划生育技术服务站,河北 丰宁 068350;3.河北省人民医院优生优育科,河北 石家庄 050051;4.河北医科大学第二医院妇科,河北 石家庄 050000)
·论 著·
个体化补充叶酸预防新生儿缺陷性疾病的临床观察
魏海青1,徐新磊2,王方娜3,杜洁贤4*
(1.石家庄医学高等专科学校药理教研室,河北 石家庄 050000;2.河北省丰宁满族自治县计划生育技术服务站,河北 丰宁 068350;3.河北省人民医院优生优育科,河北 石家庄 050051;4.河北医科大学第二医院妇科,河北 石家庄 050000)
目的探讨不同叶酸利用能力的孕妇在孕期个体化补充叶酸后对新生儿缺陷性疾病的影响。方法从婚前检查并有生育准备的4 896例孕龄妇女中,挑选1 416例自愿进行叶酸利用能力基因检测的孕妇作为观察组,采用Taqman-MGB技术,对5,10-亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)的A1298C、C677T 2个基因位点和甲硫氨酸合成还原酶(methionine synthase reductase,MTRR)A66G基因位点的基因型进行检测,并根据以上各基因位点功能、纯合、野生及出现频率进行分析。将叶酸利用能力基因检测结果分级(正常、略差、较差、很差),从中选取检测结果较差和很差的孕妇,对其个体化口服补充叶酸并定期产检;选择1 416例同期进行定期产检但没有接受叶酸利用能力基因检测的孕妇作为对照组,按照400 μg/d的剂量常规口服补充叶酸并定期产检。分别记录以上2组孕妇的新生儿神经管缺陷性疾病(脊柱裂、无脑儿、脑膨出、脑脊髓膜膨出、唇裂、腭裂)发生情况。结果①观察组MTHFR 2位点基因型和等位基因与中国人群基因型和等位基因分布差异无统计学意义(P>0.05);MTRR位点基因型和等位基因与中国人群基因型和等位基因分布差异有统计学意义(P<0.05)。②观察组叶酸利用能力基因检测存在风险比例达到72.46%。③观察组孕妇生产的新生儿神经管缺陷性疾病发生率明显低于对照组(P<0.05) 。结论采集样本区域育龄妇女叶酸利用能力风险比例超过半数,针对不同孕妇制定不同的叶酸剂量补充方案可以有效降低新生儿神经管缺陷性疾病的发生率。
神经管缺损;叶酸缺乏;新生儿
新生儿神经管缺陷性疾病的发生受到多种因素的影响,遗传因素和环境因素的影响尤为突出,特别是胚胎在孕早期叶酸的缺乏是导致神经管缺陷性疾病发生的主要原因之一。叶酸的缺乏可以导致胎儿出生缺陷,以神经管缺陷性疾病的发生最为明显[1-2]。孕妇在妊娠前和妊娠期增补适量叶酸可有效降低出生缺陷性疾病的发生率[3]。孕妇口服叶酸利用能力的不同,会导致不同程度的叶酸缺乏,叶酸缺乏导致的神经管缺陷性疾病主要包括无脑儿、脊柱裂、脑膨出、唇裂、腭裂等,是一组严重的新生儿先天性异常,也是导致围生儿死亡的主要原因之一,给社会和家庭带来一系列问题。尽管神经管缺陷性疾病的发生率在不同地域、不同种族间存在着差异,但该疾病的发生几乎不分国界,已经在全球范围内引起高度重视[4-6]。孕龄妇女在孕前3个月到怀孕12周每天常规口服400 μg叶酸,对神经管缺陷性疾病的发生具有显著的预防效果。但不同的孕龄妇女在孕前3个月及孕后12周内即便均按照常规补充叶酸,仍然出现一定比例的有神经管缺陷性疾病的新生儿。因此,诸多学者在有关新生儿缺陷性疾病的研究中,除了从遗传因素包括基因检测入手外,更多关注孕妇在孕期增补叶酸剂量的情况。在叶酸补充剂量与神经管缺陷性疾病的跟踪研究中发现,除了食物补充叶酸和口服叶酸外,个体化补充叶酸非常关键。因此,针对不同孕妇在怀孕期间对叶酸需求量的增加和摄入以及利用能力的不同,制定不同的叶酸补充方案或许能够更有效地预防新生儿无脑儿、脊柱裂等神经管缺陷性疾病的发生[7-9]。据卫生部报告,我国每年仍然有超过90万新生儿发生缺陷性疾病,排在前5位的包括先天性心脏病、神经管畸形、唇腭裂、唐氏综合征、多指(趾),这些多与孕妇叶酸缺乏有一定关系[10-11]。另据统计,我国每年出生的神经管缺陷性疾病患儿达6万以上[12-13]。可见,科学补充叶酸预防新生儿缺陷性疾病的发生尤为重要。本研究主要针对是否参加叶酸利用能力基因检测并进行个体化补充叶酸的2组孕妇新生儿缺陷性疾病发生情况,探讨孕龄妇女通过叶酸利用能力基因检测制定不同叶酸剂量补充方案的必要性。
1 资料与方法
1.1 一般资料 从2013年12月—2015年12月在河北省丰宁满族自治县计划生育服务站、河北省人民医院、河北医科大学第二医院进行婚前检查并有生育准备的4 896例孕龄妇女中挑选出1 416例自愿进行叶酸利用能力基因检测的孕妇为观察组,年龄21~35岁,平均(27.5±2.1)岁;选择同期进行定期产检,但没有接受叶酸利用能力基因检测,只是按照400 μg/d 的剂量常规口服补充叶酸的1 416例孕妇为对照组,年龄20~34岁,平均(26.8±2.3)岁。2组孕妇年龄、孕产次数、定期检查方法差异均无统计学意义(P>0.05),具有可比性。
1.2 采集DNA样本方法 采用咽拭子法采集DNA样本,观察组孕妇用生理盐水漱口,然后取出采样器里的咽拭子,小心靠近被检者口腔黏膜,在口腔黏膜刮取脱落细胞,送实验室提取DNA。
1.3 叶酸利用能力基因检测 采用Taqman-MGB技术,对观察组孕妇5,10-亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)的C677T、A1298C 2个基因位点和甲硫氨酸合成还原酶(methionine synthase reductase,MTRR)的A66G的基因位点进行基因型检测,并根据以上各基因位点功能、纯合、野生及出现频率,对其进行叶酸利用能力风险等级评估。
1.4 补充叶酸的方法 ①观察组个体化口服补充叶酸方法:对叶酸利用能力基因检测结果为正常或略差的孕妇,在孕前3个月及孕早期按照400 μg/d的剂量常规口服补充叶酸,但略差的孕妇需要在孕中/后期(13~40周)继续补充叶酸400 μg/d,同时增加食物中叶酸的摄入量;对于叶酸利用能力基因检测结果为较差的孕妇,孕前3 个月口服叶酸的剂量为400 μg/d,孕早期(0~12周)口服叶酸的剂量为800 μg/d,孕中/后期(13~40周)口服叶酸的剂量为400 μg/d,同时注意食物中叶酸的摄入量;对于叶酸利用能力基因检测结果为很差的孕妇,除全程注意食物中叶酸摄入量外,孕前3 个月口服叶酸的剂量为800 μg/d,孕早期(0~12周)口服叶酸的剂量为800 μg/d,孕中/后期(13~40周)口服叶酸的剂量为400 μg/d。②对照组口服补充叶酸方法:对照组孕妇均按照400 μg/d的剂量常规口服补充叶酸,同时增加食物中叶酸的摄入量。
1.5 新生儿神经管缺陷性疾病的观察方法 对2组孕妇进行全程跟踪,严格按以上方法口服补充叶酸及增加食物中摄入量,并定期产检(检测出死胎及缺陷引产的病例不计入出生缺陷的统计),直到新生儿出生,观察新生儿神经管缺陷性疾病发生情况。
1.6 统计学方法 应用SPSS 13.0软件进行统计学分析。对基因频率采用Hardy-Weinberg遗传平衡检验;计数资料比较采用拟合优度χ2检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 观察组孕妇MTHFR、MTHFR基因频数和频率分布结果 对采集到的1 416例观察组孕妇的样本进行MTHFR基因 A1298C和 C677位点以及 TMTRR基因A66G位点的检测,并将数据进行Hardy-Weinberg遗传平衡检验,检验结果与Hardy-Weinberg平衡相符。MTHFR的A1298C位点野生型(AA)、纯合突变型(CC)、杂合型(AC)的分布以及C677T 位点野生型(CC)、纯合突变型(TT)和杂合型(CT)的分布与中国人群中频率差异无统计学意义(P>0.05);MTRR基因的A66G位点野生型(AA )、纯合突变型(GG)、杂合型(AG)的分布与中国人群中频率差异有统计学意义(P<0.05)。见表1。
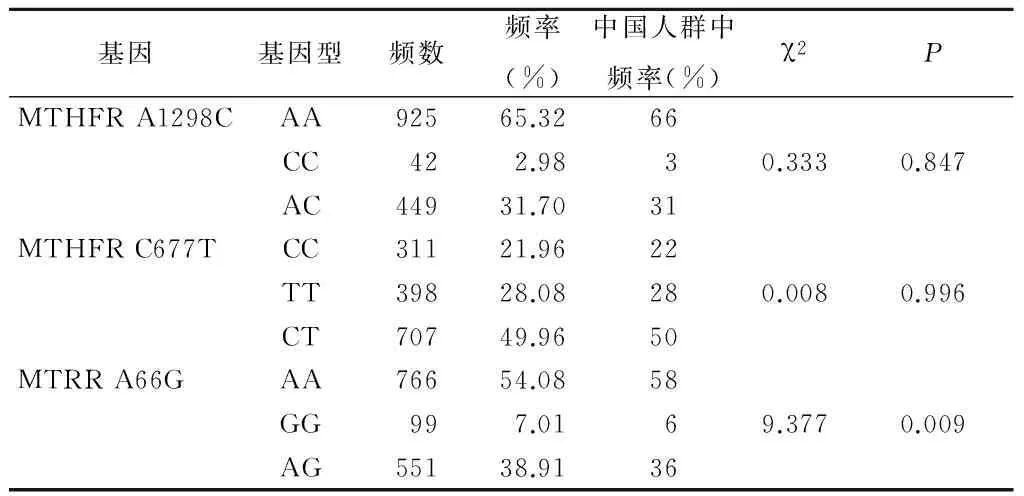
表1 观察组MTHFR、MTHFR基因型频数和频率分布情况Table 1 Frequency and frequency distribution of MTHFR and MTHFR genotypes in observation group
2.2 观察组孕妇MTHFR、MTHFR等位基因频数和频率分布结果 对采集到的1 416例观察组孕妇的样本进行MTHFR基因A1298C和C677T、MTRR基因A66G位点等位基因检测,统计采集样本各位点突变基因的基因频率。MTHFR基因A1298C和C677T 2个位点的等位基因频率分布与中国人群中频率差异均无统计学意义(P>0.05);MTRR基因的A66G位点等位基因频率分布低于中国人群中频率,差异有统计学意义(P<0.05)。见表2。
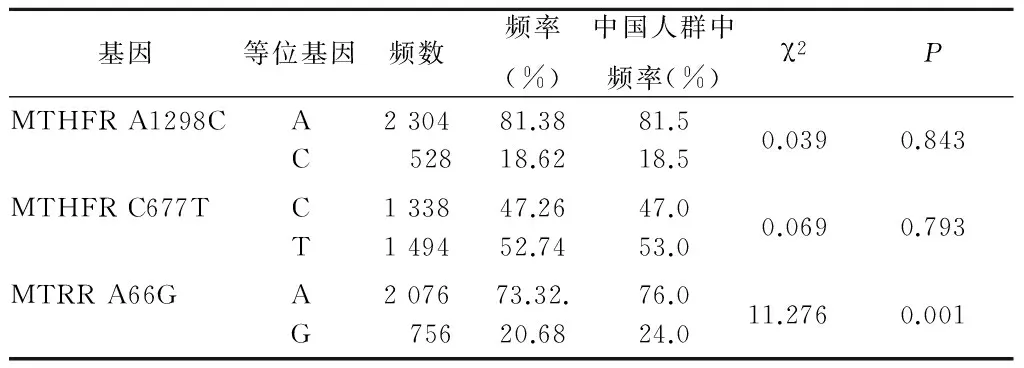
表2 观察组MTHFR、MTRR等位基因频数和频率分布情况Table 2 Frequency and frequency distribution of MTHFR and MTHFR alleles in the observation group
2.3 观察组孕妇的叶酸利用能力风险等级情况 根据送检的结果,对观察组1 416例孕妇的各基因位点功能、纯合、野生及出现频率进行分析,其叶酸利用能力风险基因检测未发现风险的占19.63%(278/1 416),低度风险的占7.91%(112/1 416),中度风险的占29.38%(416/1 416),高度风险的占43.08%610/1 416),具有中、高度风险的达到72.46%[(416+610)/1 416],见表3。
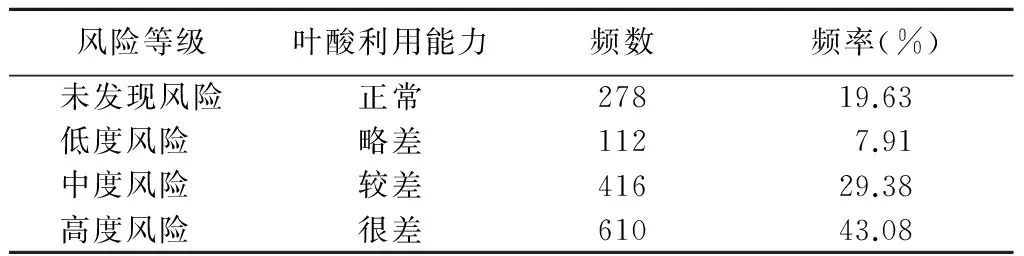
表3 观察组叶酸利用能力基因检测风险等级情况Table 3 The level of folic acid utilization ability in the observation group
2.4 2组新生儿神经管缺陷性疾病比较 观察组孕妇生产的新生儿观察到唇裂1例(0.07%),未观察到脊柱裂、无脑儿、脑膨出、脑脊髓膜膨出、腭裂神经管缺陷;对照组孕妇生产的新生儿观察到神经管缺陷9例(0.64%)。观察组神经管缺陷性疾病发生率明显低于对照组,差异有统计学意义。见表4。
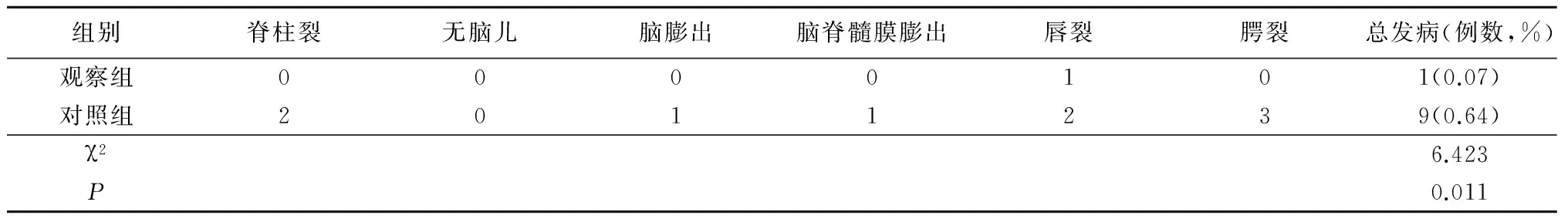
表4 2组新生儿神经管缺陷性疾病比较Table 4 Observation of neonatal neural tube defects in the 2 groups (n=1 416,例数)
3 讨 论
出生缺陷的原因比较复杂,发生机制尚不十分明了,多数认为与家族遗传和环境因素有关,或者是多种因素共同作用的结果。在我国,新生儿出生缺陷中,先天性心脏病、神经管缺陷性疾病、唐氏综合征等较为常见,新生儿缺陷总发病率在5.6%左右,这些都与叶酸的缺乏有关。MTHFR是叶酸代谢的关键酶,在体内催化5,10-亚甲基四氢叶酸转换成5-甲基四氢叶酸,为同型半胱氨酸提供甲基形成甲硫氨酸。MTHFR有多种突变,主要为A1298C和C667T的突变,A1298C的基因多态性为1 298位点上的碱基A被替换成C,导致谷氨酸被替换成丙氨酸,C667T的基因多态性表现为677位点上的碱基C被替换成T,导致丙氨酸被替换成缬氨酸,这些突变可使MTHFR的活性下降,如果2个位点同时突变,可显著降低MTHFR的活性[14]。因此,预防新生儿缺陷性疾病的发生非常值得关注,且一定要早期预防、早期发现。在常见的新生儿缺陷性疾病中,神经管缺陷性疾病相对容易发现和鉴别,从解剖的角度分析,中枢神经系统包括大脑和脊髓,如果胎儿在早期由于叶酸缺乏很可能出现神经管不能闭合,出现神经管畸形,如无脑儿、脊柱裂、唇裂、腭裂、脑积水、死胎或者出生后夭折等,即便经过后天治疗能够存活下来,也常常伴有心理障碍或精神与身体等方面的异常[15-16]。脊柱裂的发生,往往与胚胎早期形成过程中脊柱未能完全闭锁有关;无脑儿的发生与胚胎形成过程中的脑及头盖骨发育异常有关;腭裂是胎儿在胚胎发育第4周到第12周颜面形成和融合期时由于各种原因未能正常融合,导致先天性腭裂形成;唇裂是口腔颌面部常见的先天性畸形,属于多基因遗传性疾病,其发生与遗传因素和环境因素如孕期叶酸缺乏等有关[17]。
近年来,我国神经管缺陷性疾病的患儿出生率呈上升趋势,而孕前3个月及妊娠早期科学补充叶酸可以有效预防该疾病的发生。可见,叶酸作为B族维生素之一,对于孕龄妇女不可或缺。目前较为常用的口服的叶酸增补剂中,其主要的叶酸化合物是人工合成的单谷氨酸,这种人工合成的叶酸化合物的生物利用率比通过食物摄取获的叶酸化合物利用率高得多,故口服补充小剂量的叶酸尤为必要。由于身体自身不能合成叶酸,一定要注意口服叶酸的同时进行饮食的调整,多食用一些含有叶酸较高的蔬菜、水果等,必要时通过一些视频的强化教育改善自身叶酸水平,以满足妊娠期妇女及胎儿对叶酸的大量需求[18]。在国外,也同样重视预防新生儿神经管缺陷的发生,通常采用食物补充、食品强化、口服叶酸等多种方式多管齐下。口服补充叶酸是当前预防新生儿缺陷性疾病发生的常规而有效的途径。但由于不同个体,叶酸利用能力的不同,采用常规相同剂量补充叶酸显然有待矫正[19]。本研究中,观察组孕妇通过自愿选择进行叶酸利用能力的基因检测,然后根据检测的结果,指导其科学合理补充叶酸,通过不同孕期口服剂量的调整,有针对性地制订了个体化补充叶酸的方案,其新生儿神经管缺陷性疾病的发生率明显低于对照组(P<0.05)。
综上所述,孕龄妇女在孕前3个月至孕早期直至新生儿出生,通过基因检测进行个体化补充叶酸能更加有效地预防新生儿神经管缺陷性疾病的发生。
[1] 蒙绍建.5 688例唐氏综合征产前筛查结果分析[J].右江医学,2014,42(5):627-628.
[2] 沈婷婷,沈玲萍.余姚地区2008-2012年神经管缺陷检测分析[J].中国优生与遗传杂志,2014,22(4):97,112.
[3] 于宏杰.孙思飞.袁红.围孕期补充叶酸预防神经管缺陷的概况[J].上海预防医学,2014,26(6):328-329,334.
[4] 沈丽娟.余姚地区妇女增补叶酸预防神经管缺陷项目实施效果分析[J].中国优生与遗传杂志,2014,22(5):107-108.
[5] 孙喜红,王志平,赵仲堂.增补叶酸预防神经管缺陷的效果及影响因素[J].中华疾病控制杂志,2009,13(5):568-572.
[6] 王蒙.神经管缺陷影响因素研究[D].济南:山东大学,2014.
[7] 李方,林茜.增补叶酸预防神经管缺陷:研究进展与展望[J].中国儿童保健杂志,2015,23(11):1166-1168.
[8] 李新伟.新生儿出生缺陷监测与遗传性疾病的筛查研究[J].中国妇幼保健,2015,30(21):3653-3657.
[9] 柏如海,章琦,王玲玲,等.2010-2013年西安市新生儿出生缺陷发生状况及其影响因素研究[J].中国全科医学,2016,19(26):3149-3152.
[10] 骆珊,罗方举,卓贵椰,等.关于开展汕尾市新生儿疾病筛查模式研究[J].中国医药科学,2015,5(14):35-37.
[11] 马庆祥.2011至2013年某区新生儿疾病筛查情况分析研究[D].济南:山东大学,2015.
[12] 刘美.新生儿出生缺陷的监测情况探讨[J].中外医学研究,2014,12(33):62-63.
[13] 李琦.李俊华.新生儿神经管缺陷的相关因素分析[J].中国实用神经疾病杂志,2014,17(3):61-62.
[14] 罗世强,邱萍,严提珍,等.广西柳州地区苗族女性MTRR和MTHFR基因多态性分布研究[J].中国优生与遗传杂志,2015,23(9):20-23.
[15] 祝德营,戴智勇,李勇.叶酸与出生缺陷关系的研究进展[J].食品与营养科学,2014,3(2):11-15.
[16] 云小云,欧凤荣.叶酸缺乏与出生缺陷相关性研究[J].实用药物与临床,2016,19(2):244-248.
[17] 秦亚娟.叶酸可预防新生儿神经管畸形[J].生物技术世界,2014,(10):145.
[18] 张洁琼,徐东萍.亚甲基四氢叶酸还原酶基因多态性与先天神经管缺陷的相关性研究[J].中国现代医生,2014,52(13):16-18.
[19] 李琦,李俊华.新生儿神经管缺陷的相关因素分析[J].中国实用神经疾病杂志,2014,17(3):61-62.
(本文编辑:许卓文)
Clinical observation of individualized folic acid supplementation in the prevention of neonatal diseases
WEI Hai-qing1, XU Xin-lei2, WANG Fang-na3, DU Jie-xian4*
(1.DepartmentofPharmacology,ShijiazhuangMedicalCollege,Shijiazhuang050000,China; 2.TheFamilyPlanningTechnicalServiceStation,ManchuAutonomousCountyofFengning,HebeiProvince,Fengning068350,China; 3.DepartmentofEugenics,HebeiGeneralHospital,Shijiazhuang050051,China; 4.DepartmentofGynecology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China)
Objective To investigate the effect of folic acid supplementation during pregnancy on the newborn infants with neural tube defects diseases. Methods Among 4 896 pregnant women who had been examined before marriage and were prepared for childbearing, a total of 1 416 pregnant women as the observation group were selected for gene testing, Using Taqman-MGB technology, genotype were performed in 5, 10-methylenetetrahydrofolate reductase(MTHFR) A1298C and C677T gene loci and methionine synthase reductase(MTRR) A66G gene loci. According to the above gene function, homozygous, wild and frequency were analyzed. Ability to use folic acid gene detection was classified(normal, slightly poor, poor and very poor). Poor and very poor pregnant women were selected for individual oral folic acid supplementation and regular antenatal examination. A total of 1 416 pregnant women cases was defined as the control group, who did not receive folic acid by gene detection, only in accordance with the dose conventional oral folic acid 400 g/day and regular antenatal examination. Newborn neural tube defect disease(spina bifida and anencephaly, encephalocele, meningocele, incidence of cleft lip and palate) of 2 groups were recorded. Results ①There was no significant difference in genotype and allele distribution in MTHFR two gene loci in the observation group and the Chinese population in the observation group(P>0.05). There was significant difference in genotype and allele distribution in. MTRR gene loci in the observation group and the Chinese population in the observation group(P<0.05). ②The ratio of folic acid utilization ability to detect gene was 72.46% in the observation group . ③The incidence rate of neural tube defects in pregnant women in the observation group was significantly lower than that of observation group(P<0.05). Conclusion More than half of the folic acid utilization ability of women of childbearing age in the sample area was collected, and different folic acid supplementation scheme could effectively reduce the incidence of neural tube defects.
neural tube defects; folic acid deficiency; neonate
2017-02-07;
2017-03-13
河北省医学科学研究重点课题(ZL20140314)
魏海青(1970-),女,河北迁安人,石家庄医学高等专科学校副教授,医学硕士,健康管理学博士,从事药理学及健康管理学研究。
*通讯作者。E-mail: 630705975@qq.com
R742.89
A
1007-3205(2017)05-0561-05
10.3969/j.issn.1007-3205.2017.05.015

