EC-SOD在肾缺血再灌注损伤大鼠脑内的表达变化
郝 斌,王 切,王素玲,王 磊*
(1.河北省沧州市中心医院泌尿外科,河北 沧州 061001; 2.河北医科大学基础医学院人体解剖学教研室,河北 石家庄 050017;3.河北省血液中心检验科, 河北 石家庄 050071)
·论 著·
EC-SOD在肾缺血再灌注损伤大鼠脑内的表达变化
郝 斌1,王 切2,王素玲3,王 磊2*
(1.河北省沧州市中心医院泌尿外科,河北 沧州 061001; 2.河北医科大学基础医学院人体解剖学教研室,河北 石家庄 050017;3.河北省血液中心检验科, 河北 石家庄 050071)
目的观察细胞外超氧化物歧化酶(extracellular superoxide dismutases,EC-SOD)在肾缺血再灌注损伤(renal ischemia reperfusion injury,RIRI) 大鼠脑内的表达变化,探讨EC-SOD在脑抗氧化应激反应中的作用。方法选用健康雄性Wistar大鼠12只,随机分为对照组和RIRI组各6只,RIRI组切除大鼠右肾后,用无损伤动脉夹夹闭大鼠左肾动脉,45 min后移去动脉夹,恢复大鼠左肾血液供应,建立大鼠肾缺血再灌注损伤模型。待左肾动脉再灌注24 h后麻醉大鼠取材(血、肾、脑)。对照组大鼠只分离左肾动脉并不夹闭。选用苦味酸和酶偶联速率法,检测2组大鼠血清中血尿素氮(blood urea nitrogen,BUN)、血清肌酐(serum creatinine,SCr)浓度;苏木精-伊红染色光镜观察实验大鼠肾组织形态变化;采用硫代巴比妥酸比色法检测2组大鼠脑内丙二醛(malondialdehyde,MDA)含量;应用逆转录聚合酶链反应和western blot法,测定大鼠脑内EC-SOD mRNA与蛋白的表达水平。结果RIRI组大鼠血清中BUN和SCr浓度明显高于对照组,RIRI组大鼠脑内MDA含量、H2O2浓度、EC-SOD mRNA水平相对表达量以及EC-SOD蛋白水平相对表达量均高于对照组,差异有统计学意义(P<0.05)。RIRI组脑组织MDA、H2O2含量与EC-SOD mRNA水平以及EC-SOD蛋白水平表达呈正相关。结论大鼠RIRI后,脑内出现过氧化损伤;EC-SOD在RIRI大鼠脑内的表达升高,可能发挥了抗氧化应激的作用。
再灌注损伤;超氧化物歧化酶;丙二醛
缺血再灌注损伤是指器官在缺血缺氧时出现的细胞损伤,会在器官的血液和氧含量恢复时加重的现象[1-2]。肾缺血再灌注损伤(renal ischaemia reperfusion injury,RIRI)是肾脏在临床治疗过程中经常发生的病理生理过程,也是影响肾功能恢复以及发生肾衰竭的重要原因之一[3-5]。肾在缺血再灌注过程中会有大量活性氧族(reactive oxygen species,ROS)产生,使肾处于高度的氧化应激状态,损伤肾功能[6-7]。已有研究发现在肾功能损伤时,会影响机体其他器官如肝、肺等的功能[8]。细胞外超氧化物歧化酶(extracellular superoxide dismutases,EC-SOD)是在组织的细胞外基质中被发现的,被认为能有效地阻止细胞外ROS所引发的细胞和组织损伤[9]。脑是对缺血缺氧高度敏感的器官,本研究旨在观察RIRI发生时脑组织是否会受到RIRI的影响?脑内EC-SOD的表达是否发生改变?现将观察结果报告如下。
1 材料与方法
1.1 大鼠RIRI模型的建立及取材 选用健康雄性Wistar大鼠12只(来自河北省实验动物中心,合格证编号:1510165),体质量190~210 g,随机分为对照组和RIRI组各6只。6%水合氯醛(5 mL/kg)腹腔注射麻醉下,将大鼠固定于手术台上,常规备皮、消毒、铺单。自剑突向下做腹部正中切口4 cm,暴露并结扎右侧肾蒂后切除右肾。RIRI大鼠分离左肾动脉,用无创动脉夹将其夹闭,观察左肾颜色,由鲜红渐变为暗红,显示夹闭成功。45 min后松开动脉夹,恢复血液供应,可见左肾动脉充盈,颜色迅速转为鲜红色,显示再灌注成功。对照组大鼠只分离左肾动脉并不夹闭。术后单笼饲养、自由进食饮水。
术后24 h再次麻醉大鼠,自颈总动脉取血约5 mL,将血液3 000 r/min离心10 min,分离血清去除红细胞,用于血尿素氮(blood urea nitrogen,BUN)、肌酐(serum creatinine,SCr)浓度测定;取肾并用4%多聚甲醛浸泡固定,组织切片苏木精-伊红(hematoxylin eosion,HE)染色光镜观察其形态学变化;取脑置于液氮中,用于丙二醛(malondialdehyde,MDA)含量和EC-SOD mRNA及蛋白水平测定。
1.2 主要试剂及PCR引物 RT试剂盒购于Promega公司,SCr和BUN测定试剂盒均购于中生北控生物科技有限公司,MDA和H2O2测定试剂盒均购于南京建成科技有限公司。兔抗EC-SOD抗体和辣根过氧化物酶标记抗兔IgG抗体均购于Abcam公司。所有引物均采用primer 5.0软件设计。GAPDH(gene bank: NM _017008):由北京三博远志生物技术公司合成。上游:5′GCT GAG TAT GTC GTG GAG T 3′;下游:5′TCT TCT GAG TGG CAG TGA T 3′;扩增产物长度为286 bp(344~629 bp)。EC-SOD(gene bank:NM_057114):由北京三博远志生物技术公司合成。上游:5′CCT GGG TAA AGG TGG CA3′;下游:5′TGG GAG CAA ACT CAA AGA C3′;扩增产物长度为573 bp(711~1 283 bp)。
1.3 血清SCr和BUN浓度测定 根据试剂盒说明书,采用苦味酸法测定血清样本SCr浓度,酶偶联速率法测定BUN浓度。将R1和R2按照1∶1的比例混合成工作液,校准品开瓶即可使用,用于测定SCr浓度;用R2溶解R1,溶解后即为工作液,校准品为厂家提供,用于测定BUN浓度。各取3只直径为1 cm的比色管,分别作为空白管、校准管和样本管。在空白管内加入1 mL工作液和0.1 mL生理盐水,在校准管内加入1 mL工作液和0.1 mL校准品,在样本管内加入1 mL工作液和0.1 mL血清样本,分别混匀待检测。测定其在波长505 nm(SCr)和340 nm(BUN)、温度37 ℃条件下的吸光光度值。混匀后30 s所测吸光光度值为A1,再过20~60 s所测吸光光度值为A2,用2次吸光光度的差值,以空白管调零,计算吸光光度的变化值,即△A样本和△A校准。根据公式C样本=△A样本×C校准/△A校准,计算每个血清样本的SCr和BUN浓度。
1.4 肾组织形态学观察 将肾脏组织置于4%多聚甲醛固定液内固定,按常规组织切片制作步骤进行操作:脱水、透明、浸蜡、包埋,切片厚约5 μm,HE染色后封片,奥林巴斯光学显微镜观察肾组织的形态变化并摄像。
1.5 脑组织匀浆的制备和MDA、H2O2含量测定 将从-70 ℃冰箱中取出的脑组织,按照20 mg/100 μL加入预冷的匀浆缓冲液(50 mmol/L磷酸钾缓冲液,pH7.4,1 mmol/L盐酸苯甲脒,1 mmol/L PMSF,0.1%Tween-20,0.5 mol/L NaCl,1 mmol/L EDTANa3,5 mmol/Lβ-巯基乙醇),冰浴中匀浆,匀浆液4 000 r/min(约3 500 g),4 ℃离心20 min,收集150 μL上清液,于上清液内加入150 μL匀浆缓冲液即制成10%脑匀浆,用于MDA及H2O2含量测定。根据试剂盒操作说明,MDA含量采用硫代巴比妥酸比色法测定,以每克样本蛋白所含MDA的量表示(mmol/g pro);H2O2含量采用钼酸比色法测定,以每克样本蛋白所含的过氧化氢的量(mmol/g pro)表示。
1.6 脑组织EC-SOD mRNA水平与蛋白水平相对表达量的测定 采用Trizol(Invitrogen公司)法,提取脑组织总RNA。用3 μgRNA 反转录生成cDNA,GAPDH作为内参照,进行逆转录聚合酶链反应。用EC-SOD与内参的扩增产物灰度值之比,表示EC-SOD mRNA相对表达量。采用免疫印迹分析法测定大鼠脑组织内EC-SOD蛋白的相对表达量。将脑组织制成匀浆后,离心取上清。采用改良Lowry法测定脑组织蛋白总量。电泳时上样量为62 μg。经电泳、转膜、封闭后,在聚偏氟乙稀(polyvinylidene fluoride,PVDF)膜上滴加一抗,室温(18~24 ℃)过夜,漂洗后加HRP标记的二抗。按照发光试剂的操作说明进行显影、定影、晾干。影像扫描后进行数据分析(以条带吸光光度值与内参之比表示相对表达量)。
1.7 统计学方法 应用SPSS 14.0统计学软件处理数据。计量资料比较采用成组设计的t检验;相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠肾组织形态学改变 光学显微镜下,对照组大鼠肾小囊、肾血管球、近曲小管、远曲小管以及集合管的形态结构均清晰规整。RIRI大鼠肾血管球萎缩,体积减小,肾小囊腔出现扩张,肾小管管腔也扩张明显,偶尔可见近曲小管上皮细胞呈现水肿、胞浆疏松化改变;肾小管间隙扩大,肾间质水肿,集合管也呈现管腔扩张、上皮水肿等改变(图1,2)。
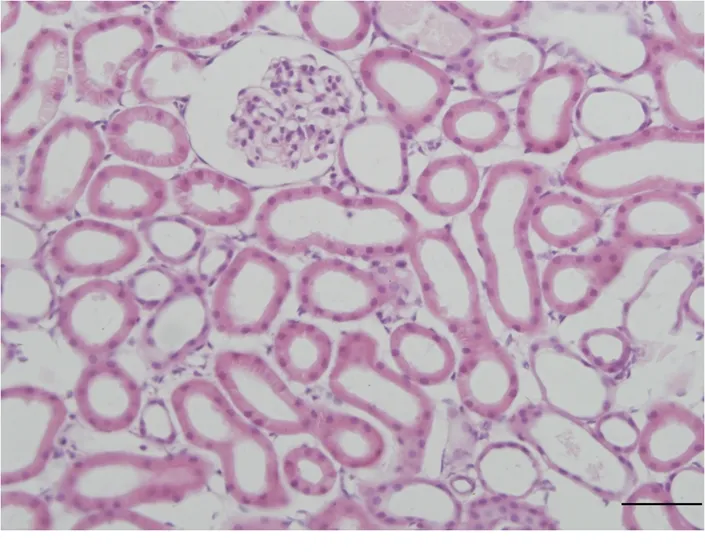
图1 正常组肾小球、肾小管形态结构(HE ×400)
Figure 1 Morphology of glomeruli and tubules in control group(HE ×400)
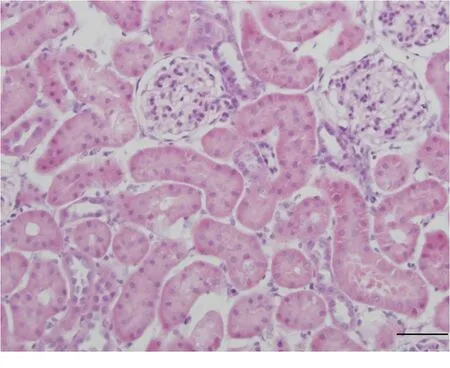
图2 RIRI肾小球、肾小管形态改变(HE ×400)
Figurea 2 Morphological changes of glomeruli and tubules in RIRI group(HE ×400)
2.2 2组SCr和BUN水平比较 RIRI组SCr和BUN水平均较对照组明显升高,差异有统计学意义(P<0.05),见表1。

表1 2组血清中SCr和BUN水平比较Table 1 Comparison of SCr and BUN level between two groups
2.3 脑组织匀浆内MDA、H2O2、EC-SOD mRNA和EC-SOD蛋白的表达 RIRI组脑组织匀浆内MDA、H2O2、EC-SOD mRNA和EC-SOD蛋白的表达均高于对照组,差异有统计学意义(P<0.05),见表2,图3,4。

表2 2组MDA、H2O2和EC-SOD mRNA、蛋白水平表达比较表2 Comparison of MDA、H2O2、EC-SOD mRNA and protein expression level between two groups

图3 脑组织EC-SOD mRNA的相对表达量
Figurea 3 The mRNA expression of EC-SOD in brain

图4 脑组织EC-SOD蛋白的相对表达量
Figure 4 The protein expression of EC-SOD in brain
2.4 相关性分析 RIRI组脑组织MDA含量与EC-SOD mRNA表达水平和EC-SOD 蛋白表达水平、脑组织H2O2含量与EC-SOD mRNA表达水平和EC-SOD 蛋白表达水平,均呈正相关(P<0.05),见表3。
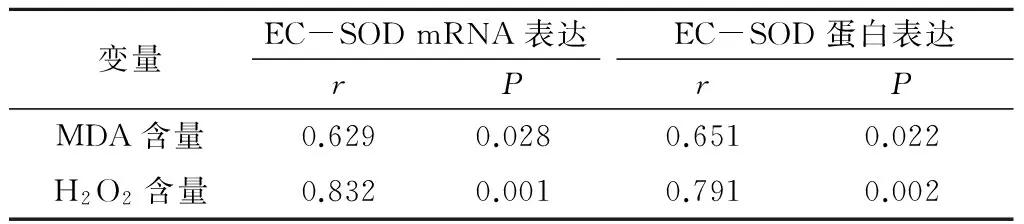
表3 RIRI组脑组织MDA、H2O2含量与EC-SODmRNA和EC-SOD蛋白的相关性Table 3 Correlation between the content of MDA,H2O2, the mRNA and protein expression of EC-SOD in brain tissue of RIRI group
3 讨 论
肾脏通过对水、离子、葡萄糖、营养物质等的重吸收,以及去除代谢产物,在维持血流动力学、电解质、水平衡和机体内环境的平衡稳定中具有重要作用。RIRI是很多临床治疗过程中不可避免的事件,如肾脏移植、肾挤压伤以及部分肾切除等。由于能导致急性肾损伤、肾移植后功能恢复延迟、急性肾衰竭的发生,而且具有较高的发病率和病死率,关于RIRI的发病机制和防治方法研究,已引起高度重视[10-12]。研究表明,到达肾脏的血液供应被突然暂时性阻断,随后再重新恢复其血液供应,再灌注阶段,被重新充血充氧的肾组织中会有大量ROS产生,使肾脏处于高度氧化应激状态,从而启动有害的细胞级联反应,导致细胞死亡和急性肾衰竭[13]。本研究目的是观察在肾脏缺血再灌注损伤发生且处于高度氧化应激状态时,脑组织是否也处于氧化应激状态并遭受过氧化损伤?抗氧化酶EC-SOD的表达如何改变?在此过程中是否发挥抗氧化作用?首先,本研究采用无损伤血管夹夹闭大鼠左肾动脉,45 min后再重新灌注,建立大鼠RIRI模型。RIRI可导致血中氮代谢产物的积累,如BUN和SCr[1]。本研究结果与此一致。此外,与对照组相比,RIRI组大鼠的肾小球和肾小管形态结构发生明显改变。表明RIRI大鼠肾脏的结构和功能均已受损,RIRI模型是成功的。
在RIRI发生时,脑组织是否也处于高度氧化应激状态并遭受过氧化损伤?ROS包括超氧阴离子(O2-)、羟自由基(OH-)和过氧化氢(H2O2)等;其中,H2O2是ROS成员中含量最丰富最稳定的形式之一[14-15]。参与炎症、细胞功能障碍和细胞凋亡的发生,最终导致组织和器官损伤。本研究结果显示,RIRI组大鼠脑组织中的H2O2高于对照组,表明在RIRI发生时,脑组织也出现大量ROS,处于氧化应激状态。MDA是脂类物质与ROS发生过氧化反应所形成的一种终末代谢产物,其含量的高低能反映脂类物质发生过氧化反应的速度和强度,因此MDA常被作为评价过氧化损伤程度的客观指标[16]。脑组织含有丰富的脂类物质,故更容易遭受ROS袭击发生过氧化损伤。本研究结果显示,与对照组相比,RIRI组大鼠脑组织的MDA含量明显升高。结合H2O2检测结果表明,在RIRI发生时,脑组织不仅处于氧化应激状态,并且已遭受过氧化损伤。
机体内氧化还原反应失衡,可引起ROS在细胞水平的升高,导致疾病的发生[17]。EC-SOD是超氧化物歧化酶的家族成员之一。在组织间质和细胞外液(血浆、淋巴、流体和滑膜液)中,EC-SOD能催化超氧自由基发生歧化反应转变为过氧化氢和氧气。它消除了来自细胞环境的超氧自由基,防止ROS和它们的衍生物的形成,在维持血管张力、肺功能、一氧化氮代谢,以及在动脉粥样硬化、糖尿病和关节炎等疾病的病理学中,也起着重要作用[18]。有研究表明,放射线照射后,EC-SOD依靠其抗氧化作用,对于维持认知功能和海马神经形成是至关重要的;EC-SOD在新生儿大脑过度表达,在对抗高氧诱导的脑损伤中提供了显著的保护作用[19]。本研究结果显示,在RIRI发生时,EC-SOD的mRNA和蛋白表达水平均明显增强,并且与脑组织MDA、H2O2含量均呈正相关。从而推测,当RIRI发生后,脑组织内产生大量ROS并与脂类物质发生过氧化反应,导致过氧化损伤。为了清除过多的ROS以维持机体氧化还原平衡,机体通过上调抗氧化酶EC-SOD的表达来清除过多的ROS,保护脑组织免遭过氧化损伤。
总之,在RIRI发生时,伴有脑组织处于氧化应激状态并发生过氧化损伤,抗氧化酶EC-SOD在清除ROS、防治RIRI诱发脑组织过氧化损伤中,可能发挥重要作用,也为防治RIRI所诱发的脑损伤提供了一条新思路。
[1] Go KL,Lee S,Zendejas I,et al. Mitochondrial Dysfunction and Autophagy in Hepatic Ischemia Reperfusion Injury[J]. Biomed Res Int,2015,2015:1834-1869.
[2] 李爱芝,马加海.吸入麻醉对大鼠急性肾缺血再灌注损伤的保护[J].医学动物防制,2009,25(4):262-263,268.
[3] 霍洪昌,王切,王素玲,等.大鼠肾缺血再灌注损伤模型心肌内过氧化酶Ⅲ的表达变化[J].河北医科大学学报,2016,37(10):1165-1169.
[4] Xu YM,Ding GH,Huang J,et al. Tanshinone ⅡA pretreatment attenuates ischemia/reperfusion-induced renal injury[J]. Exp Ther Med,2016,12(4):2741-2746.
[5] Moslemi F,Taheri P,Azimipoor M. Effect of angiotensin Ⅱ type 1 receptor blockade on kidney ischemia reperfusion: a gender related difference[J]. J Renal Inj Prev,2016,5(3):140-143.
[6] Zhao L,Xu L,Tao X,et al. Protective Effect of the Total Flavonoids from Rosa laevigata Michx Fruit on Renal Ischemia Reperfusion Injury through Suppression of Oxidative Stress and Inflammation[J]. Molecules,2016,21(7):1-13.
[7] Abogresha NM,Greish SM,Abdelaziz EZ,et al. Remote effect of kidney ischemia-reperfusion injury on pancreas: role of oxidative stress and mitochondrial apoptosis[J]. Arch Med Sci,2016,12(2):252-262.
[8] Karimi Z,Ketabchi F,Alebrahimdehkordi N. Renal ischemia reperfusion against nephrectomy for induction of acute lung injury in rats[J]. Ren Fail,2016,38(9):1503-1515.
[9] Ota F,Kizuka Y,Kitazume S,et al. N-Glycosylation is essential for the secretion of extracellular superoxide dismutase[J]. FEBS Lett,2016,590(19):3357-3367.
[10] Fu Y,Lin Q,Gong T,et al. Renal targeting triptolide glucosamine conjugate exhibits lower toxicity and superior efficacy in attenuation of ischemia reperfusion renal injury in rats[J]. Acta Pharmacol Sin,2016,37(11):1467-1480.
[11] Jiang BT,Chen QZ,Guo ZH,et al. Ischemic post-conditioning attenuates renal ischemic reperfusion injury via down-regulation of toll-like receptor 4 in diabetic rats[J]. Ren Fail,2016,38(9):1425-1431.
[12] Kaur A,Kaur T,Singh B,et al. Curcumin alleviates ischemia reperfusion induced acute kidney injury through NMDA receptor antagonism in rats[J]. Ren Fail,2016,38(9):1462-1467.
[13] Najafi H,Changizi Ashtiyani S,Sayedzadeh SA,et al. Therapeutic effects of curcumin on the functional disturbances and oxidative stress induced by renalischemia/reperfusion in rats[J]. Avicenna J Phytomed,2015,5(6):576-586.
[14] Kim KS,Lee D,Song CG,et al. Reactive oxygen species activated nanomaterials as theranostic agents[J]. Nanomedicine(Lond),2015,10(17):2709-2723.
[15] Lina M,Hongfei M,Yunxin X,et al. The mechanism of ROS regulation of antibiotic resistance and antimicrobial lethality[J]. Yi Chuan,2016,38(10):902-909.
[16] Gagua AK,Strelnikov AI,Valkov KS. The value of volatile fatty acids,citrulline and malondialdehyde for diagnosis of suppurative cholangitis in obstructive jaundice and choosing of optimal surgical approach(with commentary)[J]. Khirurgiia(Mosk),2016,(10):41-47.
[17] Lee JH,Jung HK,Han YS,et al. Antioxidant effects of Cirsium setidens extract on oxidative stress in human mesenchymal stem cells[J]. Mol Med Rep,2016,14(4):3777-3784.
[18] Iversen MB,Gottfredsen RH,Larsen UG,et al. Extracellular superoxide dismutase is present in secretory vesicles of human neutrophils and released upon stimulation[J]. Free Radic Biol Med,2016,97:478-488.
[19] Baba A,Kawakami Y,Saito K. Effects of Edaravone on Hippocampal Antioxidants in EL Mice[J]. J Nippon Med Sch,2016,83(3):100-106.
(本文编辑:许卓文)
Expression changes of EC-SOD in the brain of the renal ischemia reperfusion injury in rats
HAO Bing1, WANG Qie2, WANG Su-ling3, WANG Lei2*
(1.DepartmentofUrology,CangzhouCentralHospital,HebeiProvince,Cangzhou061001,China; 2.DepartmentofAnatomy,theSchoolofBasicMedicalSciences,HebeiMedicalUniversity,Shijiazhuang050017,China; 3.DepartmentofLaboratory,HebeiBloodCenter,Shijiazhuang050071,China)
Objective To observe the expression of extracellular superoxide dismutases(EC-SOD) in renal ischemia reperfusion injury(RIRI) rats and to investigate the role of EC-SOD in the brain oxidative stress response. Methods The male Wistar rat were divided randomly into RIRI group and control group ,6 rats in each group. After the right kidney was removed in RIRI rats, the left renal artery was clamped with a non injured artery clamp. After 45 min, the rats were removed and the blood supply was restored. After 24 hours of reperfusion, the blood, kidney and brain were taken. The left renal artery were only separated, but not cliped in the control group rats. The urea nitrogen(BUN) and serum creatinine(SCr) in the serum blood of two groups were detected by picric acid method and enzyme coupling rate method. The malondialdehyde(MDA)content in the brain tissue of two groups was determined by thiobarbituric acid colorimetric method. the renal morphological change was observed by HE staining. The EC-SOD mRNA and protein expression in brain were evaluated by reverse transcription polymerase chain reaction and western blot. Results Compared with the control group, the BUN and SCr in serum of RIRI group were significantly increased. The content of MDA, H2O2, the relative expression level of EC-SOD and the relative expression level of EC-SOD protein in RIRI group were higher than those in control group. The difference was statistically significant(P<0.05). The content of MDA and H2O2was positively correlated with the expression of EC-SOD mRNA and protein in the brain tissue of RIRI group. Conclusion After the RIRI, oxidative damage in the brain was occured. The increase of EC-SOD expression in the brain of RIRI rats may play an important role in anti oxidative stress.
reperfusion injury; superoxide dismutase; malondialdehyde
2016-11-11;
2016-12-20
河北省医学科学研究重点课题(20160088)
郝斌(1981-),男,河北沧州人,河北省沧州市中心医院主治医师,医学硕士,从事泌尿外科疾病诊治研究。
R619.9
A
1007-3205(2017)05-0552-05
10.3969/j.issn.1007-3205.2017.05.013

