猴痘病毒特异性单克隆抗体制备及鉴定
管茜茜 赵莉 任皎 黄盼盼 王慧娟 陈迎珠 朱娜 谭文杰 阮力 田厚文
102206 北京,中国疾病预防控制中心病毒病预防控制所
·技术方法·
猴痘病毒特异性单克隆抗体制备及鉴定
管茜茜 赵莉 任皎 黄盼盼 王慧娟 陈迎珠 朱娜 谭文杰 阮力 田厚文
102206 北京,中国疾病预防控制中心病毒病预防控制所
目的 制备猴痘病毒特异性单克隆抗体,建立猴痘病毒免疫荧光检测方法。方法 原核表达猴痘病毒A29蛋白及与之同源的痘苗病毒A27蛋白和牛痘病毒162蛋白,建立抗体筛选系统;使用人工合成的猴痘病毒A2917~49多肽免疫BALB/c小鼠,取小鼠脾细胞通过融合、克隆和筛选等制备猴痘病毒单克隆抗体。通过ELISA法确定单克隆抗体的特异性及亚型。结果 在大肠埃希菌中成功表达A29、A27及162蛋白,经Western blot鉴定分子量与预期相符,带his标签的三种蛋白经His-Bind亲和层析柱纯化后纯度均大于90%;用纯化蛋白筛选获得8株A29蛋白特异的单克隆抗体,其中两株为IgG3型,其余为IgG1型。结论 本研究获得8株猴痘病毒特异性单克隆抗体,为进一步建立猴痘病毒免疫荧光检测奠定基础。
Fund programs: National Science and Technology Major Project of China(2013ZX10004001,2013ZX0004101);National Key Research and Development Program(2016YFC1200900)
目前已知可致人发病的正痘病毒主要有天花病毒、痘苗病毒、牛痘病毒及猴痘病毒。猴痘病毒是动物源性病毒,在人类中可引起类似天花的病症,临床表现为发热出疹后结痂。该病于1970年初次在人类中发现,主要见于中西非热带雨林地区[1],但疫区在扩大,特别是2003年美国暴发猴痘[2],引起人们对这种病毒的警觉。此病毒可被利用于制造生化武器,威胁人类安全。因此,建立正确诊断猴痘病毒的方法,才能制定相关措施政策,控制其可能造成的危害。PCR是目前国内外主要检测方法[3],但需要依赖设备和敏感的样本。我国尚未建立除PCR检测法的其他诊断方法。而建立猴痘病毒特异的免疫学检测法可以为我国应对可能出现的猴痘疫情以及生物反恐提供应急技术储备。
猴痘病毒基因组由大小约为196 kb的双股正链DNA组成,与其他正痘病毒基因组同源性高。我国目前虽无猴痘输入性病例,可借鉴国外猴痘病毒研究成果。Roumillat等[4]利用猴痘病毒制备的一株猴痘病毒特异单克隆抗体mAb 69-126-3-7,只与猴痘病毒反应,与痘苗、天花、牛痘、骆驼痘病毒均不反应。Hughes等[5]发现其表位在猴痘病毒A29蛋白的A2917~49多肽上。本研究筛选出8株只与猴痘病毒A29蛋白反应的抗体,即猴痘病毒特异性单克隆抗体。这是国内首次制备出猴痘病毒特异性单克隆抗体的研究,为后期建立猴痘病毒免疫荧光检测方法奠定了基础。
1 材料与方法
1.1 材料 大肠埃希菌BL21(DE3)感受肽细胞(北京全式金公司);DMEM培养基(Hyclone);HAT培养基(美国Gibco);HT培养基(Gibco);聚乙二醇1450(美国Sigma);青-链霉素(美国Gibco);抗体亚型鉴定试剂盒(Pierce Rapid ELISA Mouse mAb Isotyping Kit);BALB/c小鼠(军事医学科学院实验动物中心);His镍柱(美国GE公司);Gel Doc XR+凝胶成像系统和Image Lab分析软件(美国Bio-rad公司)。
1.2 多肽合成与蛋白偶联 A2917~49多肽 (TEFFSTKAAKNPETKREAIVKAYGDDNEETLKQ ),由北京中科亚光生物科技有限公司合成20 mg,其中10 mg与匙孔血蓝蛋白(KLH)偶联。
1.3 基因合成与质粒构建 从美国国家生物技术信息中心(NCBI)建立的DNA序列数据库下载猴痘病毒A29基因序列(330 bp)、痘苗病毒A27基因序列(330 bp)、牛痘病毒162基因序列(330 bp),基因尾部加入6个his编码基因[6]。表达载体选择pET9a质粒(4 341 bp)。酶切位点选择质粒上NdeI与BamHI酶切位点。由南京金斯瑞生物科技有限公司进行密码子优化合成后插入pET9a载体中,三种重组质粒命名为pET9a-mpxvA29、pET9a-vacvA27、pET9a-cpxv162。对质粒进行酶切鉴定并送北京睿博兴科生物技术有限公司测序。
1.4 蛋白表达与鉴定 将质粒pET9a-mpxvA29、pET9a-vacvA27、pET9a-cpxv162分别转化BL21(DE3)感受肽细胞,挑选阳性克隆接种于3 ml含50 μg/ml 卡那霉素的LB培养基中,37℃,180 rpm,振荡培养过夜;第二天再按1∶100接种于含50 μg/ml 卡那霉素LB培养基中,37℃,240 rpm,振荡培养3 h至OD值达0.8左右加入IPTG至终浓度为1 mmol/L,37℃诱导培养2 h,收获菌液。分别取200 μl上述菌液,4000 rpm,离心2 min,再分别以80 μl双蒸水充分重悬后与20 μl的5X loading buffer混匀,煮沸5 min, 取样10 μl。以5%浓缩胶和15%分离胶进行常规SDS-PAGE鉴定。同时对表达的蛋白作Western blot鉴定。
1.5 蛋白纯化与鉴定 各取上述300 ml菌液,4 000 rpm,离心30 min,弃上清,以30 ml PBS重悬,在冰浴中超声破碎菌体,功率为200 w,超声4 s,间隔4 s,工作140次,至外观澄清透亮。离心后上清经His-Bind柱亲和层析纯化。
1.6 动物免疫 选择8周龄雌性BALB/c小鼠,分别于第1、21及35天对小鼠进行皮下注射免疫:首次免疫使用A2917~49多肽-KLH与完全弗氏佐剂1∶1乳化后,皮下注射,剂量为100 μg/只;第二次免疫使用A2917~49多肽-KLH与不完全弗氏佐剂1∶1乳化,皮下注射,剂量同上;第三次免疫使用A2917~49多肽-KLH皮下注射,剂量同上;融合前3 d腹腔注射加强免疫,剂量为50 μg/只。
1.7 细胞融合与克隆 取1 ml聚乙二醇1450逐滴加入到5∶1混合的免疫小鼠脾细胞和SP2/0骨髓瘤细胞中,60 s内加完;37℃水浴静置5 min,然后在1 min内逐滴加完1 ml无血清的DMEM培养液,同时不断搅动细胞,重复一次;然后3 min内逐滴加入7 ml无血清的DMEM培养液。离心后去上清。用含HAT和20%胎牛血清的DMEM培养液稀释成1×106个脾细胞/ml,接种到5块96孔细胞培养板。10 d后使用间接法ELISA筛选IgG抗体阳性的融合孔,选择阳性孔进行克隆:将融合孔中的细胞充分混匀,取100 μl使用96孔细胞培养板2倍稀释7个稀释度。显微镜下计数为50左右的细胞孔将其回收,使用培养液稀释成10 ml,充分混匀后加到96孔细胞培养板中,100 μl/孔。
1.8 阳性单克隆细胞株抗体亚型鉴定 对克隆后检测为阳性的单克隆细胞株收集上清使用Pierce Rapid ELISA Mouse mAb Isotyping Kit进行抗体亚型鉴定。
2 结果
2.1 A29、A27和162蛋白原核表达质粒酶切鉴定 用限制性内切酶NdeI和BamHI对三质粒进行双酶切后,重组质粒分别在约4.3 kb与330 bp出现明显的条带,大小与预期一致。进一步测序结果无误。
2.2 蛋白表达与鉴定 将三质粒pET9a-mpxvA29、pET9a-vacvA27、pET9a-cpxv162分别转化BL21感受态培养,经IPTG诱导表达后经SDS-PAGE分析,结果显示IPTG诱导2 h后,在相对分子质量约14×103处可见明显条带(图1A),与预期大小一致。蛋白经Western blot检测,显示在相对分子量约14×103处出现特异性条带(图1B),说明该条带是特异的目的蛋白表达带。
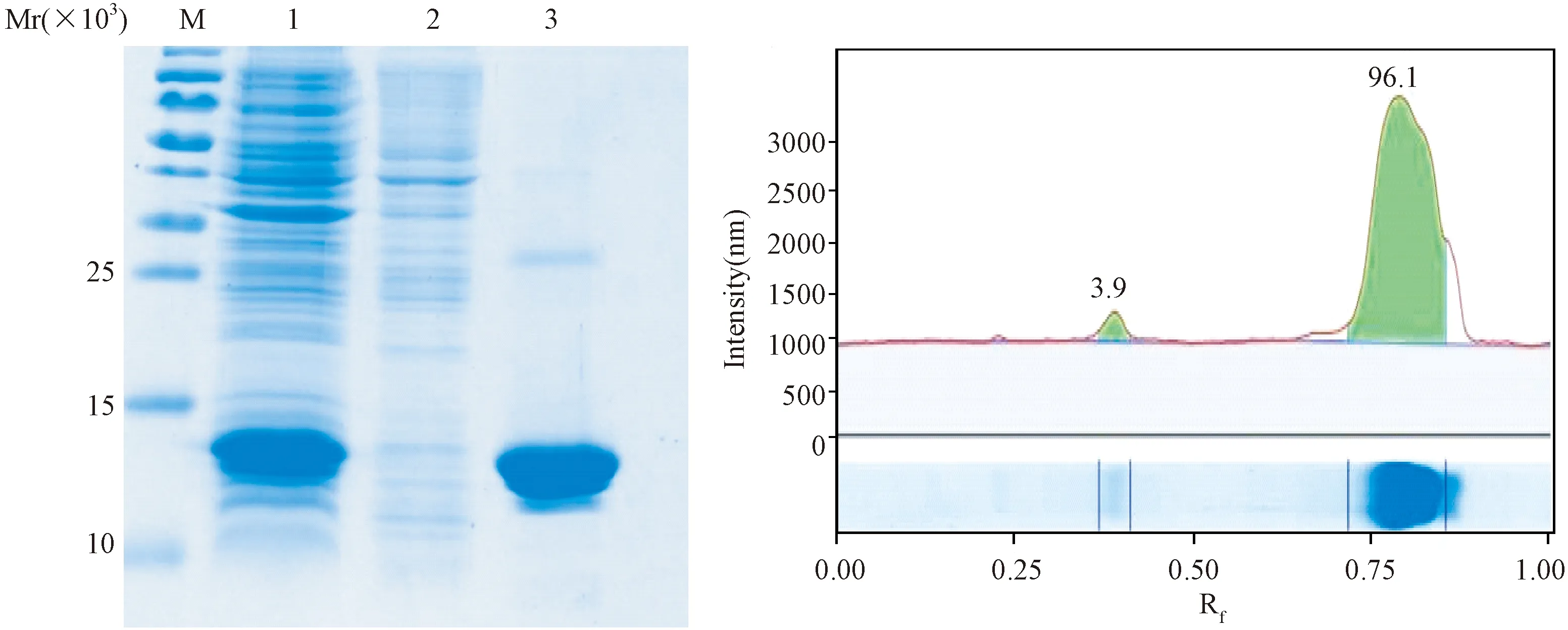
M:marker;1:162蛋白纯化前原液;2: 162蛋白20 mmol/L咪唑洗脱液;3:162蛋白300 mmol/L咪唑洗脱液图2 162蛋白纯化SDS-PAGE分析及Image Lab软件纯度分析M: marker; 1: supernatant before 162 protein purification; 2: 20 mmol/L imidazole eluent of 162 protein; 3: 300 mmol/L imidazole eluent of 162 protein. Fig.2 SDS-PAGE analysis and Image Lab results of protein 162 purification
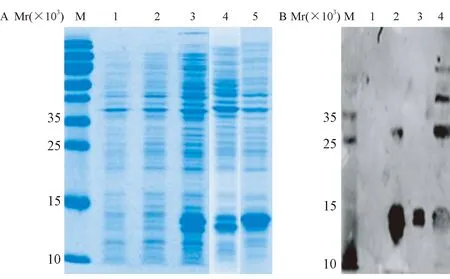
A, M:marker;1:空载体;2:诱导前pET9a-mpxvA29全菌;3-5:诱导后pET9a-mpxvA29、 pET9a-vacvA27、pET9a-cpxv162全菌;B, M: marker;1:空载体;2-4:诱导后pET9a-mpxvA29、pET9a-vacvA27、pET9a-cpxv162全菌图1 A29、A27和162蛋白表达SDS-PAGE分析及Western blot鉴定A, M: marker; 1:E.coli lysate of empty plasmid vector; 2:E.coli lysate of pET9a- mpxvA29; 3-5: E.coli lysate of pET9a-mpxvA29,pET9a-vacvA27, pET9a-cpxv162 after induced for 2 h;B, M: marker;1:E.coli lysate of empty plasmid vector; 2-4: E.coli lysate of pET9a-mpxvA29,pET9a-vacvA27, pET9a-cpxv162 after induced for 2 hFig.1 SDS-PAGE analysis and Western blot results of protein A29,A27 and 162 expression
2.3 蛋白纯化与鉴定 三组表达产物超声破碎后,经His-Bind柱亲和层析纯化,然后进行SDS-PAGE电泳鉴定分析,得到A29蛋白纯度为90.6%、A27蛋白纯度为93.8%及162蛋白纯度为96.1% (图2中只包括162蛋白纯化结果,其余结果未显示)。2.4 细胞克隆及阳性单克隆抗体细胞株的筛检 使用PEG1450融合免疫小鼠的脾细胞和SP2/0骨髓瘤细胞,第4天观察融合细胞,融合率为94%。经过间接法ELISA筛选后,获得31个阳性的融合细胞孔。为得到A29蛋白抗体特异阳性的单克隆细胞株,挑选7个阳性融合细胞孔进行一次性克隆,获得88个单克隆细胞株,再经过ELISA筛检后,有8个单克隆细胞株上清与A29蛋白反应,在450 nm波长处吸光度值均为2.0以上,与阴性对照吸光度值0.08比较,判定为阳性反应,而与A27蛋白及162蛋白反应孔的吸光度值均在0.10以下,判定为阴性反应,即得到8株A29蛋白特异的单克隆细胞株。
2.5 阳性单克隆细胞株抗体亚型鉴定 对此8株单克隆细胞株收集上清进行抗体亚型鉴定,在450 nm波长处测定每孔吸光度,结果显示两株为IgG3型,其余为IgG1型(表1)。
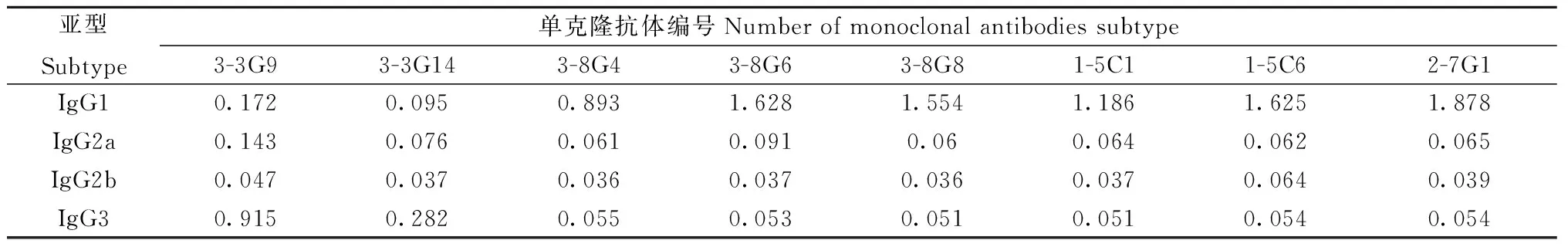
表1 单克隆抗体亚型鉴定
3 讨论
2016年8—10月,中非共和国报道了26例猴痘患者,其中2例患者死亡[7],2017年3月,刚果(布)地区暴发20例猴痘病例,死亡3例。说明猴痘病毒在疫区依然活跃。目前我国虽无猴痘输入性病例,但在中西非的劳务及援外人员数以千计,且经常往返,随时有病例输入的可能性。鉴于目前国内尚无猴痘特异的免疫学检测技术,可借鉴国外研究在我国建立相关技术。
Roumillat等[4]证明筛选到的猴痘病毒特异性单克隆抗体mAb 69-126-3-7的表位在A2917~49多肽序列上,且为线性表位。由此我们推测此段多肽也可能是猴痘特异性抗原。然而我们通过ELISA实验将之与痘苗病毒小鼠血清反应,结果显示该多肽能与痘苗抗体结合,说明为非猴痘特异性的抗原肽。
猴痘病毒A29蛋白和痘苗病毒A27蛋白、牛痘病毒162蛋白,同源性均为95%。尽管如此,由于A2917~49多肽全长33个氨基酸,其中含有猴痘病毒特异性抗体表位,因此我们可以采用人工合成的A2917~49多肽免疫小鼠,通过脾细胞融合,采用A29蛋白及与之同源的其他正痘病毒蛋白进行筛选,就有可能获得猴痘病毒特异性单抗。为增强肽段的免疫原性,我们将多肽偶联KLH蛋白后,经两针免疫小鼠后,针对A2917~49多肽抗体滴度可达1∶50 000。由于天花病毒基因操作受WHO天花消灭的相关生物安全规定,不能进行天花病毒基因合成,因此本研究中无法使用天花蛋白进行筛选。此外通过原核表达的猴痘A29蛋白及与之同源的其他正痘病毒蛋白进行猴痘特异的单克隆抗体筛选,获得的单克隆抗体理论上应当与猴痘病毒,痘苗病毒,天花病毒、牛痘病毒等进行反应做进一步验证,由于条件限制,国内实验室尚无猴痘、天花、牛痘病毒,因此我们仅用痘苗病毒通过ELISA实验与筛选获得的猴痘特异单抗进行了反应,结果表明猴痘特异的单抗与痘苗病毒无结合,初步证明了实验筛选获得的单抗的特异性。
本研究用猴痘A29蛋白上的A2917~49多肽免疫小鼠,获得了猴痘病毒特异性单抗,为建立猴痘病毒特异的免疫荧光检测方法奠定了基础,对我国应对可能出现的猴痘疫情以及生物反恐都具有现实意义。
[1] Rimoin AW, Mulembakani PM, Johnston SC, et al. Major increase in human monkeypox incidence 30 years after smallpox vaccination campaigns cease in the Democratic Republic of Congo[J]. Proc Natl Acad Sci USA, 2010, 107(37):16262-16267.doi: 10.1073/pnas.1005769107.
[2] Reed KD, Melski JW, Graham MB, et al. The Detection of Monkeypox in Humans in the Western Hemisphere[J]. N Engl J Med, 2004, 350(4):342-350.doi: 10.1056/NEJMoa032299.
[3] 周为民, 谭文杰, 郑楠,等. 猴痘、天花病毒感染快速分子诊断荧光定量实时PCR方法的建立[J]. 生物技术通讯, 2006, 17(5):703-706.doi: 10.3969/j.issn.1009-0002.2006.05.006.
[4] Roumillat LF, Patton JL, Davis ML. Monoclonal antibodies to a monkeypox virus polypeptide determinant[J]. J Virol, 1984, 52(1):290-292. PMID: 6207310.
[5] Hughes LJ, Goldstein J, Pohl J, et al. A highly specific monoclonal antibody against monkeypox virus detects the heparin binding domain of A27[J]. Virology, 2014, s 464-465:264-273.doi: 10.1016/j.virol.2014.06.039.
[6] 孙丽娜, 周荣苹, 刘洋,等. 4株埃博拉病毒核蛋白特异性单克隆抗体抗原结合表位研究[J]. 中华实验和临床病毒学杂志, 2016, 30(2):138-140. doi:10.3760/cma.j.issn.1003-9279.2016.02.007.
[7] Monkeypox fact sheets (November 2016). World Health Organization. http://www.who.int/mediacentre/factsheets/fs161/en/.
(本文编辑:唐浏英)
Generation and characterization of specific monoclonal antibodies against monkeypox virus
GuanQianqian,ZhaoLi,RenJiao,HuangPanpan,WangHuijuan,ChenYingzhu,ZhuNa,TanWenjie,RuanLi,TianHouwen
NationalInstituteforViralDiseaseControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China
TianHouwen,Email:houwent@126.com.
Objective To generate monkeypox virus specific monoclonal antibodies for further establishing monkeypox virus immunofluorescence assay. Methods Monkeypox virus A29 protein, vaccinia ortholog A27 protein and cowpox ortholog 162 protein were expressed inE.coliBL21 to screen antibodies. Synthetic monkeypox virus A2917 ~ 49polypeptide was used to immune BALB/c mice. Monkeypox virus monoclonal antibodies were generated through fusion, cloning and screening techniques. Indirect ELISA was performed to test antibodies specificity and subtype. Results A29, A27 and 162 proteins were highly expressed inE.coliand detected by Western blot. The three his-tagged proteins were purified using His-Bind affinity chromatography column. The purity of the proteins was all more than 90%. And 8 strains monkeypox virus specific monoclonal antibodies were screened by the three purified proteins. Two mAbs of 8 were IgG3 subtype and the rest were IgG1 subtype. Conclusions Eight strains of monkeypox virus specific monoclonal antibodies were generated, they can be used to further establish monkeypox virus immune immunofluorescence assay.
Monkeypox virus;A29 protein;Polypeptide;Monoclonal antibody
田厚文,Email:houwent@126.com
10.3760/cma.j.issn.1003-9279.2017.02.015
国家科技重大专项(2013ZX10004001,2013ZX0004101);国家科技重点研发项目(2016YFC1200900)
猴痘病毒;A29蛋白;多肽;单克隆抗体
2016-12-29)

