检测基孔肯雅病毒抗原方法的建立与初步评价
邢骁跃 芜为 张硕 张全福 李川 梁米芳 李建东 李德新
102206 北京,中国疾病预防控制中心病毒病预防控制所
·技术方法·
检测基孔肯雅病毒抗原方法的建立与初步评价
邢骁跃 芜为 张硕 张全福 李川 梁米芳 李建东 李德新
102206 北京,中国疾病预防控制中心病毒病预防控制所
目的 建立基孔肯雅病毒抗原检测方法。方法 利用重组杆状病毒表达的基孔肯雅病毒全部结构蛋白组成的病毒样颗粒免疫小鼠和兔,制备了基孔肯雅病毒特异性多克隆抗体,建立了检测基孔肯雅病毒抗原双抗体夹心ELISA方法。优化了抗体使用浓度和ELISA反应条件,以灭活基孔肯雅病毒为阳性参考品评价了该方法的检测限和重复性。结果 利用10份模拟阳性血清、90份阴性血清、40份其他病毒感染者急性期血清初步评价该方法的特异性、灵敏性。结果显示特异性为100%,检出限约为10TCID50,板间变异系数小于10%,板内变异系数小于5%。结论 双抗体夹心ELISA方法可以用于检测急性期血清样本中基孔肯雅病毒抗原,为基孔肯雅热的病原学诊断提供了新的手段。
Fund programs: National Key Research and Development Program of China (2016YFD0500303)
基孔肯雅病毒(Chikungunya virus,CHIKV)是一种主要经伊蚊传播的单股正链RNA病毒,属于披膜病毒科甲病毒属。人感染后,引起以发热、关节疼痛等为主要特征的自限性传染性疾病。该病的病死率低,但部分患者可产生经久不愈的关节痛等后遗症,影响正常的工作生活。传染源主要为病人、隐性感染者,主要传播媒介为伊蚊,病毒主要以人-蚊-人的方式循环。携带病毒的患者输入到有媒介生物分布的地区,可导致该病的暴发[1, 2]。1952年在坦桑尼亚发生暴发流行中首次分离到CHIKV,1958年在亚洲地区分离到CHIKV。随后,在非洲、亚洲引发了多次暴发流行,流行特征以不定期出现的暴发为主。多个国家因输入病例而引发CHIKV本土传播,造成暴发疫情[3, 4]。在我国,2008年首次发现输入性CHIK病例[5], 2010年在广东东莞发生了输入病例引发的本地暴发疫情,报告200多病例,在云南、海南等地曾发现疑似CHIKV感染病例[6, 7]。
病例的早诊断、早发现,对于暴发疫情的有效防控极为重要。基孔肯雅热临床表现无特异性,确诊依赖于实验室检测。检出病毒核酸、抗原,分离到病毒或恢复期血样本特异性抗体较急性期有4倍及以上升高可确诊。目前,我国基孔肯雅热的诊断主要采用核酸、抗体检测和病毒分离方法,缺少检测CHIKV抗原的方法与试剂。本研究初步建立和评价了基于CHIKV病毒样颗粒免疫制备的多克隆抗体的双抗体夹心ELISA检测抗原的方法。
1 材料与方法
1.1 CHIKV、重组杆状病毒、细胞以及实验动物 灭活CHIKV、包含编码CHIKV结构蛋白C-E3-E2-6K-E1基因的重组杆状病毒[8]、Vero细胞、Sf9细胞由病毒病所出血热科室保存;昆明鼠购自北京维通利华公司,新西兰兔购自京天成生物技术有限公司。
1.2 病毒样颗粒抗原表达纯化 按本科室之前制备CHIKV样颗粒相同方法[8]。在锥形瓶中用无血清的SF900-Ⅱ培养Sf9细胞,至细胞浓度至2×107/ml以上时,加入一半新的培养基加入重组杆状病毒,MOI为1左右。感染4 d后每半天观察一次,至病变细胞到达40%~50%时收获上清。8 000 rpm(R10A3 日立)离心30 min收取上清,将1 L离心后上清用Viva flow 200超滤器(赛多利斯)浓缩至100 ml左右,然后用40%蔗糖垫层35 000g超速离心4 h,收取垫层上的液体,用20%的蔗糖垫层30 000g超速离心3.5 h,沉淀病毒样颗粒,用1 ml PBS重悬沉淀。进行SDS-PAGE电泳分析,并用科室保存的CHIKV抗体和相应的二抗进行Western blot分析。
1.3 多克隆抗体制备
1.3.1 鼠免疫腹水制备:上述浓缩纯化的抗原加入完全弗氏佐剂用皮下多点注射接种6周龄昆明鼠,抗原使用量100 μg/只。两周后进行第二次注射,换用不完全弗氏佐剂,其他不变。两周后采尾血测抗体滴度,抗体滴度低于1∶10万(间接ELISA法)进行下一次免疫。当抗体滴度达到1∶10万以上时,结束免疫。用活化后的S180细胞腹腔注射,1~2周后收取腹水,8 000g离心10 min,收取上清。
1.3.2 兔血清制备:选取2.0±0.5 kg雄性新西兰兔两只,免疫前耳缘静脉取血1 ml备用。兔背部刮毛,用上述抗原加入完全弗氏佐剂混合进行皮下多点注射。一周后进行第二次注射,换用不完全弗氏佐剂,其他不变。第二次注射开始,每次注射前耳缘静脉取血进行滴度检测。抗体滴度低于1∶10万(间接ELISA法)一周后进行下一次免疫。滴度达到1∶10万以上,颈动脉放血,收取全血,置37℃30 min,然后4℃过夜,3 000 rpm(Multifuge 1L-R,Heraeus)离心5 min收取兔血清。
1.3.3 抗体纯化:鼠腹水和兔血清分别使用Hitrap protein G HP 抗体纯化柱和Hitrap protein A HP 抗体纯化柱,参考说明书操作。
1.4 抗体检测
1.4.1 间接免疫荧光:取CHIKV感染Vero细胞制备的抗原片(由本科室保存),鼠免疫腹水或兔免疫血清用PBS进行10倍系列稀释后加到抗原片的细胞孔,放入湿盒,37℃孵育30 min,PBS洗6次。以羊抗鼠和羊抗兔IgG-FITC(1∶100 伊文思蓝稀释)为二抗,放入湿盒,37℃孵育30 min,PBS洗6次。荧光显微镜下观察。
1.4.2 间接法ELISA:用灭活的CHIKV(由本科室保存),在PH为9.6的碳酸盐缓冲液中,4℃过夜包被酶标板,500 ng/孔。5%脱脂奶300 μl/孔,37℃孵育1 h封闭。将鼠腹水或兔血清从1∶1 000起做2倍系列稀释后加入,100 μl/孔 37℃孵育1 h,PBST洗6次。将羊抗鼠或羊抗兔IgG-HRP(1∶1 000)加入对应的孔中,100 μl/孔37℃孵育1 h,PBST洗6次。加入底物夜A/B各50 μl/孔,室温放置15 min,加入终止液用酶标仪读板。
1.5 CHIKV参考品 取已知病毒滴度的CHIKV感染Vero细胞上清,灭活后进行10倍系列稀释,将每个浓度的灭活病毒上清分装保存于-80℃冰箱。每个稀释度的灭活病毒取140 μl,用Qiagen公司的QIAamp Viral RNA Mini Kit,按照说明书步骤提取RNA。使用ABI公司的AgPath-IDTMOne-Step RT-PCR 试剂和本科室已发表的CHIKV实时定量RT-PCR定量分析检测方法进行定量分析[9],设置3个复孔,同时设置阴性空白对照。使每个稀释度的病毒有和滴度对应的Ct值。
1.6 双抗体夹心ELISA方法 通过棋盘滴定,比较分析分别用兔或鼠多克隆抗体作为捕获抗体或检测抗体的ELISA检测体系。使用浓度为100~800 ng/每孔。然后利用抗原参考品对ELISA反应孵育时间(30 min和60 min)、显色时间进行优化比较,确定最佳反应条件。Cut-off值为阴性对照孔OD均值的2.1倍(阴性对照孔OD值低于0.05者按0.05计算)。
1.7 检测限与特异性分析 利用步骤5中所建立的灭活病毒参考品,评价双抗体夹心ELISA检测抗原的检测限。确定检测限后,对检测限稀释度进行real-time PCR检测,重复三次每次三个复孔,得到对应Ct值,并与原液稀释相应倍数后得到的滴度对比确认。选择本科室保存的北京地区健康人血清90份、确诊登革热患者急性期血清20份和确诊肾综合征出血热患者血清20份,用双抗体夹心法ELISA检测CHIKV抗原,计算特异度。在90 μl正常人血清中加入10 μl灭活病毒原液制成模拟患者血清,初步检测敏感性。
1.8 重复性评价 取抗原阳性参考品,制备高浓度(原液)、低浓度(原液进行10倍稀释)样品,进行3次重复检测,每次实验板内设置3个复孔,计算板内和板间样本检测吸光度的变异系数CV,CV=标准差/均值×100。
2 结果
2.1 病毒抗原制备与鉴定 将浓缩纯化的病毒样颗粒,进行SDS-PAGE电泳进行分析,在55KD、40KD、15KD和10KD左右可以见到蛋白条带,并且在Western blot中可以见到相应条带,其相对分子质量与基孔肯雅结构蛋白相当,基孔肯雅C蛋白约为16×103,E1蛋白约为54×103,E2约为43×103,E3约10×103,6K约6×103。
2.2 多克隆抗体制备 用灭活病毒为包被抗原的间接法ELISA检测抗体滴度。单只鼠(共五只分别测量)腹水和单只兔(共两只分别测量)血清效价分别为1∶128 000、1∶512 000。对鼠腹水、兔血清分别进行IFA检测,抗体与抗原反应良好,无明显非特异反应(图1),滴度为1∶10 000。

A/C:通过间接免疫荧光检测兔血清/鼠腹水当中的抗CHIKV的IgG抗体;B/D:通过间接免疫荧光检测阴性兔血清/鼠腹水当中的抗CHIKV的IgG抗体图1 间接免疫荧光分析制备的CHIKV多克隆抗体A/C:Detection of anti-CHIVK IgG in rabbit antiserum/mice immuno ascitic fluid by IFA(×40);B/D: Detection of anti-CHIVK IgG in normol rabbit serum/mice ascitic fluid (×40)Fig.1 Detection of IgG antibody against CHIKV by IFA
2.3 参考病毒 计算每个稀释度三个复孔的Ct值的均数,经过十倍稀释后TCID50/ml为105、104、103、102、101、100分别对应的Ct值为11.5、16.8、20.2、24.3、28.0、32.3。
2.4 双抗体夹心ELISA 通过比较兔和鼠抗体用于包被时的非特异反应,确定用鼠免疫腹水作为包被抗体,用PH 9.6的碳酸盐缓冲液适当稀释,4℃过夜包被酶标板。用棋盘滴定选择合适浓度。通过对P/N以及非特异反应的综合评价,选取500 ng/孔鼠抗体进行包被。0.5% BSA 300 μl/孔,37℃孵育2 h进行封闭;将阳性参考病毒进行2倍系列稀释后使用。在进行孵育时间对比后发现,孵育1 h的检出限要优于孵育30 min。在实验中采用37℃孵育1 h,然后PBST洗6次;通过棋盘滴定确定兔血清与二抗的使用浓度,在兔血清1∶1 000二抗浓度1∶8 000时其P/N值最高,同时非特异也较小;加入上述兔血清,37℃孵育1 h,PBST清洗6次;加入羊抗兔IgG-HRP,37℃孵育1 h,PBST清洗6次;加入底物液A/B各50/孔,室温放置5 min,后终止。见图2。

A 棋盘滴定包被的纯化鼠抗体以及二抗浓度; B 棋盘滴定兔血清使用浓度以及二抗浓度; C 孵育时间的对比图2 包被的纯化鼠抗体、二抗、兔血清工作浓度以及孵育时间的优化A.Determination of the optimal concentration of mice antibody and second antibody using a chessboard titration measure;B.Determination of the optimal concentration of rabbit serum and second antibody using a chessboard titration measure;C.Comparison of the incubation timeFig.2 Optimization of the concentration of mice antibody, second antibody, rabbit serum and the incubation time
2.5 特异性、检出限和重复性评价 用双抗体夹心ELISA对确诊的登革热、肾综合征出血热患者血清各20份及健康人血清90份进行CHIKV抗原检测,均为阴性,特异性为100%。10份模拟患者血清均为阳性。方法的检出限在参考病毒稀释至1∶128~1∶256之间,阳性参考病毒的滴度为105TCID50/ml,经过约200倍稀释,滴度在5×102TCID50/ml以下,即在0.1 ml样本中CHIKV滴度在50 TCID50以上时可以被本方法检测出。对检出限病毒进行核酸检测,其Ct值约为20(19.6±0.49),CV=2.5,对应的滴度为103TCID50/ml[10]。通过高浓度组、低浓度组重复检测,同一样本在板内和板间的重复检测中,OD值呈现较高的重复性(图3)。板间变异系数为5.67±0.7(95%可信区间:3.5~7.8),板内变异系数为3.5±0.6(95%可信区间:2.2~4.8)。
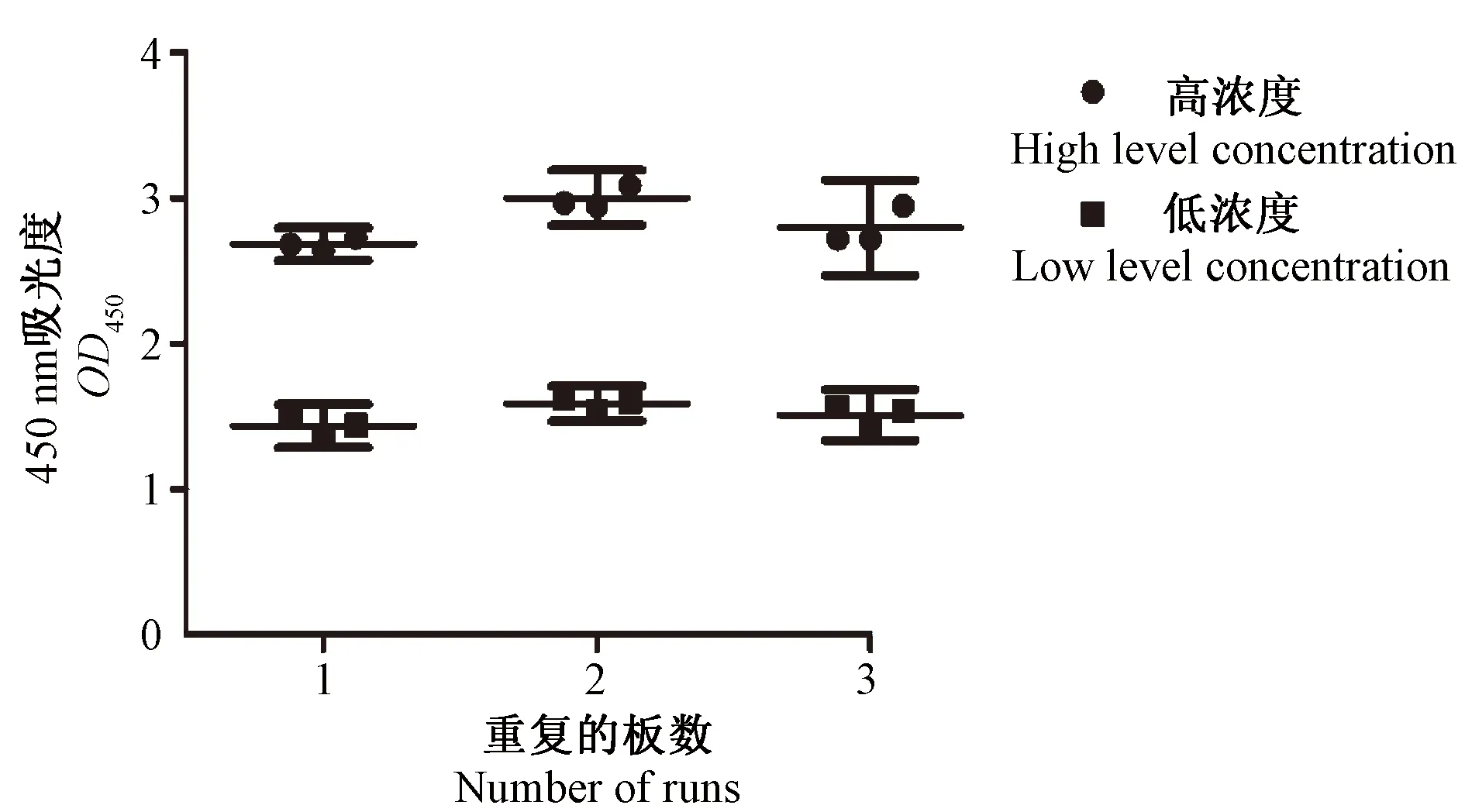
图3 双抗体夹心法ELISA重复性试验Fig.3 Repeatability of the double antibody sandwich ELISA
3 讨论
CHIKV主要通过伊蚊传播,人感染后可引起以关节痛和发热为主要症状的基孔肯雅热,病程持续数周到数月不等。2016年同样以伊蚊为媒介的寨卡病毒开始大范围传播,WHO将其升级为全球紧急公共卫生事件[11],年初我国发生寨卡输入性病例[12]。我国东南沿海地区是伊蚊主要自然栖息地[13-15],常有登革热的暴发;而登革病毒与CHIKV的传播媒介相同,我国存在发生基孔肯雅热暴发流行的可能性[16-18]。由于基孔肯雅热和登革热、寨卡病毒病的临床表现相似,临床不易鉴别,需通过实验室特异性检测加以确诊。在既往登革热暴发地区是否已存在基孔肯雅热的共同流行,是应当高度重视的问题。有必要建立便捷、敏感和特异的基孔肯雅热诊断方法,提高蚊媒传染病的防控能力。
本研究采用无感染性的病毒样颗粒免疫动物,使动物免疫的生物安全得到保证。使用的重组杆状病毒包含CHIKV的结构蛋白C-E3-E2-6K-E1,感染Sf9细胞,表达并且包装成病毒样颗粒,其抗原性与CHIKV相同。由于CHIKV结构蛋白较多,不易对抗原进行定量,本研究使用病毒滴度作为参考。由于目前基孔肯雅热的诊断多采用real-time PCR,为能够和一些有关报道比较,同时用real-time PCR测定了参考病毒的核酸。本研究建立的检测抗原的双抗体夹心法ELISA,具有较好的特异性和检出限,在0.1 ml标本中CHIKV滴度在50TCID50以上均可以被本方法检测出。Santhosh等[19]在印度南部地区基孔肯雅热流行时,用real-time PCR检测了51份疑似患者的急性期血清,发现大多数患者病毒核酸的Ct值在13—20之间,少数患者会低于13。本研究制作的模拟患者血清,将参考品10倍稀释加入正常人血中,其Ct均值为16.8,和大多数患者的病毒载量接近。Ummul等[20]在马来西亚2008年基孔肯雅热暴发时,在疫区捕获蚊子,每10只分为一组进行CHIKV的检测,发现均为阳性,病毒量在3×105-6×106拷贝/μl。根据本科室之前做的标准曲线[21],其对应的Ct值在18—20之间。Hugo等[22]建立了人工感染CHIKV的蚊模型,发现人工感染的蚊体内病毒量约为105TCID50/ml。可见CHIKV在急性期患者体内以及主要媒介蚊体内的病毒载量均在本方法的检测限之上。虫媒病毒病防控的重点之一是媒介携带病毒的检测与监测,本方法简单、成本低适用于媒介生物的监测。控制疾病的暴发,病例的早期诊断非常重要,ELISA方法检测耗时短,适合在基层卫生机构使用。对于临床症状相似的传染病,病原体的分离检测是有效的鉴别诊断的手段,CHIKV分离耗时较长,抗原检测ELISA方法的建立,可以快速的鉴定病原,对于疫情的早期应急反应、预防控制工作有重要意义。本研究仍有以下不足之处,制备的抗体均为多克隆抗体,对于抗原捕获的效率相比单克隆抗体要低。免疫用抗原的纯化仍有改进的空间。希望可以对该方法进一步完善,提高敏感性。
综上所述,本研究通过表达CHIKV的VLP样颗粒,制备多克隆抗体,建立了捕获抗原的ELISA方法,并进行了初步评价,为基孔肯雅热的诊断和监测提供了新的方法。
[1] Rezza G, Nicoletti L, Angelini R, et al. Infection with chikungunya virus in Italy: an outbreak in a temperate region[J]. Lancet, 2007,370(9602):1840-1846.doi:10.1016/S0140-6736(07)61779-6.
[2] 李建东, 李德新. 基孔肯雅热[J]. 病毒学报, 2011,27(4):372-377. doi:10.13242/j.cnki.bingduxuebao.002193.
[3] Carey DE. Chikungunya and dengue: a case of mistaken identity?[J]. J Hist Med Allied Sci, 1971,26(3):243-262.
[4] Pastorino B, Muyembe-Tamfum JJ, Bessaud M, et al. Epidemic resurgence of Chikungunya virus in democratic Republic of the Congo: identification of a new central African strain[J]. J Med Virol, 2004,74(2):277-282.doi:10.1002/jmv.20168.
[5] Zheng K, Li J, Zhang Q, et al. Genetic analysis of chikungunya viruses imported to mainland China in 2008[J]. Virol J, 2010,7:8.doi:10.1186/1743-422X-7-8.
[6] 林炳亮, 谢冬英, 翟洁卿, 等. 东莞基孔肯雅热确诊病例的调查分析[J]. 中山大学学报(医学科学版), 2011(2):208-212.doi:10.13471/j.cnki.j.sun.yat-sen.univ(med.sci).2011.0038.
[7] 董必军, 陈文州, 李秀维, 等. 首次从海南岛蚊虫和蝙蝠中分离出两株基孔肯雅病毒[J]. 中国媒介生物学及控制杂志, 1993(3):47-50.
[8] 李建东, 张全福, 张硕, 等. 基于病毒样颗粒的检测基孔肯雅病毒IgM抗体的MacELISA方法的建立与评价[J]. 病毒学报, 2014(6):599-604.doi:10.13242/j.cnki.bingduxuebao.002571.
[9] Pang Z, Li A, Li J, et al. Comprehensive multiplex one-step real-time TaqMan qRT-PCR assays for detection and quantification of hemorrhagic fever viruses[J]. PLoS One, 2014,9(4):e95635.doi:10.1371/journal.pone.0095635.
[10] 郑夔, 丁国允, 周惠琼, 等. 应用含内参的多重实时荧光RT-PCR方法快速检测登革病毒和基孔肯雅病毒[J]. 中国人兽共患病学报, 2013(3):242-247. doi:10.3969/cjz.j.issn.1002-2694.2013.03.007.
[11] Gulland A. Zika virus is a global public health emergency, declares WHO[J]. BMJ, 2016,352:i657.doi:10.1136/bmj.i657.
[12] 郑夔, 袁帅, 梁洁怡, 等. 我国口岸首例输入性寨卡病毒感染病例的实验室检测[J]. 中国国境卫生检疫杂志, 2016(2):77-82.doi:10.16408/j.1004-9770.2016.02.001.
[13] Wang G, Zhang H, Cao X, et al. Using GARP to predict the range of Aedes aegypti in China[J]. Southeast Asian J Trop Med Public Health, 2014,45(2):290-298.
[14] 杨明东, 姜进勇, 郑宇婷, 等. 云南省边境地区埃及伊蚊分布调查[J]. 中国媒介生物学及控制杂志, 2015(4):406-408.doi:10.11853/j.issn.1003.4692.2015.04.020.
[15] 刘起勇. 寨卡病毒媒介伊蚊控制策略和措施展望[J]. 中国媒介生物学及控制杂志, 2016(2):93-98.doi:10.11853/j.issn.1003.8280.2016.02.001.
[16] Chen LH, Wilson ME. Dengue and chikungunya infections in travelers[J]. Curr Opin Infect Dis, 2010,23(5):438-444.doi:10.1097/QCO.0b013e32833c1d16.
[17] Vega-Rua A, Zouache K, Caro V, et al. High efficiency of temperate Aedes albopictus to transmit chikungunya and dengue viruses in the Southeast of France[J]. PLoS One, 2013,8(3):e59716.doi:10.1371/journal.pone.0059716.
[18] 熊劲光, 黄振宇, 陈平华, 等. 一起登革热和一起基孔肯雅热暴发疫情的对比分析[J]. 中华疾病控制杂志, 2012(4):328-331.
[19] Santhosh SR, Parida MM, Dash PK, et al. Development and evaluation of SYBR Green I-based one-step real-time RT-PCR assay for detection and quantification of Chikungunya virus[J]. J Clin Virol, 2007,39(3):188-193.doi:10.1016/j.jcv.2007.04.015.
[20] Ummul HA, Vasan SS, Ravindran T, et al. Development and evaluation of a one-step SYBR-Green I-based real-time RT-PCR assay for the detection and quantification of Chikungunya virus in human, monkey and mosquito samples[J]. Trop Biomed, 2010,27(3):611-623.
[21] 庞正. 病毒性出血热多重荧光定量RT-PCR检测方法的建立[D]. 中国疾病预防控制中心, 2013.
[22] Hugo LE, Prow NA, Tang B, et al. Chikungunya virus transmission between Aedes albopictus and laboratory mice[J]. Parasit Vectors, 2016,9(1):555.doi:10.1186/s13071-016-1838-1.
(本文编辑:唐浏英)
Development of a double antibody sandwich ELISA for detection of Chikungunya virus antigen
XingXiaoyue,WuWei,ZhangShuo,ZhangQuanfu,LiChuan,LiangMifang,LiJiandong,LiDexin
NationalInstituteforViralDiseaseControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China
LiDexin,Email:lidx@chinacdc.cn
Objective To establish a method for detection of chikungunya virus(CHIKV) antigen. Methods CHIKV virus like particle(VLP),that contains all structural proteins, was prepared by baculovirus expression system. Mice and rabbits were immunized with the VLP to develop antibodies against CHIKV. A double antibody sandwich ELISA was established for detection of CHIKV antigens. The concentrations of the antibodies used and the reaction conditions were optimized. The detection limit and repeatability of the ELISA was evaluated. Results The sensitivity and specificity was estimated by 10 mimicking CHIKV sera, 90 health person sera,40 other virus infected sera. It was show that the specificity of DAS-ELISA was 100%, the detection limit was 10 TCID50,the coefficients of variation (CV) within plate was <5%,theCVof different plates was <10%.Conclusions The double antibody sandwich ELISA established in this study can be used to detect the CHIKV antigen in acute phase serum of patient and provide a method for detection of CHIKV.
Chikungunya virus; Virus like particle; Double antibody sandwich ELISA
李德新,Email:lidx@chinacdc.cn
10.3760/cma.j.issn.1003-9279.2017.02.014
国家重点研发计划(2016YFD0500303)
基孔肯雅病毒;病毒样颗粒;双抗体夹心ELISA
2017-01-05)

