内蒙古地区样本MRSA和MSSA临床分离株agr分型特征研究
薛东力,王俊瑞,额尔德木图,孙 鹏,兰海霞
(1内蒙古医科大学,内蒙古呼和浩特010110;2内蒙古医科大学附属医院检验科,内蒙古呼和浩特010050;3内蒙古医科大学科技处,内蒙古呼和浩特010110;4内蒙古医科大学病原生物学实验室,内蒙古呼和浩特010059;5中国人民解放军第253医院,内蒙古呼和浩特010051)
·检验与转化医学·
内蒙古地区样本MRSA和MSSA临床分离株agr分型特征研究
薛东力1,王俊瑞2,额尔德木图3,孙 鹏4,兰海霞5
(1内蒙古医科大学,内蒙古呼和浩特010110;2内蒙古医科大学附属医院检验科,内蒙古呼和浩特010050;3内蒙古医科大学科技处,内蒙古呼和浩特010110;4内蒙古医科大学病原生物学实验室,内蒙古呼和浩特010059;5中国人民解放军第253医院,内蒙古呼和浩特010051)
目的:探究金黄色葡萄球菌附属基因调节子(agr)在耐甲氧西林金黄色葡萄球菌(MRSA)和甲氧西林敏感金黄色葡萄球菌(MSSA)临床株中的分布特征.方法:以50株MSSA株和40株MRSA株作为研究对象,采用多位点序列分型方法(MLST)检测这些菌株的ST型,进一步采用PCR方法检测agrⅠ~Ⅳ型基因在2组金黄色葡萄球菌以及不同ST型金黄色葡萄球菌中的分布.结果:MLST结果显示,MRSA株主要为ST⁃239型(36株,90.0%),MSSA主要为ST⁃5型(10株,20.0%),其次为ST⁃7型(9株,18.0%).90株金黄色葡萄球菌中agr⁃Ⅰ基因占86.7%(78株),agr⁃Ⅱ基因占24.4%(22株),agr⁃Ⅲ基因占3.3%(3株),agr⁃Ⅳ基因占3.3%(3株).MRSA株主要携带agr⁃Ⅰ基因(97.5%/78.0%,P<0.05),而agr⁃Ⅱ基因携带率明显低于MSSA,差异具有统计学意义(P<0.05).Agr基因调控的毒力基因中,hla和fnbA基因表达率均为100%(90株,90/90),sea基因表达率为47.8%(43株,43/90).结论:MRSA株和MSSA株agr基因分型特征差异显著,agr⁃I型基因在MRSA株中呈优势表达,其对MRSA株毒力调控基因表达的影响机制值得进一步研究.
金黄色葡萄球菌;agr分型;多位点序列分型
0 引言
金黄色葡萄球菌是引起医院感染和社区获得性感染的重要致病菌,可造成皮肤和软组织的感染,如化脓性骨髓炎等,已成为威胁公众健康的重大问题之一[1-2].金黄色葡萄球菌发挥其毒力的途径主要是通过多种毒力因子来实现的,包括α⁃溶血素(α⁃hemoly⁃sin,hla)、肠毒素A(enterotoxin A,sea)、纤维粘连蛋白A(Fibronectin⁃binding protein A,fnbA)、杀白细胞毒素D、E(Leucocytic toxin,Luk⁃D、E)等[3-6].这些毒力因子表达水平受几个调控系统的影响,其中之一即为agr调控系统.Agr调控系统全称为金黄色葡萄球菌附属基因调节子调控系统(accessory gene regulato⁃ry system,agr),该调控系统具有双组份调控特征.Agr系统由2个不同转录单位构成,分别由P2和P3启动子驱动.其中,P2操纵子含有agrB、agrD、agrC和agrA 4个基因.AgrA和agrC形成典型的双组份信号转导模型.AgrB、agrD和agrC可形成至少4种agr类型组,即agr⁃Ⅰ、agr⁃Ⅱ、agr⁃Ⅲ和agr⁃Ⅳ4种.Agr基因的分化特征被认为与金黄色葡萄球菌的系统发育有关,并与菌株特定毒力特征有关,如agr⁃Ⅲ基因阳性菌株常可引起毒性休克综合征.另有研究[7]显示,不同来源菌株agrⅠ~Ⅳ型基因分布具有十分明显的特征.多重耐药金黄色葡萄球菌(multi⁃resistant Staphylococcus aureus,MRSA)等[8-9]在住院患者中分离率的不断提高,进一步阐明MRSA致病特征及其遗传背景特征对于更好地防控和治疗MRSA感染及研发新型抗MRSA感染药物具有重要意义.
本研究旨在对MRSA和甲氧西林敏感金黄色葡萄球菌(methicillin sensitive Staphylococcus aureus,MSSA)临床分离株中agrⅠ~Ⅳ等位基因分布特征进行初步研究,探究MRSA临床分离株中优势agr等位基因及其调控的下游关键毒力基因的表达特征,为更好地阐明agr调控系统在MRSA致病中的作用机制提供更多实验数据和思路.
1 材料和方法
1.1 菌株的收集收集2011-12/2013-10内蒙古地区不同医院住院患者分离90株金黄色葡萄球菌作为研究对象,其中MRSA40株、MSSA50株.33株分离自伤口分泌物,其中19株为MRSA,14株为MSSA;15株分离自脓液,其中4株为MRSA,11株为MSSA;13株分离自全血标本,其中6株为MRSA,7株为MSSA;18株分离自下呼吸道,其中9株为MRSA,9株为MSSA;6株分离自咽拭子,其中1株为MRSA,5株为MSSA;2株分离自尿液标本,全部为MSSA;1株分离自腹水,且为MSSA;1株分离自关节腔积液,为MRSA菌株;1株分离自粪便标本,为MSSA菌株.所选菌株再次采用革兰阳性球菌鉴定卡(GP卡)(法国生物梅里埃公司)进行鉴定和确认.采用头孢西丁纸片扩散法核对甲氧西林敏感株,质控菌株(ATCC 25923)由本实验室保存,药敏结果判断依据为美国临床与实验室标准化协会标准(CLSI 2015版)[10].
1.2 多位点序列分型(Multilocus sequence typing,MLST) 按照试剂盒(细菌基因组DNA提取试剂盒,天根生化科技有限公司)说明书对各菌株纯培养物进行DNA提取,利用金黄色葡萄球菌MLST分型[11]用7个管家基因(arc,aro,glp,gmk,pta,tpi,and yqi)特异性引物进行PCR扩增.具体实验步骤参考王俊瑞等的方法[11]进行.最终纯化PCR产物并送生工生物工程(上海)股份有限公司进行测序,测序结果与MLST数据库(http://saureus.mlst.net)中序列进行比对,得到每株菌ST分型.
1.3 agr等位基因检测按照1.2中提取各菌株DNA进行多重PCR反应[12-13],扩增agr4个等位基因(agr⁃Ⅰ,agr⁃Ⅱ,agr⁃Ⅲ和agr⁃Ⅳ)以及agr调控系统关键下游调控毒力基因(hla,fnbA和sea)进行扩增.引物序列信息见表1[14-16].

表1 agr(agr⁃Ⅰ,agr⁃Ⅱ,agr⁃Ⅲ和agr⁃Ⅳ)、毒力基因扩增引物
1.4 统计学处理采用SPSS19.0统计学软件进行数据分析,计量资料采用MRSA与MSSA株中各基因分布差异行χ2检验.P<0.05表示差异有统计学意义.
2 结果
2.1 MLST分型MRSA主要是ST⁃239(90.0%,36/40),其次为ST⁃338(5.0%,3/40);50株MSSA中最常见的类型为ST⁃5(20.0%,10/50),其次为ST⁃7(18.0%,9/50,表2).7个管家基因PCR产物琼脂糖凝胶电泳结果如图1所示.

表2 MRSA株和MSSA株MLST分型结果
图1 部分菌株MLST分型7个管家基因琼脂糖凝胶电泳结果
2.2 不同标本分离菌株MLST分型结果90株金黄色葡萄球菌中,ST⁃239主要标本类型为伤口分泌物(48.7%,18/37),ST⁃5主要标本类型为脓液(40.0%,4/10),见表3.
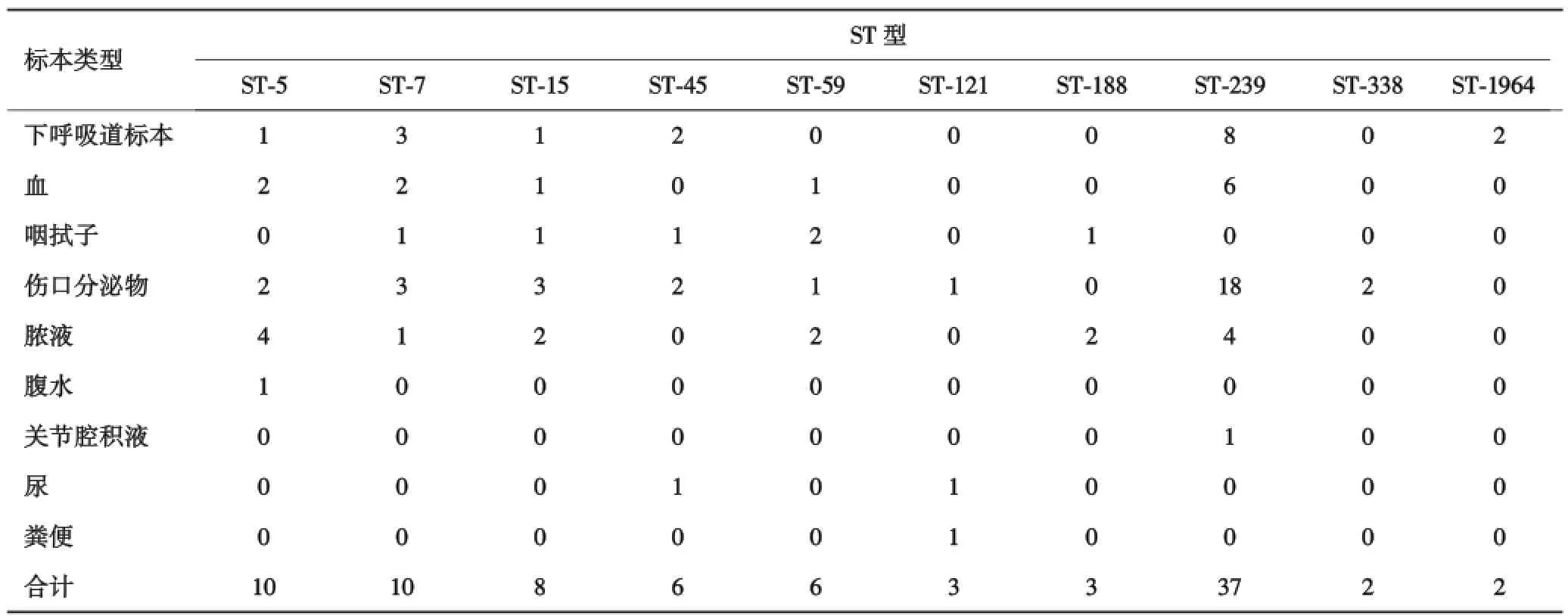
表3 不同类型标本分离菌株MLST分型结果
2.3 agr等位基因分布特征所有90株菌种agr基因阳性率(100%,90/90).agr⁃Ⅳ基因仅存在于MSSA菌株中,而MSSA菌株agr⁃Ⅱ携带率明显高于MRSA菌株,差异具有统计学意义(38.0%/7.5%,P<0.05).此外,MRSA株agr⁃Ⅰ基因携带率明显高于MSSA菌株,差异具有统计学意义(97.5%/78.0%,P<0.05,表4).Agr各型别PCR扩增产物见图2~5.
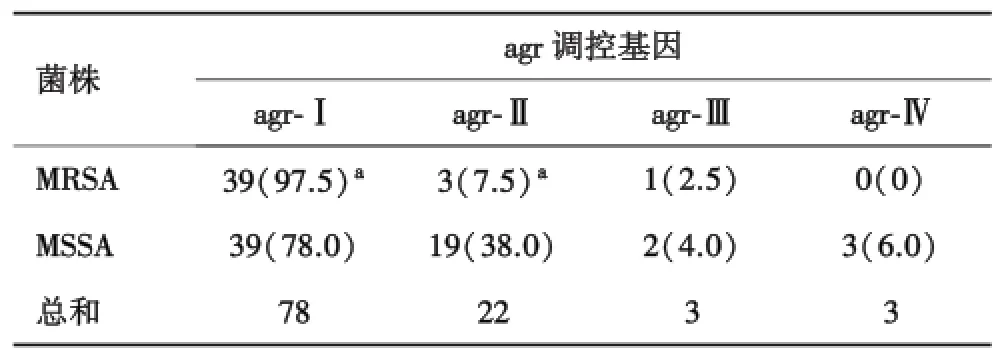
表4 agr调控基因在不同菌株中的分布n(%)
图2 部分菌株agr⁃Ⅰ基因PCR产物琼脂糖凝胶电泳结果

图3 部分菌株agr⁃II基因PCR产物琼脂糖凝胶电泳结果

图4 部分菌株agr⁃III基因PCR产物琼脂糖凝胶电泳结果

图5 部分菌株agr⁃IV基因PCR产物琼脂糖凝胶电泳结果
Agr各亚型基因分布在不同ST型金黄色葡萄球菌中的分布特征:ST⁃239型中37株为agr⁃Ⅰ基因;ST⁃5型中8株为agr⁃Ⅱ基因,6株为agr⁃Ⅰ基因;ST⁃7型全部为agr⁃Ⅰ基因;ST⁃15型中8株为agr⁃Ⅱ基因,2株为agr⁃Ⅰ基因,见表5.
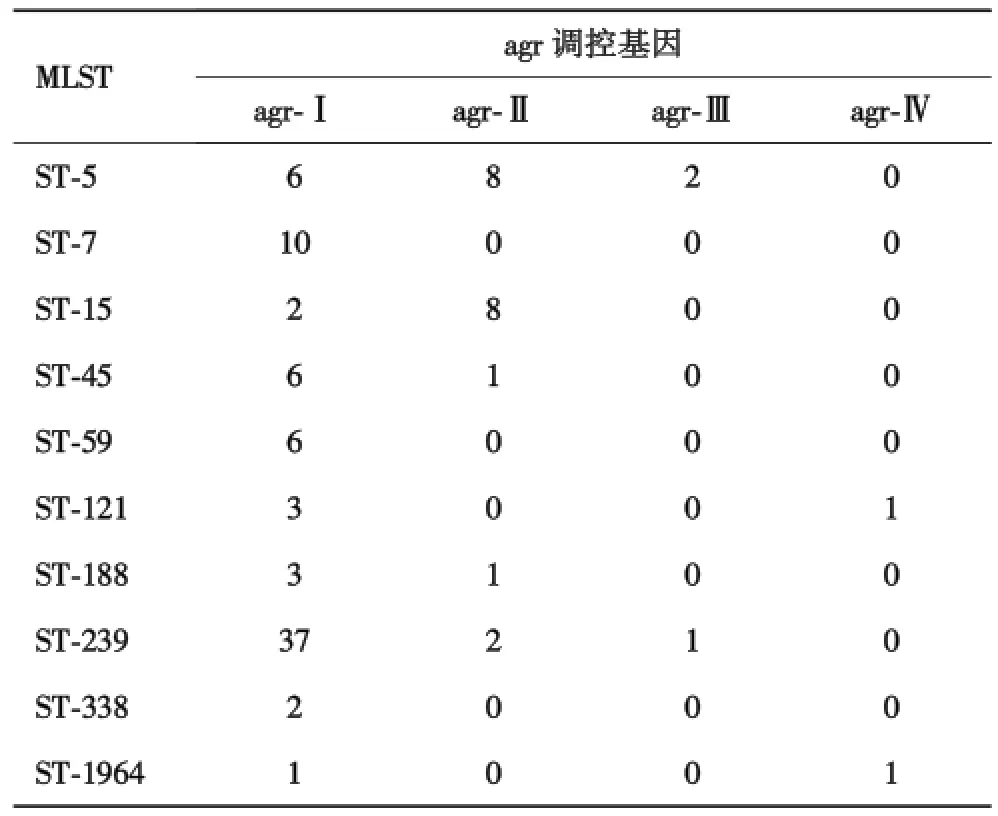
表5 agr调控基因在不同ST型菌株中的分布
2.4 毒力基因分布特征Agr基因调控的毒力基因中(PCR扩增结果见图6~8),hla、fnbA在90株金黄色葡萄球菌中的总阳性率为100%(90株,90/90),sea阳性率为47.8%(43株,43/90),且MRSA菌株的携带率明显高于MSSA菌株(77.5%/24.0%),差异有统计学意义(P<0.05,表6).

图6 hla毒力基因部分分布
图7 fnbA毒力基因部分分布

图8 sea毒力基因部分分布

表6 各毒力基因在MRSA、MSSA菌株中的分布n(%)
3 讨论
本研究以内蒙古地区住院病人分离90株MRSA和MSSA株为研究对象,首先对2类菌株MLST分子分型特征及agr等位基因分布特征进行了研究.纳入研究的菌株中,agr⁃Ⅰ型基因分布率最高,其次为agr⁃Ⅱ型基因,agr⁃Ⅲ和agr⁃Ⅳ基因总阳性率仅为3.3%.而Khan等[17]和Xie等[18]研究均发现金黄色葡萄球菌临床分离株中agr⁃Ⅰ和agr⁃Ⅲ基因阳性率最高,与本研究结果存在一定差异,这提示,不同地域分离株可能由于基因背景差异导致agr基因型进化上出现差异.Agr⁃Ⅱ型基因在国内不同地区分布特征差异及其机制有待进一步研究.国外一些研究显示,MRSA株中agr⁃Ⅱ型基因阳性率明显高于其它三个agr亚型基因[19-21],而且这类菌株在万古霉素作用下,agr⁃II基因的表达水平明显增高,提示万古霉素可能参与agr⁃Ⅱ阳性MRSA株的毒力调控.更有研究[19]显示,MRSA株agr⁃Ⅱ阳性可能预示其对万古霉素治疗的耐受.进一步分析本研究结果发现,40株MRSA株中agr⁃Ⅱ基因阳性率(7.5%)明显低于MSSA株(38.0%).相反,40株MRSA株agr⁃Ⅰ基因阳性率(97.5%)高于MSSA株(78.0%).不同地区分离株agr基因多态性及其毒力调控特征值得进一步探究.
另外,对90株金黄色葡萄球菌进行MLST分型发现,MRSA株主要为ST⁃239型(90.0%),MSSA株主要为ST⁃5型(20.0%),其次为ST⁃7型(18.0%).ST⁃5型菌株主要携带agr⁃Ⅱ基因(40.0%),携带率明显高于agr⁃Ⅰ基因(7.9%).提示agr基因型与菌株ST可能存在一定相关性,但由于本研究所选菌株数量有限,其相关性尚需进一步研究确定.
agr基因与毒力基因之间有一定的相关性[22],我们进一步对agr调控系统调控的几个关键毒力基因(hla、fnbA和sea)在90株金黄色葡萄球菌中的分布特征进行了研究.结果发现,hla和fnbA基因阳性率均为100%,与国内一些最新研究结果相似[23-26],但明显高于国内另外相关研究所得数据[27].溶血素基因在MRSA中高度保守,其蛋白能破坏多种宿主细胞,还有多种促炎效应,是导致金黄色葡萄球菌肺炎和脓毒症的重要毒素因子[28].本研究中另一个检测的毒力基因fnbA阳性率也为100%,与国内一些相关研究结果相同[23,29],同样高于国内另外一些研究所得结果[26,30].fnbA蛋白主要负责金黄色葡萄球菌与宿主细胞和细胞外基质进行粘附和生物被膜的形成.hla和fnbA表达率高,提示这些菌株可能具有更强的体外粘附和侵袭能力.另外,我们检测的sea基因阳性率为47.8%(43株,43/90),而且MRSA菌株的携带率明显高于MSSA菌株(77.5%/24.0%),这一结果与申丽等[25]的研究结果相近.但该比例明显高于另外一些研究结果[27].Sea与MRSA株致病性的相关性及与地区分布特征之间的相关性值得进一步研究.金黄色葡萄球菌毒力基因分布特征与特定克隆株的致病性密切关联,不同地区优势克隆株毒力基因及其调控系统的分布需要更深入的研究,高表达的毒力蛋白可能作为今后金黄色葡萄球菌靶向抗菌药物研发的靶点,特别是对于MRSA及万古霉素异质性耐药金黄色葡萄球菌等多重耐药菌株的重症感染.
另外,本研究未发现agr阴性菌株,这一现象值得我们进一步研究.Paulander等[31]的研究指出15%~60%的金黄色葡萄球菌临床分离菌株是agr缺陷性菌株,他们认为抗生素的过量使用是造成金黄色葡萄球菌大量菌株出现agr阴性的原因,agr的缺失与抗生素的使用和菌株的变异之间存在着直接的联系,并且认为agr阴性的菌株比agr阳性的菌株对某些抗生素的亚致死浓度具有更好的适应性.
本研究中检测的MRSA菌株,其agr⁃Ⅱ基因携带率显著低于国外相关研究报道.万古霉素治疗对该型菌株耐药性演变及在人群中的传播如何产生影响值得我们进一步关注和探究.
[1]Hathaway H,Ajuebor J,Stephens L,et al.Thermally triggered release of the bacteriophage endolysin CHAPK and the bacteriocin lysostaphin for the control of methicillin resistant Staphylococcus aureus(MRSA)[J].J Control Release,2017,245:108-115.
[2]Mohammad M,Na M,Welin A,et al.RAGE deficiency impairs bac⁃terial clearance in murine staphylococcal sepsis,but has no signifi⁃cant impact on staphylococcal septic arthritis[J].PLoS One,2016,11(12):e0167287.
[3]Otto M.Staphylococcus aureus toxins[J].Curr Opin Microbiol,2014,17:32-37.
[4]Kawaguchiya M,Urushibara N,Yamamoto D,et al.Characterization of PVL/ACME⁃positive methicillin⁃resistant Staphylococcus aureus(genotypes ST8⁃MRSA⁃Ⅳand ST5⁃MRSA⁃II)isolated from a univer⁃sity hospital in Japan[J].Microb Drug Resist,2013,19(1):48-56.
[5]Zhao C,Liu Y,Zhao M,et al.Characterization of community acquired Staphylococcus aureus associated with skin and soft tissue infection in Beijing:high prevalence of PVL+ST398[J].PloS one,2012,7(6):e38577.
[6]Jiménez JN,Ocampo AM,Vanegas JM,et al.Characterisation of virulence genes in methicillin susceptible and resistant Staphylococ⁃cus aureus isolates from a paediatric population in a university hospi⁃tal of Medellín,Colombia[J].Mem Inst Oswaldo Cruz,2011,106(8):980-985.
[7]王 琼,唐俊妮,汤 承,等.针对不同来源金黄色葡萄球菌分离菌株的agr I⁃IV分型初探[J].西南民族大学学报(自然科学版),2014,40(3):354-357.
[8]Limbago BM,Kallen AJ,Zhu W,et al.Report of the 13th vancomy⁃cin⁃resistant Staphylococcus aureus isolate from the United States[J].J Clin Microbiol,2014,52(3):998-1002.
[9]Nannini E,Murray BE,Arias CA.Resistance or decreased suscepti⁃bility to glycopeptides,daptomycin,and linezolid in methicillin⁃re⁃sistant Staphylococcus aureus[J].Curr Opin Pharmacol,2010,10(5):516-521.
[10]CLSI.Document M100⁃S23.Performance standards for antimicrobial susceptibility testing;23rd informational supplement[S].Wayne,PA,USA,2013.
[11]王俊瑞,杜小莉,塔 拉,等.甲氧西林耐药/敏感金黄色葡萄球菌基因分型和毒力基因检测[J].中国感染与化疗杂志,2015,15(1):70-75.
[12]Wu D,Li X,Yang Y,et al.Superantigen gene profiles and presence of exfoliative toxin genes in community⁃acquired methicillin⁃resistant Staphylococcus aureus isolated from Chinese children[J].J Med Microbiol,2011,60(Pt 1):35-45.
[13]Argudín MA,Tenhagen BA,Fetsch A,et al.Virulence and resist⁃ance determinants of German Staphylococcus aureus ST398 isolates from nonhuman sources[J].Appl Environ Microbiol,2011,77(9):3052-3060.
[14]Jarraud S,Mougel C,Thioulouse J,et al.Relationships between Staphylococcus aureus genetic background,virulence factors,agr groups(alleles),and human disease[J].Infect Immun,2002,70(2):631-641.
[15]Salasia SI,Khusnan Z,Lammler C,et al.Comparative studies on pheno⁃and genotypic properties of Staphylococcus aureus isolated from bovine subclinical mastitis in central Java in Indonesia and Hesse in Germany[J].J Vet Sci,2004,5(2):103-109.
[16]Peacock SJ,Moore CE,Justice A,et al.Virulent combinations of adhesin and toxin genes in natural populations of Staphylococcus aureus[J].Infect Immun,2002,70(9):4987-4996.
[17]Khan S,Rasheed F,Zahra R.Genetic polymorphism of agr locus and antibiotic resistance of Staphylococcus aureus at two hospitals in Pakistan[J].Pak J Med Sci,2014,30(1):172-176.
[18]Xie Y,He Y,Gehring A,et al.Genotypes and toxin gene profiles of Staphylococcus aureus clinical isolates from China[J].PLoS One,2011,6(12):e28276.
[19]Cázares⁃Domínguez V,Ochoa SA,Cruz⁃Córdova A,et al.Vancomy⁃cin modifies the expression of the agr system in multidrug⁃resistant Staphylococcus aureus clinical isolates[J].Front Microbiol,2015,6:369.
[20]Ando E,Monden K,Mitsuhata R,et al.Biofilm formation among methicillin⁃resistant Staphylococcus aureus isolates from patients with urinary tract infection[J].Acta Med Okayama,2004,58(4):207-214.
[21]Argudín MA,Mendoza MC,Méndez FJ,et al.Clonal complexes and diversity of exotoxin gene profiles in methicillin⁃resistant and methicil⁃lin⁃susceptible Staphylococcus aureus isolates from patients in a Spanish hospital[J].J Clin Microbiol,2009,47(7):2097-2105.
[22]Thompson TA,Brown PD.Association between the agr locus and the presence of virulence genes and pathogenesis in Staphylococcus aureus using a Caenorhabditis elegans model[J].Int J Infect Dis,2016,12(16):31629-31630.
[23]翁幸鐾,糜祖煌.金黄色葡萄球菌临床分离株功能基因及其二元分型研究[J].中华临床感染病杂志,2014,7(1):21-26.
[24]董燕红,李士朋,乔艳红,等.儿童耐甲氧西林金黄色葡萄球菌感染分离株毒力特征研究[J].中华实用儿科临床杂志,2015,30(10):733-737.
[25]申 丽,姜 南,杨志勇,等.痤疮感染金黄色葡萄球菌分子分型及毒力特征[J].广东医学,2016,37(6):856-858.
[26]姜如金,朱健铭,翁幸鐾,等.金黄色葡萄球菌人体创面分离株94种毒力基因研究[J].中华传染病杂志,2015,33(9):550-552.
[27]陈 旭,顾飞飞,王文奎,等.四家医院烧伤科临床分离金黄色葡萄球菌的毒力因子分析[J].中华烧伤杂志,2013,29(6):561-563.
[28]Crémieux AC,Saleh⁃Mghir A,Danel C,et al.α⁃Hemolysin,not Pan⁃ton⁃Valentine leukoeidin,impacts rabbit mortality from severe sepsis with Methieillin⁃Resistant staphylococcus aureus osteomyelitis[J].J Infect Dis,2014,209(11):1773-1780.
[29]黄支密,糜家瑞,罗雪平,等.创伤患者医院内感染耐甲氧西林金黄色葡萄球菌毒力基因分析[J].医学研究杂志,2016,45(2):108-112.
[30]祝 进,陆 军,余旭良,等.不同来源耐甲氧西林金黄色葡萄球菌毒力基因的研究[J].检验医学,2012,27(6):475-478.
[31]Paulander W,Nissen Varming A,Bæk KT,et al.Antibiotic⁃mediated selection of quorum⁃sensing⁃negative Staphylococcus aureus[J].Mbio,2013,3(6):e00459-12.
Study on the Agr genotyping features of MRSA and MSSA clinical isolates from Inner Mongolia
XUE Dong⁃Li1,WANG Jun⁃Rui2,Erdemtuu3,SUN Peng4,LAN Hai⁃Xia5
1Inner Mongolia Medical University,Hohhot 010110,China;2Clinical Laboratory,Affiliated Hospital of Inner Mongolia Medi⁃cal Univercity,Hohhot 010050,China;3Department of Science and Technology,Inner Mongolia Medical Univercity,Hohhot 010110,China;4Pathogenic Organisms Laboratory,Inner Mon⁃golia Medical Univercity,Hohhot 010059,China;5The 253rd Hospital of People's Liberation Army,Hohhot 010051,China
AIM:To investigate the distribution characteristics of accessory gene regulator(agr)in clinical strains of methicillin⁃resistant staphylococcus aureus(MRSA)and methicillin sensitive staphylococcus aureus(MSSA).METHODS:A total of 50 strains of MRSA and 40 strains of MSSA were selected as the research objects.The multilocus sequence typing(MLST)was used to detect the ST types,then polymerase chain reaction(PCR)was used to detect the distribution of agrⅠ~Ⅳgenes in these 2 groups of staphylococcus strains and staphylococcus aureus with different ST types.RESULTS:The MLST showed that MR⁃SA strains were mainly clustered into ST⁃239 type(36 strains,90%),and MSSA strains mainly belonged to ST⁃5(10 strains,20%),followed by ST⁃7(9 strains,18%).Among the 90 strains of staphylococcus aureus tested,the positive rate agr⁃Ⅰgenes was 86.7%(78 strains),and positive rates of the other three agr genes were respectively 24.4%(22 strains),3.3%(3 strains)and 3.3%(3 strains).MRSA strains carried higher rate of agr⁃Ⅰgene(97.5%/78%,P<0.05),while the carrying rate of agr⁃Ⅱgene in the MRSA strains was significantly lower than that of the MSSA(P<0.05).As one of the virulence genes regulated by agr regulatary system,expression rate of both hla and fnbA were 100%(90 strains,90/90),while the carrying rate of sea gene was 47.8%(43 strains,43/90).CONCLUSION:Agr genoty⁃ping features of MRSA and MSSA strains tested in this study are significantly different.Agr⁃Ⅰgene is predominatly expressed in MRSA strains,and the regulatory mechanism of this regulating system in MRSA strains is still needed to be further investigated.
staphylococcus aureus;Agr genotyping;multilocus sequence typing
R446.5
A
2095⁃6894(2017)04⁃55⁃06
2016-11-26;接受日期:2016-12-12
内蒙古科技计划项目(20140144);内蒙古自然科学基金项目(2016MS0829);内蒙古自治区卫生和计划生育委员会科研项目(201303061)
薛东力.硕士在读.E⁃mail:347342672@qq.com
兰海霞.副主任医师.E⁃mail:08shuoshuo@163.com

