同时测定人血浆中柚皮苷、柚皮素质量浓度的HPLC-MS/MS方法学*
曾璇,苏薇薇,白杨,彭维,姚宏亮
(中山大学生命科学学院∥广东省中药上市后质量与药效再评价工程技术研究中心,广东 广州 510275)
同时测定人血浆中柚皮苷、柚皮素质量浓度的HPLC-MS/MS方法学*
曾璇,苏薇薇,白杨,彭维,姚宏亮
(中山大学生命科学学院∥广东省中药上市后质量与药效再评价工程技术研究中心,广东 广州 510275)
采用HPLC-MS/MS建立了同时测定人血浆中柚皮苷、柚皮素质量浓度的方法。以异槲皮苷为内标,血浆样品经乙酸乙酯萃取后,以Agilent Poroshell 120 EC-C18(3.0 mm×30 mm,2.7 μm)为色谱柱,甲醇-水(体积比45∶55,均含φ=0.1%甲酸)为流动相,流速为0.4 mL·min-1;采用电喷雾负离子(ESI-)、多反应离子检测(MRM)模式检测,用于定量分析的离子对分别为柚皮苷m/z579.1/270.8、柚皮素m/z270.9/150.7、异槲皮苷(内标)m/z463.1/299.8。经方法学验证,柚皮苷、柚皮素分别在0.251 0~100.4、0.503 0~201.2 ng·mL-1质量浓度范围内线性关系良好,批间、批内精密度均符合要求,提取回收率高。结果表明,HPLC-MS/MS法灵敏度好、准确性高、重现性好,适用于测定人血浆中柚皮苷、柚皮素质量浓度。
人血浆;柚皮苷;柚皮素;HPLC-MS/MS
柚皮苷是本团队研发的原创化学一类新药[1],具有很好的止咳[2]、化痰[3]及抗炎[4-5]作用,已获得国家食品药品监督管理总局颁发的药物临床试验批件,柚皮素是柚皮苷进入体内的主要代谢产物[6]。目前已报道的测定人血浆中柚皮苷、柚皮素质量浓度的方法,存在定量下限高、提取回收率低、样品处理复杂等问题[7-9]。笔者通过优化流动相组成及比例、改进内标选择和样品处理方法,建立了一种定量下限低、提取回收率高、样品处理简单的能够同时测定人血浆中柚皮苷、柚皮素质量浓度的方法,符合2015版《中国药典》四部“生物样品定量分析方法验证指导原则”要求,现报道如下。
1 仪器与试药
1200SL HPLC-6410 QQQ液相色谱-质谱联用仪(美国Agilent公司);Centrifuge 5415R台式高速冷冻离心机(德国Eppendorf公司);Vortex-Genie 2涡旋振荡器(美国Scientific Industries公司);Simplicity超纯水器(美国Millipore公司);HWS24型电热恒温水浴锅(上海一恒科技有限公司);KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司);BP211D 电子分析天平(德国Sartorius公司);EYELA MG-2200型氮吹仪(日本东京理化器械株式会社);移液器(德国Eppendorf公司)。
柚皮苷(供含量测定用,批号:110722-201312)购自中国食品药品检定研究院,柚皮素(纯度99.5%,批号:038K1039)及异槲皮苷(纯度90.5%,批号:BCBL9721V)均购自美国Sigma-Aldrich公司。
甲醇(LC/MS级,Fisher Scientific公司)、乙酸乙酯(色谱级,B&J公司)、甲酸(MS级,Fluka公司)、β-葡萄糖醛酸酶(Type H-1,Sigma-Aldrich公司),水为超纯水。
2 方法与结果
2.1 色谱及质谱条件
色谱条件:色谱柱为Agilent Poroshell 120 EC-C18(3.0 mm×30 mm,2.7 μm),流动相为甲醇-水(45∶55,均含φ=0.1%甲酸),流速为0.4 mL·min-1,柱温为40 ℃。
离子源参数:Capillary 4 000 V,Drying Gas 10 L·min-1,Neb Pressure 25 psi,Gas Temp 350 ℃。采用电喷雾负离子(ESI-)、多反应监测(MRM)模式进行检测,定量离子对及相应参数如下:柚皮苷m/z579.1/270.8,Fragmentor 225 V,Collision Energy 33 V;柚皮素m/z270.9/150.7,Fragmentor 100 V,Collision Energy 12 V;异槲皮苷(内标)m/z463.1/299.8,Fragmentor 128 V,Collision Energy 24 V。
2.2 溶液的配制
2.2.1 对照品储备液的配制 分别精密称取105 ℃干燥至恒量的柚皮苷、柚皮素对照品适量,置于2个10 mL量瓶中,用甲醇溶解,φ=45%甲醇水定容,分别制成柚皮苷、柚皮素质量浓度为1 mg·mL-1的校正标样储备液。另各平行一份制成质控样品储备液。4 ℃保存备用。
2.2.2 内标溶液的配制 精密称取五氧化二磷减压干燥至恒量的异槲皮苷对照品适量,置10 mL棕色量瓶中,用甲醇溶解,φ=45%甲醇水定容,制成异槲皮苷质量浓度为1 mg·mL-1的内标储备液。用φ=45%甲醇水将储备液稀释至1 μg·mL-1,作为内标工作液,4 ℃保存备用。
2.2.3 β-葡萄糖醛酸酶溶液的配制 精密称取β-葡萄糖醛酸酶适量,用0.2 mmol·L-1醋酸缓冲液(pH=5.0)溶解,制成10 unit·μL-1的β-葡萄糖醛酸酶溶液。
2.3 校正标样及质控样品的制备
2.3.1 血浆校正标样的制备 分别取柚皮苷、柚皮素校正标样储备液适量,置10 mL量瓶中,用φ=45%甲醇水稀释成柚皮苷质量浓度分别为5、10、20、50、120、200、500、1 000、1 500和2 000 ng·mL-1,柚皮素质量浓度分别为10、20、40、100、240、400、1 000、2 000、3 000和4 000 ng·mL-1的校正标样工作液。取空白血浆200 μL,然后分别加入相应质量浓度的校正标样工作液10 μL,制成柚皮苷质量浓度分别为0.25、0.5、1、2.5、6、10、25、50、75和100 ng·mL-1,柚皮素质量浓度分别为0.5、1、2、5、12、20、50、100、150和200 ng·mL-1的血浆校正标样。
2.3.2 血浆质控样品的制备 分别取柚皮苷、柚皮素质控样品储备液适量,置10 mL量瓶中,用φ=45%甲醇水稀释成柚皮苷质量浓度分别为10、120、500、1 500 ng·mL-1,柚皮素质量浓度分别为20、240、1 000和3 000 ng·mL-1的质控样品工作液。取空白血浆200 μL,然后分别加入相应质量浓度的质控样品工作液10 μL,制成柚皮苷质量浓度分别为0.5、6、25和75 ng·mL-1,柚皮素质量浓度分别为1、12、50和150 ng·mL-1的血浆质控样品。
2.4 血浆样品的处理
取血浆样品200 μL,加入φ=45%甲醇水10 μL,然后加入β-葡萄糖醛酸酶溶液20 μL(10 Unit·μL-1),混匀,37 ℃水浴2 h。取出后,加入内标工作液10 μL,混匀,再加入φ=2%甲酸水溶液12 μL酸化,混匀后加入乙酸乙酯2 000 μL,涡旋1 min,10 000 r·min-1离心10 min(4 ℃),转移上清,氮气吹干。然后加入200 μL流动相复溶,超声5 min,涡旋5 min,13 000 r·min-1离心45 min(20 ℃),取上清液10 μL进样。
2.5 方法专属性
取6名临床健康受试者的空白血浆200 μL,除不加内标工作液外,按“2.4”项下方法操作,得空白血浆样品色谱图(图1:A-F);按“2.3.2”项操作得柚皮苷质量浓度为6 ng·mL-1、柚皮素质量浓度为12 ng·mL-1的血浆质控样品,然后按“2.4”项下方法操作,得质控血浆样品色谱图(图1:G);取健康受试者口服柚皮苷后采集的血浆样品,按“2.4”项下方法操作,得给药后血浆样品色谱图(图1:H)。结果表明:在目标成分柚皮苷、柚皮素及内标异槲皮苷的保留时间处无杂质干扰;目标成分柚皮苷、柚皮素及内标异槲皮苷之间亦无干扰。
2.6 残留效应
通过在注射柚皮苷质量浓度为75 ng·mL-1、柚皮素质量浓度为150 ng·mL-1的高质量浓度血浆质控样品后,注射空白样品来估计残留。结果表明:空白样品中未检出目标成分柚皮苷、柚皮素及内标异槲皮苷,无残留效应。
2.7 标准曲线范围与定量下限
按“2.3.1”项操作得血浆校正标样,然后按“2.4”项下方法处理,进样测定。采用最小二次加权法,以目标成分峰面积与内标峰面积之比为纵坐标Y、目标成分质量浓度为横坐标X进行线性回归,得线性回归方程如下:
Y1=2.882 8X1+ 0.002 8(柚皮苷),
r=0.995 8;
Y2=4.577 3X2+0.008 4(柚皮素),
r=0.998 0
结果表明:柚皮苷在0.25~100 ng·mL-1、柚皮素在0.5~200 ng·mL-1质量浓度范围内线性关系良好;柚皮苷、柚皮素的定量下限分别为0.25、0.5 ng·mL-1。
2.8 方法的精密度与准确度
按“2.3”项操作得定量下限样品、血浆质控样品,然后按“2.4”项下方法处理。取定量下限样品、血浆质控样品上清液10 μL进样测定,计算批内精密度、准确度;连续测定3 d,计算批间精密度、准确度。结果表明:柚皮苷和柚皮素的精密度(批内、批间)和准确度均符合生物样品测定的要求(见表1、表2)。
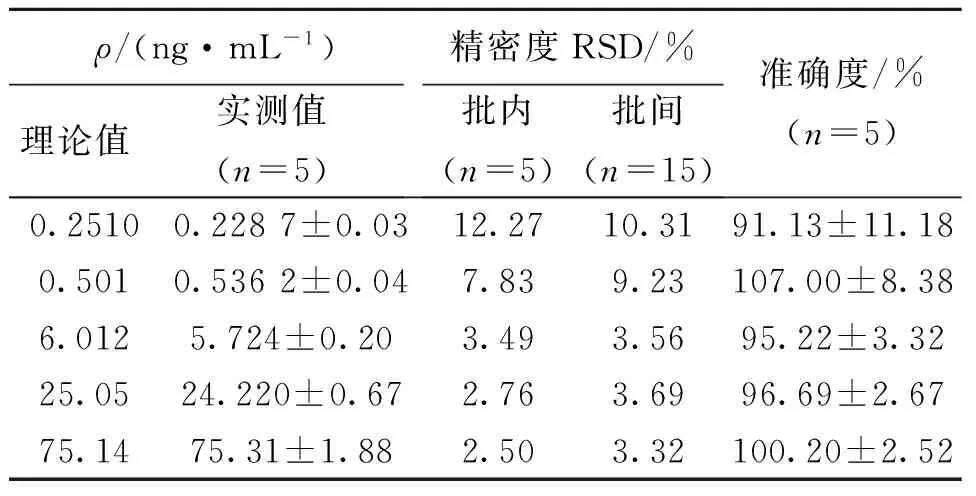
表1 方法的精密度与准确度(柚皮苷)Table 1 Precision and accuracy of the assay method (naringin)
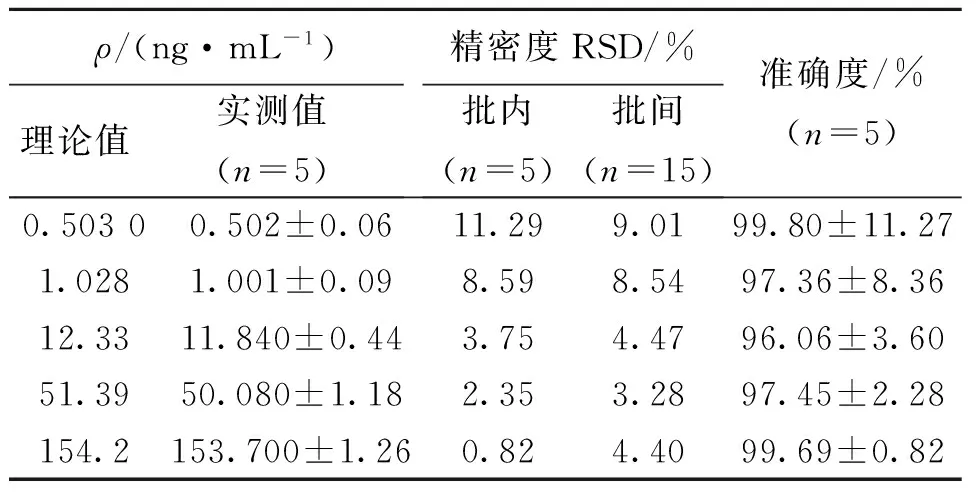
表2 方法的精密度与准确度(柚皮素)Table 2 Precision and accuracy of the assay method (naringenin)
2.9 提取回收率
取空白血浆200 μL,除不加内标工作液外,按“2.4”项下方法处理。复溶时加入φ=45%甲醇水180 μL,然后分别加入相应质量浓度的质控样品工作液10 μL,加入内标工作液10 μL,超声5 min,涡旋5 min,13 000 r·min-1离心45 min(20 ℃),制得SAE样品。
分别测定对应质量浓度的SAE样品、血浆质控样品,计算提取回收率:

图1 人血浆中柚皮苷、柚皮素及异槲皮苷的提取离子流色谱图A-F:6个不同来源空白血浆;G:空白血浆+柚皮苷+柚皮素;H:受试者给药后2 h血浆样品Fig.1 Chromatograms of naringin, naringenin and isoquercitrin in human plasmaA-F:Blank plasma samples from six different origins; G:Blank plasma + naringin + naringenin; H:Plasma sample of subject at 2 h post dose
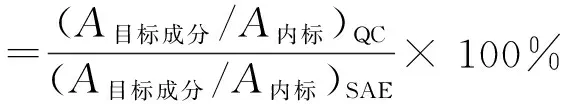
式中,(A目标成分/A内标)QC是指血浆质控样品的目标成分峰面积与内标峰面积之比,(A目标成分/A内标)SAE是指SAE样品的目标成分峰面积与内标峰面积之比。柚皮苷、柚皮素提取回收率测定结果见表3。
2.10 基质效应
本研究采用6名临床健康受试者的空白血浆,考察了柚皮苷、柚皮素在低质量浓度(柚皮苷、柚皮素质量浓度分别为0.5、1 ng·mL-1)、高质量浓度(柚皮苷、柚皮素质量浓度分别为75、150 ng·mL-1)水平下的基质效应。
取φ=45%甲醇水180 μL,分别加入相应质量浓度的质控样品工作液10 μL,再加入内标工作液10 μL,混匀,制成低、高质量浓度的Sol样品。
分别测定对应质量浓度的SAE样品、Sol样品,计算基质效应:

式中,(A目标成分/A内标)SAE是指SAE样品的目标成分峰面积与内标峰面积之比,(A目标成分/A内标)Sol是指Sol样品的目标成分峰面积与内标峰面积之比。柚皮苷和柚皮素在低、高质量浓度水平下的基质效应见表4,其RSD均小于15%,符合生物样品测定的要求。
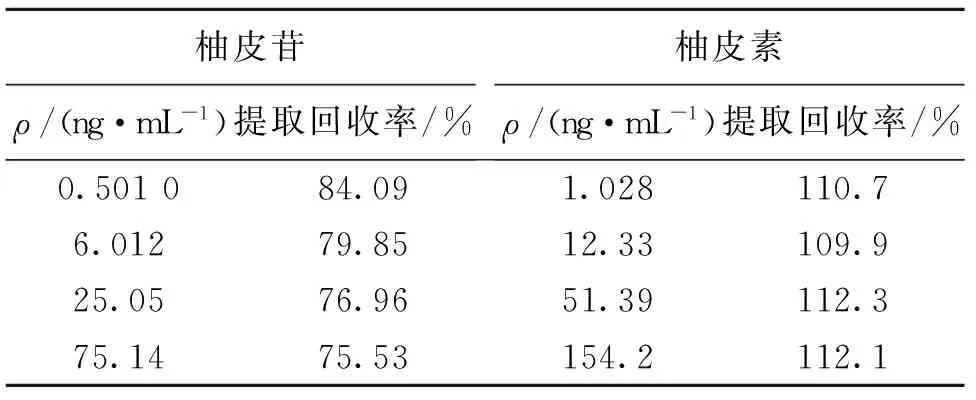
表3 方法的提取回收率(n=3)Table 3 Recoveries of the assay method (n=3)
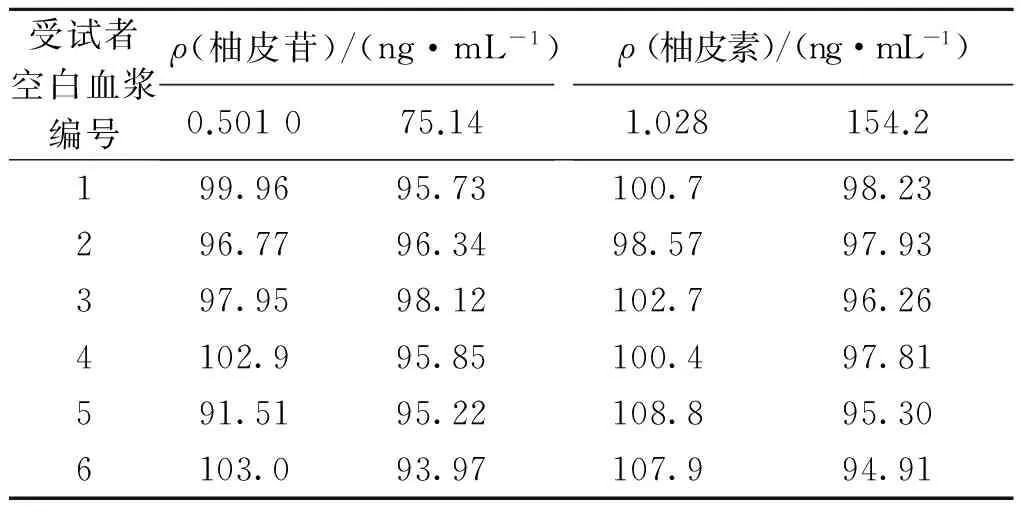
表4 方法的基质效应(n=3)Table 4 Matrix effects of the assay method (n=3) /%
2.11 稀释可靠性与稳定性试验
按表5所列的考察项目,逐项试验,结果表明:该方法的稀释可靠性与稳定性均符合生物样品测定的要求。
3 讨论与结论
3.1 流动相的选择
本研究考察了流动相组成、比例及流速对目标成分及内标响应大小、分离情况、峰型的影响。结果表明:以甲醇-水(45∶55,均含φ=0.1%甲酸)为流动相,流速为0.4 mL·min-1时,测试效果最佳。
3.2 内标的选择
橙皮苷、黄芩苷、异槲皮苷与柚皮苷、柚皮素结构相似,故选取上述3个化合物作为候选内标进行考察。结果表明:橙皮苷在空白血浆中有较大干扰;黄芩苷在挥干过程中易降解;而异槲皮苷空白干扰小,提取回收率稳定,基质效应影响小;故本研究选取异槲皮苷作为目标成分柚皮苷、柚皮素的内标。
3.3 样品处理方法的优化
本研究以10倍体积乙酸乙酯对血浆样品进行1次萃取,在有机相挥干后加入与血浆样品相同体积的流动相进行复溶,基质干扰小,提取回收率高。试验表明:与乙腈蛋白沉淀法相比,乙酸乙酯萃取法具有基质干扰小、重复性好的优点;乙酸乙酯体积增大对提取回收率的提高贡献不大,而萃取次数增多以及浓缩则会造成基质干扰变大、重现性降低。
3.4 β-葡萄糖醛酸酶孵育
柚皮苷在体内主要转化成苷元柚皮素,柚皮素经Ⅱ相代谢反应生成其在血浆中的主要代谢产物柚皮素-葡萄糖醛酸化/硫酸化结合物[6, 10]。药理研究表明,柚皮苷、柚皮素均具有显著疗效[11],因此同时测定两者在血浆中的质量浓度很有必要。本研究通过β-葡萄糖醛酸酶孵育来游离结合态的柚皮素,达到同时测定人血浆样品中柚皮苷、柚皮素质量浓度的目的。

表5 血浆样品的稀释可靠性与稳定性RSD /%(n=3)Table 5 RSD results of dilute reliability and stability in spiked samples/% (n=3)
3.5 结论
本研究建立了同时测定人血浆中柚皮苷、柚皮素的HPLC-MS/MS方法,采用一步液液萃取法处理血浆样品,具有操作简单、灵敏度好、准确性高、重现性好、提取回收率高等优点,适用于人体药动学试验中柚皮苷、柚皮素血浆质量浓度的测定。
[1] 李沛波,王永刚,吴忠,等. 以化橘红为基源的一类新药柚皮苷的临床前研究 [J]. 中山大学学报(自然科学版), 2015, 54(6):1-5. LI P B, WANG Y G, WU Z, et al. The pre-clinical studies of naringin, an innovative drug, derived fromCitrigrandisExocarpium (Huajuhong) [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2015, 54(6):1-5.
[2] GAO S, LI P B, YANG H L, et al. Antitussive effect of naringin on experimentally induced cough in Guinea pigs [J]. Planta Medica, 2011, 77(1):16-21.
[3] NIE Y C, WU H, LI P B, et al. Naringin attenuates EGF-induced MUC5AC secretion in A549 cells by suppressing the cooperative activities of MAPKs-AP-1 and IKKs-IkappaB-NF-kappaB signaling pathways [J]. European Journal of Pharmacology, 2012, 690(1):207-213.
[4] LIU Y, WU H, NIE Y C, et al. Naringin attenuates acute lung injury in LPS-treated mice by inhibiting NF-kappaB pathway [J]. International Immunopharmacology, 2011, 11(10): 1606-1612.
[5] CHEN Y, NIE Y C, LUO Y L, et al. Protective effects of naringin against paraquat-induced acute lung injury and pulmonary fibrosis in mice [J]. Food and Chemical Toxicology, 2013, 58(4):133-140.
[6] LIU M H, ZOU W, YANG C P, et al. Metabolism and excretion studies of oral administered naringin, a putative antitussive, in rats and dogs [J]. Biopharmaceutics and Drug Disposition, 2012, 33(3):123-134.
[7] WEN J, QIAO Y, YANG J, et al. UPLC-MS/MS determination of paeoniflorin, naringin, naringenin and glycyrrhetinic acid in rat plasma and its application to a pharmacokinetic study after oral administration of Si-Ni-San decoction [J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 66 (6):271-277.
[8] XIONG X, JIANG J J, DUAN J L, et al. Development and validation of a sensitive liquid chromatography-tandem mass spectrometry method for the determination of naringin and its metabolite, naringenin, in human plasma [J]. Journal of Chromatographic Science, 2014, 52(7):654-660.
[9] LI T X, HU L, ZHANG M M, et al. A sensitive UPLC-MS/MS method for simultaneous determination of eleven bioactive components of Tong-Xie-Yao-Fang decoction in rat biological matrices [J]. Journal of Chromatography B, 2014, 944:90-100.
[10] 孙国玲, 钱大玮, 段金廒,等. 大鼠灌胃毛橘红醇提物血浆中柚皮苷、柚皮素及其代谢产物液质分析 [J]. 中国中药杂志, 2010, 35(12):1580-1585. SUN G L, QIAN D W, DUAN J A, et al. UPLC-Q-TOF-MS analysis of naringin and naringenin and its metabolites in rat plasma after intragastrical administration of alcohol extract of exocarpiumCitrigrandis[J]. China Journal of Chinese Materia Medica, 2010, 35(12):1580-1585.
[11] LIN B Q, LI P B, WANG Y G, et al. The expectorant activity of naringenin [J]. Pulmonary Pharmacology and Therapeutics, 2008, 21(2):259-263.
HPLC-MS/MS method for simultaneous determination of naringin and naringenin in human plasma
ZENGXuan,SUWeiwei,BAIYang,PENGWei,YAOHongliang
(School of Life Sciences, Sun Yat-sen University; Guangdong Engineering & Technology Research Center for Quality and Efficacy Re-evaluation of Post-market Traditional Chinese Medicine, Guangzhou 510275, China)
The aim of the study was to establish an HPLC-MS/MS method for simultaneous determination of naringin and naringenin in human plasma. Naringin and naringenin were extracted from plasma by ethyl acetate, then determined by HPLC-MS/MS taking isoquercitrin as internal standard (IS). Chromatographic separation was carried out on a Agilent Poroshell 120 EC-C18column (3.0 mm×30 mm,2.7 μm). The mobile phase was composed of solvent A (0.1% formic acid,V/V) and B (methanol with 0.1% formic acid,V/V). The flow rate was 0.4 mL·min-1. Electrospray ionization (ESI) source was applied and operated in multiple reaction monitoring (MRM) mode with the transitions ofm/z579.1/270.8,m/z270.9/150.7,m/z463.1/299.8 for naringin, naringenin and IS, respectively. The method was validated over the concentration range of 0.251 0~100.4 ng·mL-1for naringin, and 0.503 0~201.2 ng·mL-1for naringenin, respectively. The intra- and inter-run precisions were within the acceptable range, and the extraction recoveries were satisfactory. The established method is highly sensitive, accurate and reproducible, which can be applied for the simultaneous determination of naringin and naringenin in human plasma.
human plasma; naringin; naringenin; HPLC-MS/MS
2016-05-05 基金项目:国家"重大新药创制"科技重大专项课题(2015ZX09101014);广东省应用型科技研发专项资金项目(2015B020234004)
曾璇(1993年生),男;研究方向:人体药代动力学;E-mail:zengx6@qq.con
姚宏亮(1988年生),男;研究方向:创新药物的研究开发;E-mail:yhlsysu@126.com
10.13471/j.cnki.acta.snus.2017.01.020
R965
A
0529-6579(2017)01-0125-06

