橘小实蝇半胱氨酸蛋白酶基因克隆及表达模式*
杨文佳,许抗抗,王进军,李灿
(1. 贵阳学院生物与环境工程学院//有害生物控制与资源利用贵州省高校特色重点实验室,贵州 贵阳 550005;2. 西南大学植物保护学院//昆虫学及害虫控制工程重庆市市级重点实验室,重庆 400716)
橘小实蝇半胱氨酸蛋白酶基因克隆及表达模式*
杨文佳1,2,许抗抗1,2,王进军2,李灿1
(1. 贵阳学院生物与环境工程学院//有害生物控制与资源利用贵州省高校特色重点实验室,贵州 贵阳 550005;2. 西南大学植物保护学院//昆虫学及害虫控制工程重庆市市级重点实验室,重庆 400716)
为了深入了解半胱氨酸蛋白酶基因的作用和寻求害虫防治新的分子靶标,利用RT-PCR和RACE技术,从橘小实蝇Bactroceradorsalis(Hendel)体内克隆获得半胱氨酸蛋白酶基因Bdcyp的cDNA全长序列(GenBank登录号:KU904503),采用生物信息学软件分析了Bdcyp编码蛋白的特性,利用实时定量PCR技术检测其在不同发育阶段和不同组织的表达量。橘小实蝇Bdcyp的cDNA全长为1 955 bp,开放阅读框为1 653 bp,编码551个氨基酸,预测蛋白质相对分子质量和等电点分别为62 900和6.11。Bdcyp具有半胱氨酸蛋白酶的典型特征,即信号肽、3个催化活性区域(Cys-His-Asn)以及2个保守的ERFNIN和GNFD特征基序。系统发育分析表明Bdcyp编码的蛋白质与橄榄实蝇半胱氨酸蛋白酶亲缘关系最近。Bdcyp在三龄幼虫、蛹和成虫期均有表达,其在蛹中期的表达量最高;表达部位主要在幼虫脂肪体,其次为气管和表皮,而在中肠的表达量最低。这些结果为进一步研究Bdcyp基因功能提供了依据。
橘小实蝇;半胱氨酸蛋白酶;克隆;序列分析;表达模式
半胱氨酸蛋白酶(cysteine proteinase,cyp)广泛存在于微生物、植物和动物等生物体内,它主要在细胞内和外蛋白降解中发挥着关键的作用[1-2]。半胱氨酸蛋白酶分为3个结构家族:木瓜蛋白酶、ICE/CED3型蛋白酶类和天冬酰胺特异性内肽酶家族,其中木瓜蛋白酶家族是最大的一个家族[1]。溶酶体半胱氨酸蛋白酶(Cathepsin,Cat)是木瓜蛋白酶家族的重要部分,目前已在人类和哺乳动物中发现11种。根据其分子特征和底物特异性,可分为Cat B、C、F、H、K、L、O、S、V、W和X型。Cat具有多种多样的生物学功能,它不仅参与体内蛋白质的水解,还可以参与骨质吸收、抗原呈递、组织再生、肿瘤入侵和转移以及细胞凋亡等生理活动[3-5]。
迄今为止,在昆虫中发现B、L、D、O和T等多种类型的半胱氨酸蛋白酶,其中常见的为Cat B、L和D型。在昆虫体内,半胱氨酸蛋白酶的生理功能并不局限在溶酶体内蛋白质的降解[6-8],近年来研究发现它还参与了昆虫的个体发育过程,可以调节卵母细胞发生和早期胚胎发育[9-10],并在昆虫变态过程中组织的解体和重建起着重要作用[11-12]。此外,部分蛋白酶与昆虫的长期记忆和种群防御等紧密相关[13-14]。
橘小实蝇Bactroceradorsalis(Hendel),隶属双翅目Diptera,实蝇科Tetriphitedae,由于极强的环境适应能力和入侵扩散能力,严重危害多种重要的水果和蔬菜,已成为重要的世界性农业害虫[15-16]。由于人们长期、大量使用化学农药防治橘小实蝇,不可避免地导致其对杀虫剂产生了不同程度的抗性,防治难度不断增加[17-18]。因此,探索新的靶标、开发新型控制剂是发展橘小实蝇防治策略的当务之急。以往研究表明半胱氨酸蛋白酶在昆虫生长发育过程中起着重要作用,并考虑作为害虫防治的靶蛋白[6, 19]。因此,本研究在转录组测序的基础上,利用RACE技术首次从橘小实蝇体内克隆获得Bdcysp的全长基因,并对其进行生物信息学分析,同时研究了其在不同发育阶段和不同组织的时空表达特性,为进一步揭示该基因的生理功能提供基础数据,也为其作为害虫防治的潜在靶标基因奠定基础。
1 材料与方法
1.1 供试昆虫与样品收集
橘小实蝇于2007年采自福建省福州市,利用人工饲料在人工气候箱内连续饲养多代并建立种群。饲养条件为温度(27±1) ℃、相对湿度(70 ±5)%、光周期14 L∶10D。分别收集不同日龄的橘小实蝇三龄幼虫、蛹和新羽化成虫;选取发育整齐的三龄第4天的幼虫,通过解剖获得表皮、气管、中肠、脂肪体和马氏管5个组织。将所有样品经液氮速冻后于-80 ℃冰箱内保存备用,每组样品设置3个生物学重复。
1.2 主要试剂
TRIzol购自Invitrogen公司;DNase、rTaq酶和PrimeScript®RT Reagent Kit购自TaKaRa公司;SMARTerTMRACE cDNA Amplification Kit购自Clontech公司;Gel Extraction Kit购自Omega公司;感受态细胞DH5α购自北京全式金公司;pGEM-T Easy载体和GoTaq®qPCR Master Mix购自Promega公司。
1.3 试验方法
1.3.1 总RNA的提取与第一链cDNA的合成 按照TRIzol试剂说明书分别提取橘小实蝇不同发育阶段和不同组织的总RNA,利用琼脂糖电泳检测总RNA的完整性,通过Nanodrop 2000核酸浓度测定仪检测其浓度和纯度,并利用DNase去除基因组DNA。取新羽化成虫的RNA为模板,分别按照SMARTerTMRACE cDNA Amplification Kit和PrimeScript®RT Reagent Kit说明书合成第一链cDNA,用于RACE扩增和全长验证PCR模板制备。所有样品按照PrimeScript®RT Reagent Kit说明书合成第一链cDNA,用于实时定量PCR模板制备。
1.3.2 引物设计与合成 根据笔者之前测序完成的橘小实蝇脂肪体转录组数据库[20],筛选半胱氨酸蛋白酶基因片段,采用Primer Premier 5.0软件设计相关引物(表1)用于Bdcyp基因的RACE和开放阅读框扩增,引物合成由上海生工生物工程股份有限公司完成。
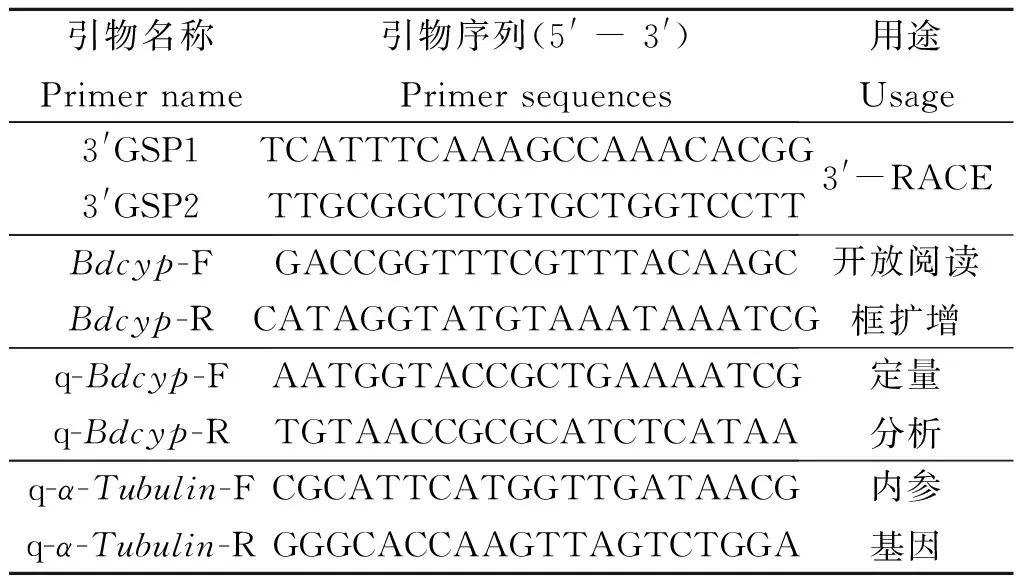
表1 本研究中涉及的引物信息Table 1 Primers used in this study
1.3.3 基因克隆 以1.3.1合成的cDNA为模板,利用相应的特异性引物进行PCR扩增。PCR反应体系,包含2.5 μL 10×PCR缓冲液,2.5 μL MgCl2(25 μmol/L),2 μL dNTPs (10 nmol/L),正/反向引物(10 μmol/L)各1 μL,2.0 μL cDNA模板,0.25 μL rTaq酶,ddH2O补足至25 μL,混匀,离心,放入PCR仪扩增。PCR反应条件为:95 ℃预变性4 min,然后95 ℃ 变性30 s,55~65 ℃退火30 s,72 ℃延伸1~2 min,34个循环,最后72 ℃延伸10 min。PCR产物经w=1.5%琼脂糖凝胶电泳鉴定后,将目的条带切胶回收,按照Gel Extraction Mini Kit说明书操作,然后将回收产物连接至pGEM-T Easy载体,转化到感受态大肠杆菌中,经蓝白筛选和PCR鉴定,将阳性克隆送往北京六合华大基因公司进行测序。
1.3.4 序列分析 利用DNAMAN v6.0(Lynnon Biosoft)软件完成测序结果的编辑和分析,推导的氨基酸采用NCBI站点的BLAST(http://www.ncbi.nlm.gov/BLAST/)程序进行同源性比较分析。利用ProtParam(http://web.expasy.org/)、SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)和NetNGlys 1.0 server(http://www.cbs.dtu.dk/services/NetNGlyc/)分析编码蛋白的理化性质、信号肽和N-糖基化位点。利用Scanprosite(http://prosite.expasy.org/scanprosite/)分析保守区域。利用MEGA5.04软件中的邻接法(Neighbor-joining)构建系统发育树[21],各分支重复检验次数均为1 000。
1.3.5Bdcyp表达模式分析 采用实时定量PCR技术检测橘小实蝇Bdcyp基因在不同发育阶段和不同组织的相对表达量。使用在线软件Primer 3.0(http://frodo.wi.mit.edu/)设计定量PCR引物,内参基因采用橘小实蝇α-Tubulin(GenBank登录号:GU269902)[22],引物序列信息如表1。定量PCR反应体系如下:10 μL GoTaq®qPCR Master Mix、1 μL cDNA、7 μL ddH2O和正/反向引物各1 μL。扩增反应在CFX96TMReal-Time System 实时定量PCR仪(Bio-Rad)中进行,反应条件为:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火并延伸30 s,共40个循环;接着60~95 ℃的熔解曲线。每个样品重复测定3次。利用2-△△CT方法计算目的基因的相对表达量[23],试验数据采用SPSS17.0软件的单因素方差分析法(ANOVA)进行差异显著性分析。
2 结果与分析
2.1 橘小实蝇Bdcyp基因cDNA的序列分析
采用RT-PCR结合RACE技术,克隆获得橘小实蝇半胱氨酸蛋白酶基因,命名为Bdcyp(GenBank登录号:KU904503),其cDNA序列全长1 955 bp,包含5′端非编码区142 bp和3′端非编码区160 bp,开放阅读框为1 653 bp,编码551个氨基酸残基,预测相对分子质量为62 900,理论等电点pI值为6.11。Bdcyp编码的蛋白N末端具有20个氨基酸组成的信号肽序列,推测其可能为分泌型蛋白。根据NetNGlyc 1.0 server分析结果,Bdcyp可能存在3个N-糖基化位点,分别N102,N435和N447。Bdcyp具有昆虫半胱氨酸蛋白酶基因家族特有的保守结构域:催化三联体(Cys356、His499、Asn519)、ERFNIN基序、GNFD基序以及结构花样G396C397D398G399G400簇(图1)。
将Bdcyp编码的氨基酸序列进行BLAST分析,结果表明,Bdcyp与同为双翅目的橄榄实蝇Bactroceraoleae(GenBank登录号:XP_014098451)半胱氨酸蛋白酶的同源性最高,为96%;与地中海实蝇Ceratitiscapitata(XP_004522056)、铜绿蝇Luciliacuprina(KNC23990)以及埃及伊蚊Aedesaegypti(ABE72972)的相似性分别为92%、87%和67%,进一步表明克隆得到的是橘小实蝇半胱氨酸蛋白酶基因。
2.2 Bdcyp的系统发育分析
将Bdcyp编码的氨基酸序列与GenBank登录的其他昆虫的半胱氨酸蛋白酶氨基酸序列进行比对,并通过MEGA5.04软件中的邻接法构建系统发育树。结果表明,橘小实蝇Bdcyp与橄榄实蝇B.oleae半胱氨酸蛋白酶的亲缘关系最近,且聚为一支(图2)。各目的昆虫均单独成一支,与传统上的分类关系一致,说明昆虫半胱氨酸蛋白酶在进化上具有较好的保守性。

图1 橘小实蝇Bdcyp基因的cDNA序列及推导的氨基酸序列起始密码子ATG和终止密码子TAA加粗;*表示终止密码子;下划线为信号肽序列;双下划线为糖基化位点;催化三联体用方框表示;黑色底纹的为保守结构域(ERFNIN、GNFD和GCDGG)Fig.1 The cDNA and deduced amino acid sequence of Bdcyp in Bactrocera dorsalis The start codon is indicated with bold and the stop codon is indicated with bold and an asterisk. The predicated signal peptide is underlined. N-linked glycosylation is double underlined. Putative catalytic triad is boxed. Three conserved motifs of ERFNIN, GNFD and GCDGG are in white with blackground
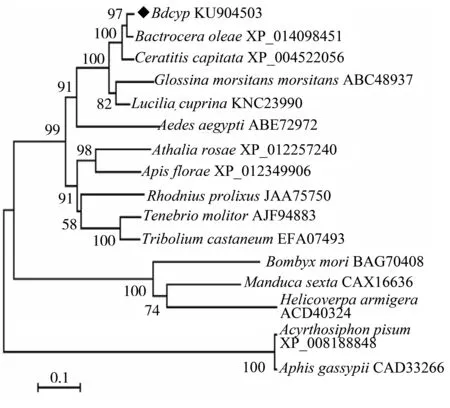
图2 橘小实蝇Bdcyp系统发育分析Fig.2 Phylogenetic relationships analysis of Bdcyp of B. dorsalis

图3 橘小实蝇Bdcyp在不同发育阶段的相对表达量通过实时定量PCR检测三龄幼虫、蛹和成虫的16个不同时间点的表达量;3L1:三龄第1天幼虫;P1:第1天蛹;A1:第1天成虫;柱上不同字母代表显著性差异(单因素方差,P < 0.05)Fig.3 Relative expression level of Bdcyp in different developmental stages of B. dorsalisExpression levels at 16 different time points in third-instar larvae, pupae and adults were detected by qPCR. Different letters above bars indicate significant difference at the 0.05 level (one-way ANOVA)
2.3Bdcyp在橘小实蝇不同发育阶段的表达模式
采用实时定量PCR方法检测Bdcyp在橘小实蝇不同发育阶段的表达情况。结果显示,Bdcyp在橘小实蝇三龄幼虫、蛹期和成虫期均有表达(图3)。从三龄幼虫到成虫的发育过程中,Bdcyp的表达量呈现先升高后降低的趋势,蛹期第5天Bdcyp基因mRNA表达量显著高于其他时期(P< 0.05),说明Bdcyp可能主要在这一时期发挥作用。
2.4Bdcyp在橘小实蝇不同组织间的表达模式
采用实时定量PCR方法检测Bdcyp在橘小实蝇三龄第4天幼虫5个不同组织的表达情况。结果显示,Bdcyp在脂肪体的表达量显著高于其他4个组织(P<0.05),在表皮和气管中表达次之,而在马氏管和中肠的表达量较低(图4)。
3 讨 论
半胱氨酸蛋白酶参与昆虫体内的食物消化[6-8]、变态发育[9-12]、种群防御[13-14]等生理过程,在昆虫生命活动中发挥着重要作用。干扰半胱氨酸蛋白酶的生理功能,将会对目标害虫的活动和发育造成直接影响,导致其生理机能受到严重阻碍而死亡。因此,深入研究昆虫半胱氨酸蛋白酶将为开发新型杀虫剂提供潜在靶标。近年来昆虫半胱氨酸蛋白酶的分子研究受到关注,包括埃及伊蚊A.aegypti[24]、黑腹果蝇Drosophilamelanogaster[25]、刺舌蝇Glossinamorsitansmorsitans[26]、棉铃虫Helicoverpaarmigera[19]、黄粉虫Tenebriomolitor[27]、麦杆蝇Deliacoarctata[28]等多种昆虫的半胱氨酸蛋白酶基因的结构和功能得到了鉴定。本研究以重要的农业害虫橘小实蝇为研究对象,采用RT-PCR和RACE技术克隆获得Bdcyp基因的cDNA全长。同源性比对分析结果表明,Bdcyp编码的氨基酸序列与其他已知昆虫的半胱氨酸蛋白酶具有较高的一致性,均在60%以上。Bdcyp具有半胱氨酸蛋白酶的典型特征,包括信号肽、催化三联体以及两个保守的ERFNIN和GNFD特征基序,说明不同昆虫的半胱氨酸蛋白酶结构高度保守。
在昆虫中,半胱氨酸蛋白酶在不同发育阶段的表达量存在很大的差异,说明其在生长发育过程中发挥着不同的作用。棉铃虫Har-CL在幼虫5~6龄蜕皮前表达量显著升高,而后快速下降,然后在化蛹前再次升高,说明Har-CL在幼虫发育期间被严格调控[19]。甘蓝地种蝇DeliaradicumDrCP1在整个发育时期均有表达,包括卵、幼虫、蛹和成虫,但在幼虫-蛹转化期的表达量明显升高,说明该基因可能与幼虫变态化蛹有关[19]。另外,半胱氨酸蛋白酶在昆虫胚胎时期、生殖过程中发挥着重要作用[7,30]。本研究发现,Bdcyp在橘小实蝇不同发育阶段均有表达,主要集中在蛹期高表达,而在其他时期的表达量较低。基于半胱氨酸蛋白酶在变态发育方面的重要作用,推测Bdcyp在蛹中期的高表达与这一时期的主要生命活动密切相关。我们对橘小实蝇不同日龄的蛹进行解剖观察,发现化蛹后1~2 d其体内组织出现溶离、解体的现象;化蛹后第5天成虫形态初现,随后虫体上的覆盖物消失并羽化为成虫,而这一时期Bdcyp的表达量有明显的提升,因此推测Bdcyp在蛹期的组织重建和羽化过程中起着重要作用。
生物体内基因的表达规律与其所具有的功能有着密切的联系,研究发现昆虫半胱氨酸蛋白酶基因的表达具有组织特异性。已有多数研究表明,消化器官如肠道是半胱氨酸蛋白酶基因表达的主要场所,包括黑腹果蝇D.melanogaster[25]、刺舌蝇G.morsitansmorsitans[26]、豌豆蚜Acyrthosiphonpisum[8],它们是重要的消化蛋白酶。Matsumoto等[7]发现玉米象鼻虫Sitophiluszeamais半胱氨酸蛋白酶基因在生殖器官,如卵母细胞和滋养层中有较高的表达,推测其可能在胚胎发育过程中起着重要作用。通过免疫组化技术对半胱氨酸蛋白酶在家蚕Bombyxmori卵中的分布进行了定位分析,发现其与卵黄蛋白的降解相关[31]。此外,目前还发现的半胱氨酸蛋白酶的合成部位还有昆虫的脂肪体以及血淋巴中的血细胞[24,32]。本研究发现Bdcyp在橘小实蝇的幼虫脂肪体中表达量最高,而脂肪体在双翅目蜕皮变态过程中发生解离,推测Bdcyp可能参与幼虫组织的解离等。本研究仅从mRNA水平上检测了半胱氨酸蛋白酶基因在橘小实蝇体内的表达情况,尚未涉及蛋白水平的表达及功能鉴定。根据本研究获得的Bdcyp全长基因结构及在不同发育时期和不同组织的表达量情况,推测该基因在组织重建和蜕皮变态中发挥着重要作用,下一步将研究该基因在橘小实蝇变态发育过程中的作用,为基于Bdcyp的分子靶标的研发提供理论参考。
[1] BERTI P J, STORER A C. Alignment/Phylogeny of the papain superfamily of cysteine proteases [J]. Journal of Molecular Biology, 1995, 246(2): 273-283.
[2] CHAPMAN H A, RIESE R J, SHI G P. Emerging roles for cysteine proteases in human biology [J]. Annual Review of Physiology, 1997, 59(1): 63-88.
[3] ISAHARA K, OHSAWA Y, KANAMORI S. Regulation of a novel pathway for cell death by lysosomal aspartic and cysteine proteinases [J]. Neuroscience, 1999, 91(1): 233-349.
[4] CHERNAYA V I. Early postnatal development-related dynamics of the activity of cathepsin L in rat brain structures [J]. Neurophysiology, 2001, 33(1): 15-18.
[5] BARROS N M, PUZER L, TERSARIOL I L, et al. Plasma prekallikrein/kallikrein processing by lysosomal cysteine proteases [J]. Biological Chemistry, 2004, 385(11): 1087-1091.
[6] BOLTER C, JONGSMA M A. The adaptation of insects to plant protease inhibitors [J]. Journal of Insect Physiology, 1997, 43(10): 885-895.
[7] MATSUMOTO I, EMORI Y, ABE K, et al. Characterization of a gene family encoding cysteine proteinases ofSitophiluszeamais(maize weevil), and analysis of the protein distribution in various tissues including alimentary tract and germ cells [J]. Journal of Biochemistry, 1997, 121(3): 464-476.
[8] CRISTOFOLETTI P T, RIBERIO A F, DERAISON C, et al. Midgut adaption and digestive enzyme distribution in a phloem feeding insect, the pea aphidAcyrthosiphonpisum[J]. Journal of Insect Physiology, 2003, 49(1): 11-24.
[9] UCHIDA K, OHMORI D, UENO T, et al. Preoviposition activation of cathepsin-like proteinase in degenerating ovarian follicles of the mosquitoCulexpipienspallens[J]. Developmental Biology, 2001, 237(1): 68-78.
[10] ZHAO X F, AN X M, WANG J X, et al. Expression of theHelicoverpacathepsin B-like proteinase during embryonic development [J]. Archives of Insect Biochemistry and Physiology, 2005, 58(1): 39-46.
[11] SHIBA H, UCHIDA K, KOBAYASHI H, et al. Involvement of cathepsin B and L-like proteinases in silk gland histolysis during metamorphosis ofBombyxmori[J]. Archives of Biochemistry and Biophysics, 2001, 390(1): 28-34.
[12] RABOSSI A, STOKA V, PUIZDAR V, et al. Novel aspartyl proteinase associated to fat body histolysis duringCeratitiscapitataearly metamorphosis [J]. Archives of insect Biochemistry and Physiology, 2004, 57(2): 51-67.
[13] COMAS D, PETIT F, PREAT T.Drosophilalong-term memory formation involves regulation of cathepsin activity [J]. Nature, 2004, 430(6998): 460-463.
[14] KUTSUKAKE M, SHIBAO H, NIKOH N, et al. Venomous protease of aphid soldier for colony defense [J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(31): 11338-11343.
[15] CLARKE A R, ARMSTRONG K F, CARMICHAEL A E, et al. Invasive phytophagous pests arising through a recent tropical evolutionary radiation: theBactroceradorsaliscomplex of fruit flies [J]. Annual Review of Entomology, 2005, 50(1): 293-319.
[16] 李伟丰, 杨朗, 唐侃, 等. 中国桔小实蝇种群的微卫星多态性分析 [J]. 昆虫学报, 2007, 50(12): 1255-1262. LI W F, YANG L, TANG K, et al. Microsatellite polymorphism ofBactroceradorsalis(Hendel) populations in China [J]. Acta Entomologica Sinica, 2007, 50(12): 1255-1262.
[17] JIN T, ZENG L, LIU Y Y, et al. Insecticide resistance of the oriental fruit fly,Bactroceradorsalis(Hendel) (Diptera: Tephritidae), in mainland China [J]. Pest Management Science, 2011, 67(3): 370-376.
[18] WANG L L, HUANG Y, LU X P, et al. Overexpression of two α-esterase genes mediates metabolic resistance to malathion in the oriental fruit fly,Bactroceradorsalis(Hendel) [J]. Insect Molecular Biology, 2015, 24(4): 467-479.
[19] LIU J, SHI G P, ZHANG W Q, et al. Cathepsin L function in insect molting: molecular cloning and functional analysis in the cotton boll worm,Helicoverpaarmigera[J]. Insect Molecular Biology, 2006, 15(6): 823-834.
[20] YANG W J, YUAN G R, CONG L, et al.Denovocloning and annotation of genes associated with immunity, detoxification and energy metabolism from the fat body of the oriental fruit fly,Bactroceradorsalis[J]. PLoS ONE, 2014, 6: e94470.
[21] TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739.
[22] SHEN G M, JIANG H B, WANG X N, et al. Evaluation of endogenous references for gene expression profiling in different tissues of the oriental fruit flyBactroceradorsalis(Dipter: Tephritidae) [J]. BMC Molecular Biology, 2010, 11(214): 1982-1995.
[23] LIVAL K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J]. Methods, 2001, 25(4): 402-408.
[24] CHO W L, TSAO S M, HAYS A R, et al. Mosquito cathepsin B-like protease involved in embryonic degradation of vitellin is produced as a latent extraovarian precursor [J]. Journal of Biological Chemistry, 1999, 274(19): 13311-13321.
[25] MATSUMOTO M, WATANABE H, ABE K, et al. A putative digestive cysteine proteinase fromDrosophilamelanogasteris predominantly expressed in the embryonic and larval midgut [J]. European Journal of Biochemistry, 1995, 227(1/2): 582-587.
[26] YAN J, CHENG Q, LI C B, et al. Molecular characterization of three gut genes fromGlossinamorsitansmorsitans: cathepsin B, zinc-metallorptease and zinc-carboxypeptidase [J]. Insect Molecular Biology, 2002, 11(1): 57-65.
[27] BETON D, GUZZO C R, RIBEIRO A F, et al. The 3D structure and function of digestive cathepsin L-like proteinases ofTenebriomolitorlarval midgut [J]. Insect Biochemistry and Molecular Biology, 2012, 42(9): 655-664.
[28] PYATI P S, BELL H A, FITCHES E, et al. Cathepsin L-like cysteine proteinase (DcCathL) fromDeliacoarctata(wheat bulb fly): basis of insecticidal activity [J]. Insect Biochemistry and Molecular Biology, 2009, 39(8): 535-546.
[29] HEGEDUS D, O’GRADY M, CHAMANKHAH M, et al. Changes in cysteine protease activity and localization during midgut metamorphosis in the crucifer root maggot (Deliaradicum) [J]. Insect Biochemistry and Molecular Biology, 2002, 32(11): 1585-1596.
[30] YAMAMOTO Y, TAKAHASHI S Y. Cysteine proteinase fromBombyxeggs: role in programmed degradation of yolk proteins during embryogenesis [J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1993, 106(1): 35-45.
[31] YAMAMOTO Y, TAKIMOTO K, IZUMI S, et al. Molecular cloning and sequencing of cDNA that encodes cysteine proteinase in the egg of the silk worm,Bombyxmori[J]. Journal of Biochemistry, 1994, 116(6): 1330-1335.
[32] KURATA S, SAITO H, NATORI S. Purification of a 29-kDa hemocyte proteinase ofSarcophagaperegrina[J]. European Journal of Biochemistry, 1992, 204(2): 911-914.
Molecular cloning and expression profiling of a cysteine proteinase gene in the oriental fruit flyBactroceradorsalis(Hendel)
YANGWenjia1, 2,XUKangkang1, 2,WANGJinjun2,LICan1
(1. Key & Special Laboratory of Guizhou High College for Pest Control and Resource Utilization ∥ College of Biology and Engineering of Environment, Guiyang University, Guiyang 550005, China; 2. Key Laboratory of Entomology and Pest Control Engineering ∥ College of Plant Protection, Southwest University, Chongqing 400716, China)
In order to better understand the roles of cysteine proteinase gene and develop a novel molecular target for insect pest control, we obtained the full-length cDNA sequence ofBdcyp(GenBank accession no. KU904503) from the oriental fruit fly,Bactroceradorsalis(Hende) by using RT-PCR and RACE methods. The deduced amino acid sequence analysis ofBdcypwas performed by using bioinformatics methods. The expression patterns ofBdcypin different stages and tissues were investigated using quantitative real-time PCR (qPCR). TheBdcypwas 1 955 bp in lenght, containing an open reading frame of 1 653 bp which encodes 551 amino acid residues with a predicated molecular weight of 62 900 and isoelectric point of 6.11. Bdcyp had typical features of cysteine proteinase, including signal peptide, three catalytic active regions (Cys-His-Asn), and two conserved motifs (ERFNIN and GNFD). Phylogenetic analysis showed that Bdcyp has the closest genetic relationship with the cysteine proteinase ofB.oleae.Bdcypwas constitutively expressed in the tested stages, including third-instar larvae, pupae and adults. The highest expression level was observed at the middle of pupal stage. Tissue-specific expression showed that the highest expression was in the fat body, followed by trachea and integument, and the expression in midgut was the lowest. The results provide the basis for further studying the function ofBdcyp.
Bactroceradorsalis; cysteine proteinase; cloning; sequence analysis; expression pattern
2016-04-22 基金项目:贵州省特色重点学科基金(ZDXK[2015]11);贵阳学院高层次人才科研启动费(校人才2014003);中央高校基本科研业务费专项资金(XDJK2013A017);贵州省高层次创新型人才培养(黔科合人才[2016]4020)
杨文佳(1986年生),男;研究方向:昆虫分子生态学;E-mail: yangwenjia10@126.com
李灿(1979年生),男;研究方向:昆虫生态与害虫综合治理;E-mail:lican790108@163.com
10.13471/j.cnki.acta.snus.2017.01.021
Q78
A
0529-6579(2017)01-0131-07

