杜鹃花总黄酮对缺血/再灌注损伤模型大鼠脑基底动脉TRPV4的作用研究
韩 军,程小龙,胡坤媚,徐杭杭,陈志武
(1. 皖南医学院基础医学院药理学教研室,国家中医药管理局中药药理三级实验室,安徽 芜湖 241002;2. 安徽医科大学基础医学院药理学教研室,安徽 合肥 230031)
杜鹃花总黄酮对缺血/再灌注损伤模型大鼠脑基底动脉TRPV4的作用研究
韩 军1,程小龙1,胡坤媚1,徐杭杭1,陈志武2
(1. 皖南医学院基础医学院药理学教研室,国家中医药管理局中药药理三级实验室,安徽 芜湖 241002;2. 安徽医科大学基础医学院药理学教研室,安徽 合肥 230031)
目的 探讨杜鹃花总黄酮(TFR)对缺血/再灌注损伤模型大鼠脑基底动脉(CBA)瞬时感受器电位通道香草酸受体亚型Ⅳ(TRPV4)的作用。方法 以改良四血管阻断法(4-VO)建立大鼠缺血/再灌注模型(IR);运用加压灌注法和细胞膜电位记录法,离体观察TFR对KCl预收缩IR大鼠CBA的舒张作用和超极化反应及TRPV4阻断剂钌红(RR)对其的影响;采用实时荧光定量PCR法和蛋白质印迹法,在体观察TFR对IR大鼠脑血管内皮细胞TRPV4 mRNA和蛋白表达以及RR对其的影响。结果 递增浓度的TFR可诱导IR大鼠离体CBA产生明显剂量依赖性的舒张效应和超极化反应。去除血管内皮细胞后,TFR仍能介导CBA产生较弱的舒张作用和超极化反应,与血管内皮完整组比较,差异有显著性(P<0.01);去除一氧化氮(NO)和前列环素(PGI2)舒张作用后,TFR仍能诱导IR大鼠CBA产生明显的舒张效应和超极化作用,此作用可被TRPV4通道阻断剂RR抑制;TFR可明显上调IR大鼠脑血管TRPV4 mRNA和蛋白表达,而阻断TRPV4可明显抑制TFR上调的TRPV4基因表达。结论 TFR能介导IR大鼠CBA产生较强的内皮依赖性和较弱的内皮非依赖性血管舒张反应和超极化作用,其内皮依赖性效应推测可能与TFR促使脑血管内皮激活,促进内皮细胞生成和释放内皮衍生性超极化因子(EDHF)增多,继而激活TRPV4,引发Ca2+内流,导致血管平滑肌细胞膜超极化,产生血管舒张效应有关。
杜鹃花总黄酮;缺血/再灌注损伤;脑基底动脉;超极化作用;血管舒张效应;内皮衍生性超极化因子;瞬时感受器电位通道香草酸受体亚型Ⅳ
缺血性脑卒中是脑动脉血栓形成或栓塞导致血流短暂或持续减少,引起的以脑组织缺血缺氧、萎缩坏死等脑部缺血性损伤症状为主要临床表现的疾病,是导致人类死亡的三大疾病之一。其病理分子机制尚不明了,临床治疗效果不理想,深入探索其病理机制,寻求抗缺血性脑卒中新药是国内外医药界关注的热点之一。
在血管舒张反应过程中,血管内皮衍生性超极化因子(endothelium-derived hyperpolarizing factor,EDHF)是继一氧化氮(nitric oxide,NO)、前列环素(prostacycline,PGI2)之后,在内皮释放的第三类舒血管因子[1]。瞬时感受器电位通道香草酸受体亚型Ⅳ(transient receptor potential vanilloid receptor 4,TRPV4)存在于脑血管内皮细胞、平滑肌、神经元及胶质细胞上,能被机体内外环境多种理化刺激所激活,激活后可促使Ca2+内流,对机体完成多种生理功能和疾病病理发展具有重要意义[2]。
杜鹃花总黄酮(total flavones of rhododendra, TFR)是从杜鹃花中提取的黄酮类物质,包含金丝桃苷、芦丁、映山红素及槲皮素等主要成分[3]。研究已证实TFR具有减轻脑水肿,降低脑梗死面积,减少缺氧复氧损伤神经元内Ca2+,保护神经元等抗脑缺血损伤作用[4]。但TFR能否介导缺血性脑损伤大鼠脑基底动脉(cerebral basilar artery, CBA)产生EDHF效应及TRPV4对其作用的影响,鲜见文献报道。本研究以全脑缺血/再灌注(ischemia/reperfusion, IR)大鼠为实验对象,探讨IR 对CBA血管内皮TRPV4功能的影响及TFR诱导CBA产生舒张效应与TRPV4的关系,以期探寻缺血性脑卒中发病的细胞分子机制和防治新策略。
1 材料与仪器
1.1 实验动物 8周龄SD大鼠,♂,体质量220~260 g,由南京市江宁区青龙山动物繁殖场提供[批号:SCXK(沪)2013-0006]。大鼠适应性喂养1周,室温(23±2)℃,相对湿度55%~60%,自然光照,动物自由饮水与进食。
1.2 药品与试剂 TFR(总黄酮含量≥85%),安徽省合肥市合源医药科技有限公司;左旋硝基精氨酸甲酯(N-nitro-L-arginine-methyl-ester,L-NAME)(批号:S0006)、BCA蛋白浓度测定试剂盒(P0010S)、内参GAPDH抗体(批号:AG019)、二抗(兔IgG、鼠IgG),碧云天生物技术研究所产品;吲哚美辛(indomethacin,Indo)(批号:N5751)、TRPV4阻断剂钌红(ruthenium red,RR,批号:R2751)及TRPV4抗体(批号:SAB2104243),美国Sigma公司产品; RT逆转录试剂盒(批号:RR037A)及SYBR-Green荧光定量试剂盒(批号:RR420A),日本TaKaRa公司产品。
1.3 仪器 多通道快速微量加药系统(MPS-2型),华中科大仪博生命科学仪器有限公司;奥林巴斯显微镜,日本OLYMPUS公司;MO-81微电极推进器,日本 Narishige公司;玻璃电极拉制仪,美国MDI公司;Intra 767 微电极放大器,美国WPI 公司;Model 550 酶标仪、Mini PROTEAN电泳系统及Mini PROTEAN转膜系统,美国Bio-Rad公司;逆转录PCR仪及实时荧光定量PCR仪,美国ABI公司。
2 方法
2.1 改良四血管阻断法(four-vessel occlusion,4-VO)建立大鼠IR模型[5]10%水合氯醛(330 mg·kg-1)注射麻醉大鼠,分离出两侧颈总动脉,放置丝线备用。颈背部皮肤切开暴露出第一颈椎双侧翼小孔,用电凝针(直径0.5 mm)电凝两侧椎动脉使其永久闭合,缝合切口,待动物清醒回笼饲养。术后24 h,夹闭两侧颈总动脉25 min,造成全脑缺血。之后再同时松开双侧动脉夹,使脑血流再灌注2 h。模型建立成功标志为大鼠翻正反射消失,自主呼吸存在,瞳孔变灰白及脑电波变低平。术中及术后保持肛温37 ℃。假手术组不夹闭两侧颈总动脉,不电凝两侧椎动脉。
2.2 加压灌注法测定离体脑血管舒缩功能 大鼠快速断头取脑,在冰浴生理盐溶液中分离出CBA,制成血管环片段放置灌流浴槽中,将微玻璃管套入血管环两端,用手术线将其固定。接着用生理盐溶液(含95% O2+5% CO2混合气体,37 ℃,pH 7.4)加压灌注(灌注压11.305 kPa,流量150 μL·min-1)CBA血管内腔与浴槽中的血管腔外侧。在体视显微镜下,观察与记录CBA直径的大小,以血管直径的变化反映CBA舒缩功能的变化。血管舒张率/%=(Dx-Dmin)/(Dmax-Dmin)×100%。Dx为加入各受试药物后的直径;Dmin为加入收缩剂后收缩稳定时的直径;Dmax为血管平衡1 h 时的直径。
通过机械法,用一根细头发丝在CBA血管腔内来回摩擦去除IR大鼠CBA内皮细胞[3]。
2.3 细胞膜电位记录法测定血管平滑肌细胞静息膜电位[5]大鼠快速断头取脑取出CBA,在倒置显微镜下将血管段纵向剖开固定在灌流槽中,血管内面向上,持续灌流生理盐溶液(含95% O2+5% CO2混合气体,37 ℃),温育1 h后,再往灌流液中加入相应的溶媒或药物温育0.5 h。在体视显微镜下,用微操纵器将玻璃微电极(电阻30~50 MΩ,3 mol·L-1KCl)推至血管表面,并穿刺细胞。细胞电信号经微电极放大器放大后,输入至Powerlab/4sp 型计算机信号采集系统,记录血管平滑肌细胞的静息膜电位。如果静息膜电位负值进一步加大,则表示出现平滑肌细胞膜电位的超极化现象。
2.4 实时荧光定量PCR法检测大鼠脑血管内皮细胞TRPV4 mRNA的表达 ♂大鼠40只,随机分为5组:Sham组、IR组、TFR用药组(100 mg·kg-1)、100 mg·kg-1TFR + 2 mg·kg-1TRPV4通道阻断剂RR组、RR组(2 mg·kg-1)。各组于缺血前20 min尾静脉注射相应受试药物。严格按照TRIzol试剂盒提取各组大鼠脑血管总RNA,并参照逆转录说明书进行cDNA合成(逆转录反应条件为:37℃ 15 min、85℃ 5 s、4℃ 2 h)。其PCR扩增条件为:95℃变性30 s,95℃退火5 s,60℃延伸31 s,反应共40个循环。以GAPDH为内参,反应结束后,运行溶解曲线程序,分析产物特异性。用7300 System SDS Software软件进行数据分析,统计各组2-△△Ct值,计算相应RQ值,比较各组mRNA的表达水平。所用引物见Tab 1。

Tab 1 Primer sequences
2.5 Western blot 法检测大鼠脑血管内皮细胞TRPV4蛋白的表达 ♂大鼠35只,分组同“2.4”。各组于缺血前20 min尾静脉注射相应受试药物。低温提取脑基底动脉蛋白。采用BCA法检测蛋白浓度,每孔上样40 μg蛋白,运用12% SDS-PAGE凝胶电泳分离样品,转膜,5%脱脂牛奶封闭,分别加入GADPH (1 ∶1 000)及TRPV4 (1 ∶1 000)一抗孵育过夜(4 ℃),再加入相应二抗(1 ∶2 000)室温孵育2 h,TBST洗膜,ECL发光液显色、曝光,成像结果采用Image J 1.43分析软件测定集成光密度值。
3 结果
3.1 TFR诱导的IR大鼠CBA血管舒张效应和超极化反应及去除血管内皮对其作用的影响 如Fig 1所示,用30 mmol·L-1KCl预收缩IR大鼠离体CBA后,加入递增浓度TFR(11~2 700 mg·L-1)可诱导血管产生剂量依赖性的舒张反应和超极化效应,与溶媒组比较差异有显著性(P<0.01)。去除CBA内皮后,TFR仍能介导IR大鼠CBA产生舒张作用与超极化效应,其最大舒张率为(29.71±3.18)%,最大超极化幅度为(-4.49±1.98)mV(P<0.01vsVehicle)。但与血管内皮完整组相比较,其效应明显减弱(P<0.01)。提示,血管内皮依赖性机制和较弱的血管内皮非依赖性机制两者均参与TFR对IR大鼠CBA舒张与超极化效应。

A: The dilatation of TFR in the 30 mmol·L-1KCl-preconstricted cerebral basilar arteries of -Endo and+Endo in ischemia/reperfusion injury in rats; B: The TFR-induced hyperpolorization in VSMC from cerebral basilar arteries of -Endo and +Endo in ischemia reperfusion injury in rats. -Endo: endotheliumdenudated and +Endo: endothelium-intact.**P<0.01vsVehicle(+Endo);##P<0.01vsIR (+Endo)
3.2 TFR诱导IR大鼠CBA产生的非PGI2非NO舒张反应和超极化作用 在大鼠CBA中灌注Indo(10 μmol·L-1)与L-NAME(30 μmol·L-1)去除PGI2、NO舒张作用,预处理30 min,当血管稳定时加入KCl(30 mmol·L-1),待血管收缩平衡分别加入11~2 700 mg·L-1TFR,结果发现后者介导大鼠CBA的舒张效应和超极化反应明显减弱,Sham组血管最大舒张率降至(45.03±3.05)%,最大超极化幅度绝对值降至(-8.34±1.06)mV,差异有统计学意义(P<0.01);IR组血管最大舒张率降至(64.30±4.21)%,最大超极化幅度绝对值降至(-11.41±2.05)mV,差异有显著性(P<0.01)。提示PGI2与NO参与诱导Sham组与IR组大鼠CBA的舒张作用和超极化反应。在去除PGI2和NO舒张效应后,IR组大鼠CBA的最大舒张率和最大超极化幅度绝对值均明显大于Sham组(P<0.01)。提示当IR发生时,TFR介导的大鼠CBA非PGI2非NO舒张效应和超极化反应是上调的。见Fig 2。
3.3 TRPV4阻断剂对TFR介导IR大鼠脑血管内皮细胞产生非NO非PGI2样舒张效应和超极化作用的影响 如Fig 3所示,IR大鼠CBA经过10 μmol·L-1Indo、30 μmol·L-1L-NAME及10 μmol·L-1TRPV4阻断剂RR预处理30 min后,TFR对IR大鼠CBA的舒张作用和超极化效应明显被阻滞,差异有统计学意义(P<0.01)。提示TRPV4阻断剂RR可以有效抑制TFR诱导的非PGI2非NO样舒张效应和超极化作用。
3.4 TFR对IR大鼠脑血管TRPV4 mRNA表达及TRPV4阻断剂对其的影响 与Sham组相比,IR组大鼠CBA中TRPV4 mRNA表达明显减少(P<0.01);与IR组比较,单用TFR组及合用TRPV4阻断剂RR组大鼠脑血管TRPV4 mRNA表达明显增加(P<0.01),单用RR组明显减少(P<0.01);合用RR组大鼠脑血管TRPV4 mRNA表达明显低于单用TFR组(P<0.01),高于单用RR组(P<0.01)。提示TFR能上调IR大鼠脑血管TRPV4 mRNA表达,但RR可抑制TFR诱导的脑血管TRPV4 mRNA表达的上调。见Fig 4。
3.5 TFR对IR大鼠脑血管TRPV4蛋白表达及TRPV4阻断剂对其的影响 如Fig 5所示,与Sham组相比,IR组大鼠TRPV4蛋白表达含量明显降低(P<0.01);当给予TFR和TRPV4阻断剂后,与IR组相比,单用TFR组及合用TRPV4阻断剂RR组CBA中TRPV4蛋白表达均明显升高(P<0.01),单用RR组明显减少(P<0.01);合用RR组大鼠TRPV4蛋白表达含量明显低于单用TFR组(P<0.01),高于单用RR组(P<0.01)。提示TFR在一定程度上能够上调IR大鼠脑血管TRPV4蛋白的表达,但TRPV4阻断剂RR可明显抑制TFR诱导的脑血管TRPV4蛋白表达的上调。
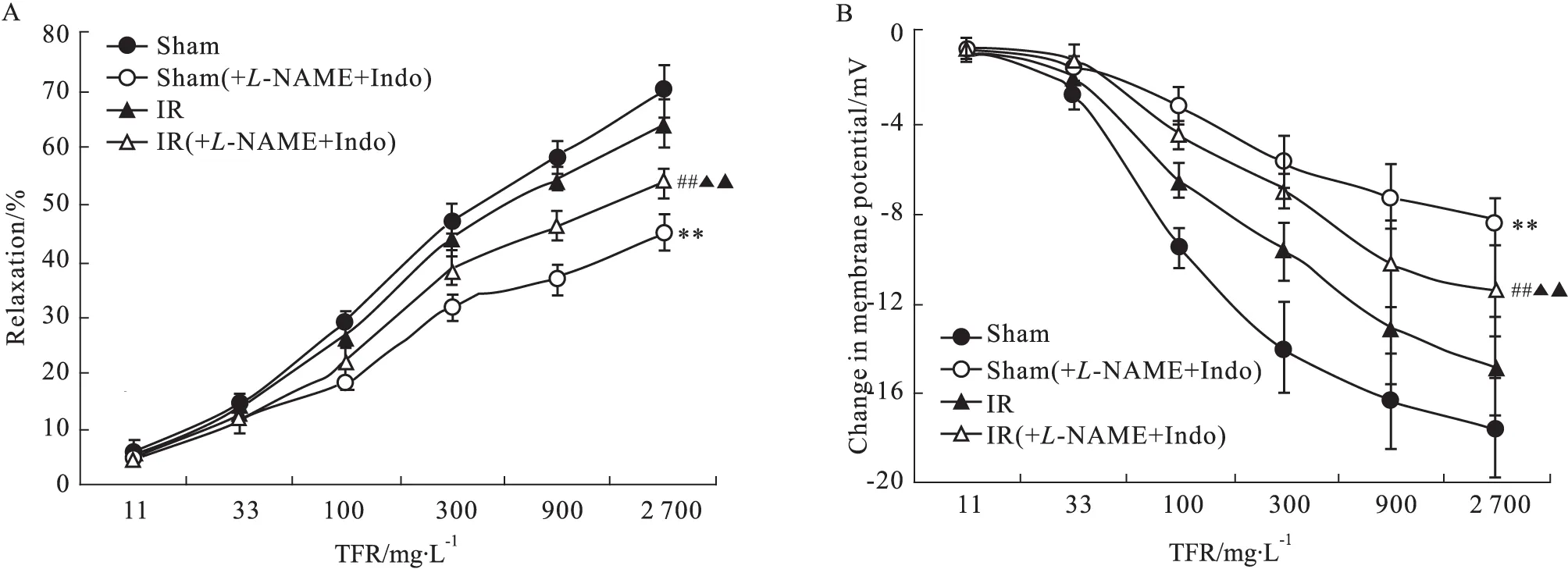
Fig 2 Effect of co-application of Indo (10 μmol·L-1) and L-NAME (30 μmol·L-1) on TFR-induced relaxation (A)
**P<0.01vssham;##P<0.01vsIR;▲▲P<0.01vsSham(+L-NAME+Indo)

**P<0.01vsvehicle;##P<0.01vsIR(L-NAME+Indo)
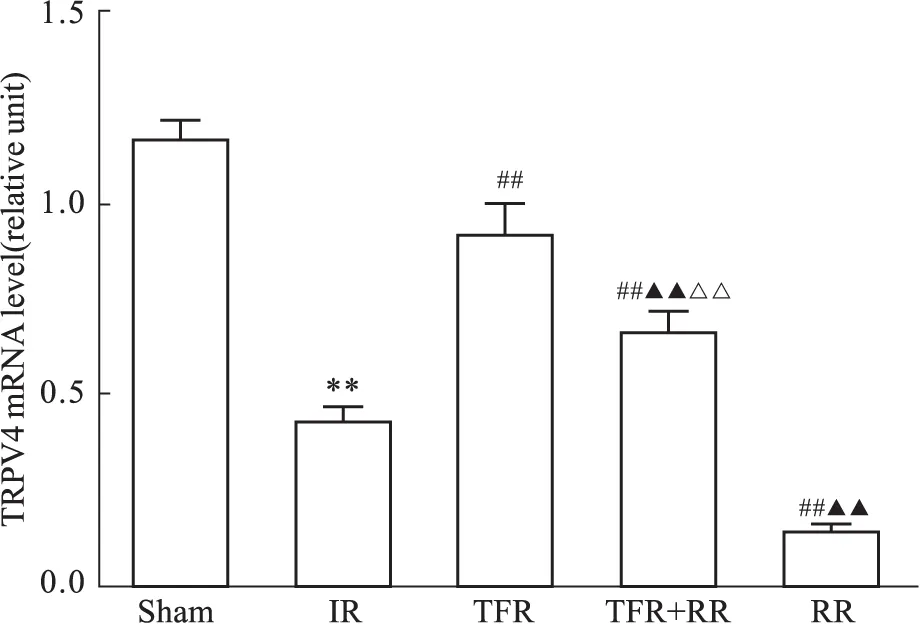

**P<0.01vssham;##P<0.01vsIR;▲▲P<0.01vsTFR;△△P<0.01vsRR
4 讨论
脑卒中是严重威胁人类生命健康的难治性疾病之一,约75%幸存者遗留有失语、瘫痪等严重残疾,在全球已成为第一致残和第二致死的原因[6]。脑卒中分为缺血性脑卒中与出血性脑卒中,其中缺血性脑卒中约占脑卒中80%。急性或慢性长期脑缺血会造成脑组织和细胞功能严重受损。临床上缺血性脑卒中多发生在CBA等脑主要动脉处,当其发生痉挛,可使血管腔狭窄、内径缩小,导致脑血流量急剧减少,从而引起脑供血严重不足。调查研究显示,近年来脑卒中发病率呈年轻化、上升趋势。目前病理机制不清,尚无疗效确切的治疗药物。

Fig 5 Effect of TFR and RR on TRPV4 protein expression level of cerebral basilar arteries in ischemia/reperfusion
**P<0.01vssham;##P<0.01vsIR;▲▲P<0.01vsTFR;△△P<0.01vsRR
研究表明[3],脑血管收缩与舒张因子导致的血管张力变化在缺血性脑卒中的发生、发展及转归中是一个决定性因素。在脑血管舒张因子中,作为非PGI2非NO舒血管物质EDHF在机体生理过程中发挥重要作用,尤其在病理情况下如脑外伤等,其作用更加突出,它在调节脑血流量方面至关重要[7]。目前,对EDHF调控血管功能的研究主要采用联用环加氧酶阻断剂与一氧化氮合成酶阻断剂排除PGI2、NO作用后,观察EDHF诱导的血管平滑肌细胞超极化与舒张效应。实验中,课题组发现递增浓度的TFR可介导预收缩IR大鼠离体CBA产生剂量依赖性的舒张作用和超极化效应。去除CBA内皮后,TFR诱导的上述效应明显减弱。结果提示,TFR介导IR大鼠CBA产生的舒张与超极化效应主要是血管内皮依赖性的。当运用环加氧酶抑制剂Indo和一氧化氮合成酶抑制剂L-NAME去除PGI2、NO 血管舒张作用后,TFR仍能诱导IR组和Sham组大鼠CBA产生明显的血管内皮依赖性舒张与超极化作用,且IR组血管最大舒张率和最大超极化幅度绝对值明显大于Sham组。结果提示,当IR发生时,TFR介导大鼠CBA产生的非PGI2非NO舒张效应和超极化反应是上调的。结合课题组前期研究结果[8],我们推测TFR介导IR大鼠CBA产生的非PGI2非NO血管舒张作用应为EDHF效应。
瞬时受体电位通道(TRP)是细胞膜上一类重要的阳离子通道家族,其通道蛋白分布十分广泛。TRPV是TRP家族中的一个亚家族,功能上属于Ca2+通道蛋白[9]。哺乳动物TRPV亚家族共有6个成员,分别为TRPV1至TRPV6,广泛分布在大脑、心脏、肝、肾、脾等组织中,在机体多种重要的生理功能与病理变化中发挥着重要作用[10]。TRPV4由 871 个氨基酸组成,可能包括33 个氨基酸基序列和6个锚定蛋白,在动脉上皮细胞、血管平滑肌细胞、呼吸道上皮细胞等均有广泛表达。TRPV4可感受机体环境压力改变促使通道开放,引起Ca2+内流,导致细胞内Ca2+浓度升高,触发Ca2+依赖的一系列生理反应,包括乙酰胆碱、谷氨酸等介质的释放[11]。文献报道,动脉血管对血流剪应力的反应关键取决于血管内皮TRPV4的激活,后者被认为可能是治疗脑血管疾病的新靶点之一[12]。钌红(RR)是第一个被发现对TRPV4具有非特异性阻断作用的拮抗剂,可完全阻滞大鼠、小鼠及人的TRPV4通道[13]。实验中,当给予TRPV4阻断剂RR后,TFR介导的IR组大鼠脑血管EDHF舒张作用和超极化反应被阻滞。提示阻断TRPV4可明显抑制TFR介导脑血管产生的EDHF效应。其结果与Zhang等[14]报道在TRPV4基因敲除小鼠,ACh诱导产生的血管舒张效应中NO和EDHF作用是减弱的一致。研究已证实,在血管内皮细胞上只有TRPV4呈高水平表达[15]。课题组对IR组大鼠脑血管内皮细胞上TRPV4基因表达进行检测。qRT-PCR和Western blot结果显示,与Sham组相比,IR组大鼠CBA内皮细胞中TRPV4 mRNA和蛋白表达明显减少。而用药后,TFR可明显增加IR组大鼠CBA内皮细胞中TRPV4 mRNA和蛋白表达,且该作用可被TRPV4阻断剂RR明显抑制。提示当脑缺血/再灌注损伤时,大鼠CBA内皮细胞中TRPV4 mRNA和蛋白表达是下调的,而TFR可通过激活TRPV4,上调IR组大鼠CBA内皮细胞中TRPV4 基因表达。
综上所述,课题组推测,脑缺血/再灌注损伤时,脑基底动脉内皮细胞上TRPV4活性与功能是降低的,而TFR可能通过作用于脑基底动脉内皮细胞,促进内源性舒血管物质EDHF生成增多,激活血管壁上的TRPV4,促使Ca2+进入细胞内,继发细胞膜超极化,继而关闭细胞膜上电压依赖性Ca2+通道,阻滞Ca2+内流发挥舒血管作用,从而产生改善缺血性脑卒中损伤的保护作用。其进一步机制还有待深入研究。
[1] Otani S, Nagaoka T, Omae T, et al. Histamine-induced dilation of isolated porcine retinal arterioles: role of endothelium-derived hyperpolarizing factor [J].InvestOphthalmolVisSci, 2016,57(11):4791-8.
[2] Seki T, Goto K, Kiyohara K, et al. Downregulation of endothelial transient receptor potential vanilloid type 4 channel and small-conductance of Ca2+-activated K+channels underpins impaired endothelium-dependent hyperpolarization in hypertension[J].Hypertension, 2017, 69(1):143-53.
[3] Han J, He G W, Chen Z W. Protective effect and mechanism of total flavones from rhododendron simsii planch on endothelium-dependent dilatation and hyperpolarization in cerebral ischemia-reperfusion and correlation to hydrogen sulphide release in rats [J].EvidBasedComplementAlternatMed, 2014, 2014: 904019.
[4] Guo Y, Chen Z W. Protective effects of total flavones of rhododendra on cerebral ischemia reperfusion injury [J].AmJChinMed, 2008, 36(2):343-54.
[5] 韩 军. 映山红花总黄酮对脑缺血/再灌大鼠脑血管舒张作用的 EDHF/H2S机制[D]. 合肥:安徽医科大学,2012.
[5] Han J. The mechanism of endothelium-derived hyperpolarizing factor/hydrogen sulphide for the cerebral vasodilation to total flavones of rhododendra flower in cerebral ischemia-reperfusion rat [D]. Hefei:Anhui Medical University,2012.
[6] Carota A, Bogousslavsky J. Mood disorders after stroke [J].FrontNeurolNeurosci,2012, 30:70-4.
[7] Han J, Chen Z W, He G W. Acetylcholine- and sodium hydrosulfide-induced endothelium-dependent dilatation and hyperpolarization in cerebral vessels of global cerebral ischemia-reperfusion rat[J].JPharmacolSci, 2013, 121(4): 318-26.
[8] 韩黎黎, 范一菲, 陈志武. 映山红花总黄酮对全脑缺血/再灌注大鼠脑基底动脉超极化反应的诱导作用[J]. 中草药, 2011, 42(6):1164-8.
[8] Han L L, Fan Y F, Chen Z W. Inducing effect of total flavones in rhododendra on endothelium-derived hyperpolarizing factor responses in cerebral basilar artery of rats subjected to global cerebral ischemia reperfusion[J].ChinTraditHerbDrugs, 2011, 42(6):1164-8.
[9] 孙春原,谢茗旭,刘愈颖,等. 高盐饮食增强内皮细胞TRPV4与cPLA2的空间偶联作用[J]. 中国药理学通报, 2016, 32(12):1718-23.
[9] Sun C Y,Xie M X,Liu Y Y, et al. High salt diet enhances the physical coupling between TRPV4 and cPLA2 [J].ChinPharmacolBull, 2016, 32(12) : 1718-23.
[10]宋 阳,詹 磊,黄 成,等. 瞬时感受器电位离子通道香草素受体亚家族4调控肝星状细胞活化增殖作用研究 [J]. 中国药理学通报,2016, 32(5): 687-91.
[10]Song Y,Zhan L,Huang C, et al. Regulatory effects of TRPV4 on liver fibrosis of rats [J].ChinPharmacolBull, 2016, 32(5): 687-91.
[11]Poole D P,Amadesi S,Veldhuis N A, et al. Protease-activated receptor 2 (PAR2) protein and transient receptor potential vanilloid 4 (TRPV4) protein coupling is required for sustained inflammatory signaling[J].JBiolChem,2013, 288(8):5790-802.
[12]Baratchi S, Almazi J G, Darby W, et al. Shear stress mediates exocytosis of functional TRPV4 channels in endothelial cells[J].CellMolLifeSci, 2016, 73(3):649-66.
[13]Sánchez J C, López-Zapata D F, Wilkins R J. TRPV4 channels activity in bovine articular chondrocytes: regulation by obesity-associated mediators[J].CellCalcium, 2014, 56(6):493-503.
[14]Zhang D X, Mendoza S A, Bubolz A H,et al. Transient receptor potential vanilloid type 4-deficient mice exhibit impaired endothelium-dependent relaxation induced by acetylcholineinvitroandinvivo[J].Hypertension, 2009, 53(3):532-8.
[15]Ma X, Cheng K T, Wong C O, et al. Heteromeric TRPV4-C1 channels contribute to store-operated Ca2+entry in vascular endothelial cells[J].CellCalcium, 2011, 50(6):502-9.
Effects of total flavones of rhododendra on transient receptor potential vanilloid receptor 4 in cerebral basilar arteries of rats subjected to ischemia/reperfusion injury
HAN Jun1,CHENG Xiao-long1,HU Kun-mei1,XU Hang-hang1,CHEN Zhi-wu2
(1.DeptofPharmacology,SchoolofBasicMedicine,Third-GradePharmacologyLaboratoryofState,AdministrationofTraditionalChineseMedicine,WannanMedicalCollege,WuhuAnhui241002,China; 2.DeptofPharmacology,SchoolofBasicMedicine,AnhuiMedicalUniversity,Hefei230031,China)
Aim To research the effects of total flavones of rhododendra (TFR) on transient receptor potential vanilloid receptor 4 (TRPV4) in cerebral basilar arteries (CBA) of rats subjected to ischemia/reperfusion (IR)injury. Methods The model of total brain IR was established by four-artery occlusion (4-VO) method in rats. Arterial pressure perfusion and cell membrane potential recording methods were used for surveying the dilatation and hyperpolarization of TFR and ruthenium red(RR, an inhibitor of TRPV4) in the KCl-preconstricted CBAexvivoin rats subjected to IR. Quantitative real-time polymerase chain reaction (qRT-PCR) and Western blot were utilized to investigate the TRPV4 mRNA and protein expressions of TFR and RR in cerebrovascular endothelial cells of CBAinvivoin rats subjected to IR. Results 11~2 700 mg·L-1TFR significantly induced concentration-dependent hyperpolarization and dilatation in the KCl-preconstricted CBA in rats subjected to IR. TFR still produced degenerative hyperpolarization and dilatation by removal of endothelium in CBA, which was remarkably attenuated as compared with endothelium-intact group (P<0.01). After removal of NO and PGI2vasodilatation, TFR obviously elicited the hyperpolarization and dilatation that were further decreased by RR (an inhibitor of TRPV4) in IR CBAs. TFR pretreatment apparently increased the level of TRPV4 mRNA and protein expressions in IR CBAs. These effects were restrained by RR, an inhibitor of TRPV4. Conclusions TFR could mediate endothelium-dependent and endothelium-independent effects. The endothelium-derived dilatation may be related to the increase of endothelium activity and endothelium-derived hyperpolarizing factor (EDHF) generation and release that have been promoted by TFR, and secondarily activating TRPV4, which results in Ca2+inflow and subsequent hyperpolarization of vascular smooth muscle cell membrane and vasorelaxation.
TFR; ischemia/reperfusion injury;cerebral basilar artery; hyperpolarization; vasodilatation; endothelium-derived hyperpolarizing factor; TRPV4
2016-12-15,
2017-01-13
国家自然科学基金资助项目(No 81173596);安徽省教育厅自然科学基金重点项目(No KJ2015A157)
韩 军(1975-),男,博士,副教授,硕士生导师,研究方向:心脑血管药理学,E-mail: aku110@163.com
时间:2017-4-24 11:20
http://kns.cnki.net/kcms/detail/34.1086.R.20170424.1120.038.html
10.3969/j.issn.1001-1978.2017.05.019
A
1001-1978(2017)05-0685-07
R-332;R284.1;R322.121;R331.32;R392.11;R743.302.2

