DPF2基因RNA干扰对人胰腺癌细胞PANC-1增殖、凋亡和细胞周期的作用研究
刘 超,孙如玉,黄 健,刘丽华,方圣云,3
(安徽医科大学1.基础医学院、2.临床药理研究所,安徽 合肥 230032;3.美国马里兰大学生物医学工程技术中心,马里兰巴尔的摩 21201)
DPF2基因RNA干扰对人胰腺癌细胞PANC-1增殖、凋亡和细胞周期的作用研究
刘 超1,孙如玉1,黄 健1,刘丽华2,方圣云1,3
(安徽医科大学1.基础医学院、2.临床药理研究所,安徽 合肥 230032;3.美国马里兰大学生物医学工程技术中心,马里兰巴尔的摩 21201)
目的 已知DPF2参与白血病以及肿瘤的发生,但是DPF2是否参与胰腺癌发生和进展还不清楚,因此观察了DPF2基因RNA干扰对胰腺癌细胞系PANC-1细胞增殖、凋亡和细胞周期的影响。方法 采用慢病毒介导的DPF2基因RNA干扰敲低PANC-1细胞的DPF2表达,通过克隆形成实验和MTT实验检测DPF2基因RNA干扰对PANC-1细胞增殖的作用,通过流式细胞术检测DPF2 基因RNA干扰对PANC-1细胞凋亡和细胞周期的作用。结果 慢病毒介导的DPF2基因RNA干扰中剂量和高剂量(2 μL和4 μL)使PANC-1细胞的DPF2表达明显降低。与阴性对照组比较,DPF2基因RNA干扰明显抑制PANC-1细胞活力和克隆形成,还促进PANC-1的凋亡。此外,DPF2基因RNA干扰引起细胞周期的S期阻滞,明显减少G2/M周期的细胞数量。结论 DPF2可能参与胰腺癌细胞PANC-1的增殖、凋亡过程和细胞周期的调控,通过慢病毒介导的DPF2基因RNA干扰敲低DPF2蛋白表达,可能为寻找潜在的抗胰腺癌的新方法提供实验依据。
DPF2;RNA干扰;慢病毒;PANC-1;增殖;凋亡;细胞周期
胰腺癌是极具侵袭性的恶性肿瘤,发病率不断上升[1]。至2030年,胰腺癌将成为第2位的肿瘤致死因素[2]。胰腺癌对放疗和化疗耐受,进展快速又无明显临床症状[3],导致早期诊断治疗极为困难,预后差[4]。胰腺癌患者的5年生存率约5%[5],尽管外科手术提供了治疗的机会,但是多数病人由于难以根除,失去治愈时机的同时,还存在较高的复发机率[5]。
DPF2是SWI/SNF复合物的亚单位之一,为白细胞扩增和自我更新所需,也是白血病相关的致病蛋白[6]。此外,DPF2作为SWI/SNF复合物和RelB/p52之间的调节蛋白,在非经典的NF-κB信号通路的转录激活和相关的肿瘤发生中起重要作用[7]。因此,我们推测DPF2也可能参与其他实体肿瘤的发生和发展,但是DPF2对胰腺癌的作用目前还不清楚。近年来研究表明[8],发现致瘤相关基因可以成为肿瘤治疗的重要靶点。通过RNA干扰(RNA interference, RNAi)方法高效特异地沉默致瘤基因,是肿瘤治疗的方法之一[9]。此外,特异性沉默致瘤基因还可协同相关化学药物疗法,增强抗癌药物疗效[10]。因此,本实验中我们采用带有DPF2-RNAi的慢病毒感染胰腺癌细胞系—PANC-1细胞,观察DPF2基因RNA干扰对PANC-1细胞增殖、凋亡和细胞周期的影响,希望能较好地明确DPF2基因是否参与胰腺癌发生和发展,为探索治疗胰腺癌新方法提供新的实验依据。
1 材料
1.1 细胞株 PANC-1细胞,购自中国科学院细胞库(上海)。
1.2 药物与试剂 胎牛血清(Ausbian,批号:VS500T)。DMEM(Corning,批号:10-013-CVR)。胰酶(上海生工生物工程股份有限公司,批号:T0458-50G)。Puromycin(Clontech,批号:631305)。慢病毒:LV-DPF2 siRNA #25540和对照NC siRNA病毒(Genechem,上海),慢病毒信息和序列见参考文献[11]。抗体:兔抗DPF2抗体(Proteintech,美国),兔抗GAPDH抗体(Proteintech,美国)。MTT(Genview,批号:JT343)。DMSO(上海试一化学试剂,批号:130701)。Giemsa染色液(上海鼎国生物技术有限公司,批号:AR-0752)。凋亡试剂盒(eBioscience,批号:88-8007)。碘化丙啶(propidium,PI)(Sigma,批号:P4170)。RNase A(Fermentas,批号:EN0531)。
1.3 仪器 荧光显微镜(奥林巴斯IX71)。CO2培养箱(日本三洋,SANYO MCO-175)。离心机(赛默飞世尔科技中国有限公司,Fresco 21)。生物安全柜(上海振样创空气净化设备有限公司,Bio 1200-Ⅱ-A2)。酶标仪(Tecan infinite,M2009PR)。流式细胞仪(Millipore Guava easyCyte HT)。
2 方法
2.1 细胞培养 PANC-1细胞培养参考文献方法[11]。细胞用Dulbecco′s modified Eagle′s medium(DMEM)培养基(添加体积分数0.10的胎牛血清、50 kU·L-1青霉素和50 mg·L-1链霉素双抗),置于体积分数0.05二氧化碳条件下培养。细胞覆盖率近90%时,用0.25%胰酶消化制备细胞悬液,计数后,以1 ∶3的比例传代,每3 d传代1次。至对数生长期时,取细胞用于后续实验。
2.2 慢病毒感染 慢病毒介导的DPF2-RNAi干扰方法参考本课题组的报道[12]。细胞经胰酶消化,用完全培养基制成细胞悬液,按每孔5×104个细胞接种到6孔培养板中继续培养,保证感染时铺板量达到30%左右。感染时,每孔更换1 mL新鲜培养基,加入荧光标记的慢病毒(LV-DPF2 siRNA #25540病毒和对照病毒)1~4 μL进行感染。在感染后10 h更换为常规培养基继续培养。在感染后72 h左右,荧光显微镜观察GFP的表达情况,荧光率即为阳性感染率。当细胞阳性感染效率达到70%以上,进行相关后续实验。
2.3 MTT检测 参考文献方法[13],将处于对数生长期的各实验组细胞消化后制备细胞悬液,并进行计数。于96孔细胞培养板中每孔接种2×103个细胞,每组重复5孔,铺5张96孔板。铺板后连续培养5 d,最后1 d培养终止前4 h,于每孔中加入20 μL 5 g·L-1的MTT。4 h后吸去培养液,保留孔板底部的甲臜颗粒,再加100 μL DMSO,振荡器振荡2~5 min后,用酶标仪在490 nm 检测OD值。最后进行数据统计分析。
2.4 细胞克隆形成检测 参考文献[14],将处于对数生长期的各实验组细胞消化后制备细胞悬液,进行计数。于6孔培养板中每孔接种1×103个细胞,每组设3个复孔。将接种好的细胞继续培养到14 d,每隔3 d换液1次。实验终止前3 h,在荧光显微镜下对细胞克隆进行拍照。拍照结束后,用1×PBS洗涤细胞1次,每孔加入1 mL质量浓度为10 g·L-1多聚甲醛,固定细胞60 min,再用1×PBS洗涤细胞1次。然后,每孔加入洁净且无杂质的Giemsa染液500 μL,保持10~20 min,其后用ddH2O洗涤细胞数次并晾干,用数码显微镜拍照后,进行克隆计数。
2.5 凋亡检测 参考文献[4]和试剂盒方法,将处于对数生长期的各实验组细胞制成细胞悬液,进行细胞计数。然后于6孔培养板中接种细胞,每组设3个复孔。待细胞覆盖率约为70%时,经胰酶消化细胞,用完全培养基重悬,收集于5 mL离心管中,在1 300 r·min-1离心5 min,弃上清,用4 ℃预冷的D-Hanks(pH=7.2~7.4)缓冲液洗涤细胞沉淀。后用1×binding buffer洗涤细胞沉淀1次,1 300 r·min-1离心3 min,收集细胞。再用200 μL 1×binding buffer重悬细胞沉淀,并加入10 μL Annexin V染色,室温避光10~15 min。最后补加400~800 μL 1×binding buffer,上机检测。
2.6 细胞周期检测[15]采用PI-流式细胞术方法,病毒感染后d 3,将处于对数生长期的各实验组细胞制成细胞悬液,进行计数。然后于6 孔板培养板中接种细胞,待细胞覆盖率约为80%时,经胰酶消化,用完全培养基重悬成细胞悬液,收集细胞于5 mL离心管中,每组设3个复孔。将细胞置于1 300 r·min-1离心5 min,弃上清后,用4 ℃预冷的D-Hanks(pH=7.2~7.4)洗涤细胞1 次,重复1 300 r·min-1离心5 min,弃上清。然后用4 ℃预冷的体积分数为0.75乙醇固定细胞1 h,经1 300 r·min-1离心5 min 除去固定液,再用D-Hanks洗涤细胞1次。加入细胞染色液(0.6~1 mL)重悬细胞,上机时细胞通过率为300~800个·s-1。配制细胞染色液如下:40×PI母液(2 g·L-1) ∶100×RNase母液(10 g·L-1) ∶1×D-Hanks=25 ∶10 ∶1 000。
2.7 Western blot检测 Western blot检测参考文献方法[16]。所用抗体如下:兔抗DPF2(1 ∶500, Proteintech,美国) 和兔抗GAPDH(1 ∶2 000,Proteintech, 美国)。
3 结果
3.1 DPF2基因RNA干扰明显抑制PANC-1细胞DPF2蛋白表达 为了检测DPF2在胰腺癌细胞PANC-1中的生物学作用,用可以表达绿色荧光蛋白的介导DPF2基因RNA干扰的慢病毒感染PANC-1细胞。感染后d 3,通过荧光显微镜检测荧光表达,两组慢病毒均显示了较高的感染效率,见Fig 1A~1D。与阴性对照病毒(NC)组相比较,DPF2-RNAi干扰(KD)组明显抑制了PANC-1细胞中DPF2的表达,而且中剂量和高剂量(2 μL和4 μL)组的效果优于低剂量(1 μL)组,具有一定的剂量依赖性,见Fig 1E。
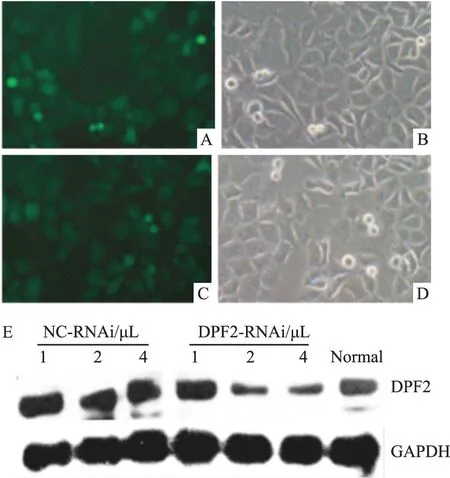
Fig 1 Effect of lentivirus-mediated DPF2-RNAi on expression of DPF2 in PANC-1 cells
A:Fluorescence photograph of negative control(NC)-RNAi lentivirus group;B:Phase photograph of the same area in A; C:Fluorescence photograph of DPF2-RNAi lentivirus group;D:Phase photograph of the same area in C; E:DPF2-RNAi downregulates expression of DPF2 in PANC-1 cells in a dose dependent style. The number of 1, 2 and 4 indicate the amount of lentiviruses used for infection(1,2 and 4 μL). NC: negative control; KD: knockdown of DPF2
3.2 DPF2基因RNA干扰抑制PANC-1细胞增殖 克隆形成是测定细胞增殖能力的有效方法之一,通过感染后细胞在细胞培养板上的克隆形成能力来提示慢病毒感染后细胞的成瘤能力。结果显示,与阴性对照组比较,DPF2-RNAi明显减少了PANC-1细胞的克隆形成,见Fig 2A、2B。通过MTT方法检测细胞活力,同样可以验证细胞增殖能力。如Fig 2C、2D所示,与阴性对照组比较,DPF2-RNAi明显降低了PANC-1细胞的存活能力。而且DPF2-RNAi的上述作用在细胞增殖的d 3呈现明显效果(P<0.05),并在d 4和d 5进一步增强(P<0.01),见Tab 1。以上结果提示DPF2可能促进PANC-1细胞的增殖,而DPF2-RNAi则明显抑制PANC-1细胞的增殖。
3.3 DPF2基因RNA干扰促进PANC-1细胞凋亡 通过流式细胞术检测处于凋亡状态的PANC-1细胞数量来检验目的基因与细胞凋亡的关联。统计结果显示,与阴性对照组比较,DPF2-RNAi明显增加PANC-1细胞的凋亡率(P<0.01),见Fig 3。提示DPF2对PANC-1细胞的凋亡起重要作用,而通过DPF2-RNAi则可以促进PANC-1细胞的凋亡。
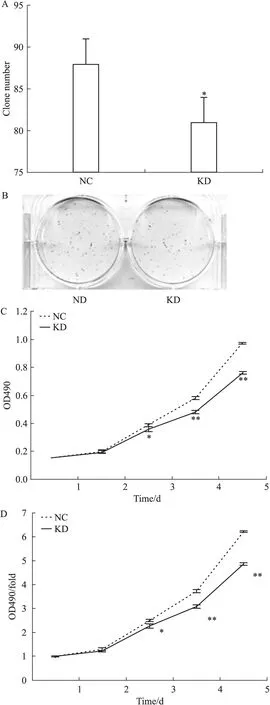
Fig 2 Effect of DPF2-RNAi on colony formation and cell viability of PANC-1 cells
A:The colony numbers of the KD group were decreased significantly as compared to those of the NC group;B:The typical cell colonies of both the NC group and the KD group;C:The OD values of the PANC-1 cells investigated by MTT assay in the indicated groups following 1, 2, 3, 4 and 5 days of the infection;D:The change fold of the OD values of PANC-1cells in the indicated groups.*P<0.05,**P<0.01vsNC group
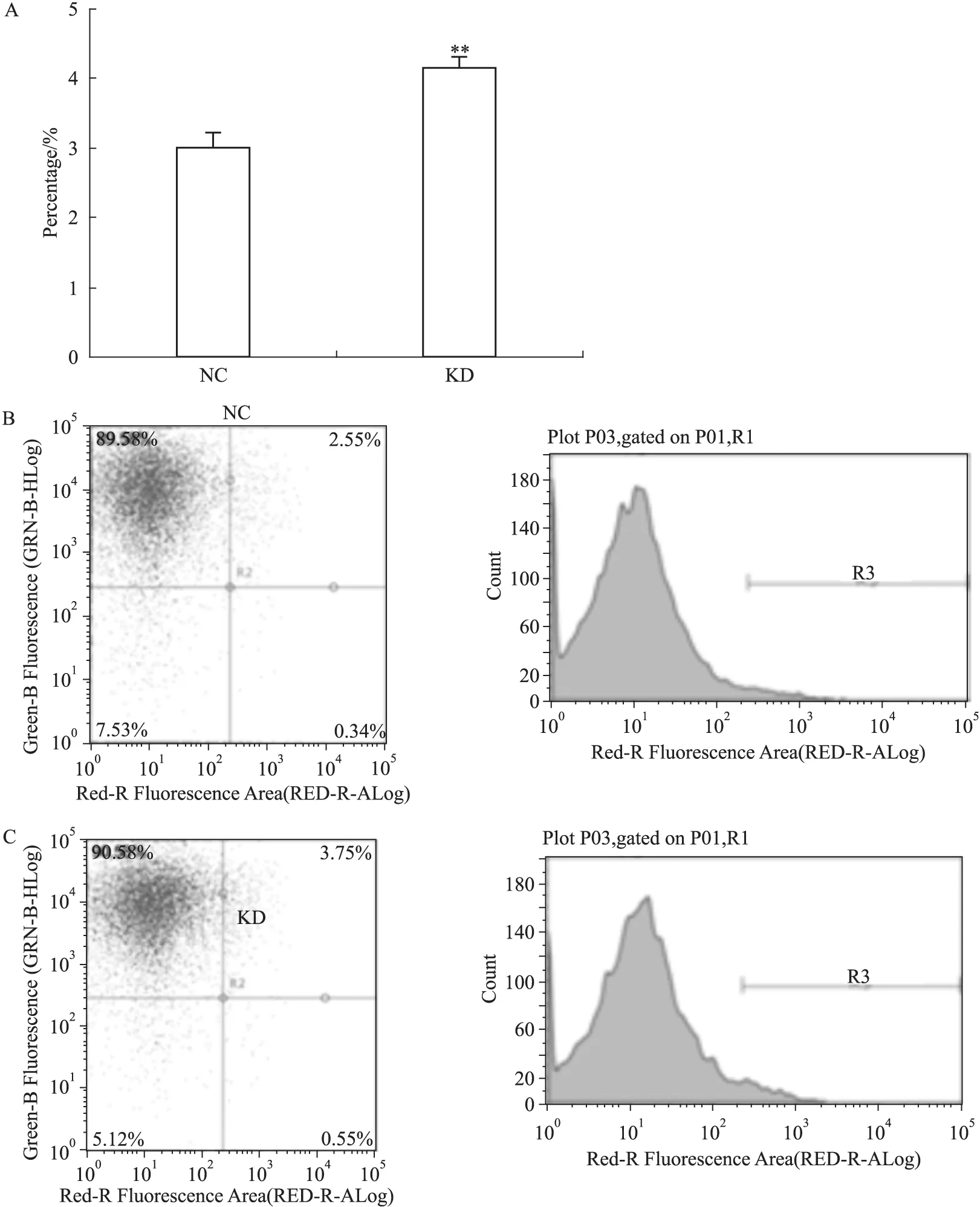
Fig 3 Effect of DPF2-RNAi on apoptosis of PANC-1cells
A:Percentage of the apoptotic PANC-1 cells in the total cells was increased significantly by the lentivirus-mediated DPF2-RNAi;B and C:The typical FACS analysis data of both the NC and KD groups are shown

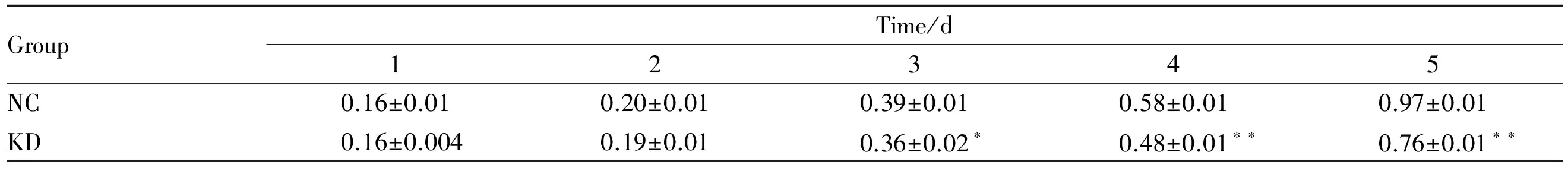
GroupTime/d12345NC0.16±0.010.20±0.010.39±0.010.58±0.010.97±0.01KD0.16±0.0040.19±0.010.36±0.02∗0.48±0.01∗∗0.76±0.01∗∗
*P<0.05,**P<0.01vsNC
3.4 DPF2基因RNA干扰引起PANC-1细胞周期的S期阻滞并减少G2/M期细胞数量 采用了PI -FACS的方法检测DPF2对PANC-1细胞周期的作用,见Fig 4A~4C。结果表明:在G1期时,阴性对照组细胞数(32.10±1.27)%和DPF2-RNAi组(31.75±1.19)%无明显差异。在S期时,与阴性对照组细胞数比较(49.28±1.11)%,DPF2-RNAi组PANC-1细胞数(53.41±0.96)%明显增加(P<0.01)。而在G2/M期,与阴性对照组(18.62±0.33)%比较,DPF2-RNAi组细胞数(14.84±0.24)%明显降低(P<0.01)。这些结果提示,DPF2-RNAi可以通过S期细胞阻滞和减少G2/M期细胞数量来影响PANC-1的细胞周期。
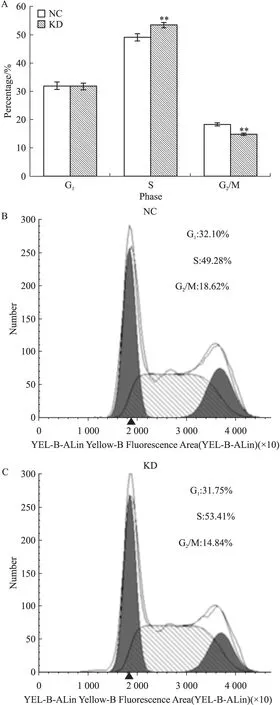
Fig 4 Effect of DPF2-RNAi on cell cycle of PANC-1 cells
A:DPF2-RNAi induced the S-phase arrest and decreased G2/M phase population significantly of the PANC-1 cells;B and C:The typical PI-FACS analysis data of both the NC and KD groups are shown.**P<0.01vsNC group
4 讨论
胰腺癌是一种严重危害患者的常见胃肠道恶性肿瘤,给包括中国在内的各国带来严重负担。近年来,针对胰腺癌的研究取得了快速进展,寻找新的生物或基因标记物既有助于揭示肿瘤发生和发展的机制,又可以为化学药物治疗肿瘤提供新的靶点[17]。
肿瘤的发生与肿瘤细胞恶性增殖有关[18],抑制肿瘤细胞增殖是抗肿瘤的有效手段[19]。本研究表明,除了抑制PANC-1细胞克隆形成外,DPF2-RNAi还可以明显抑制PANC-1细胞活力,并且有较好的时间-效应关系。一方面提示DPF2基因可能以调控细胞活力为特点,参与胰腺肿瘤细胞增殖,另一方面提示利用DPF2-RNAi抑制DPF2蛋白的表达是潜在抗胰腺肿瘤细胞增殖的手段。
促进肿瘤细胞凋亡可用于肿瘤的治疗[20]。本研究发现DPF2-RNAi促进PANC-1细胞凋亡,提示DPF2-RNAi还可能通过促进胰腺肿瘤细胞凋亡,成为潜在抑制胰腺肿瘤细胞生长的方法。我们还发现,虽然DPF2-RNAi后PANC-1细胞凋亡有明显增加,但是总凋亡比例较低。因此,采用致肿瘤细胞凋亡的化学药物联合DPF2-RNAi的方法来进一步研究基因干扰和化疗药物的协同抗肿瘤作用是我们下一步的研究方向之一。
细胞周期各阶段调节障碍导致的细胞无限增殖主要与肿瘤的进展密切相关。本研究表明,DPF2-RNAi可以明显使PANC-1细胞阻滞于S期,并且明显减少G2/M期的PANC-1细胞数,提示DPF2对肿瘤细胞周期有重要调节作用。DPF2-RNAi对上述细胞周期的影响可能是其抑制胰腺肿瘤进一步进展的潜在机制。检测细胞周期,特别是S期和G2/M期相关调控蛋白的表达也将是我们下一步的研究方向。
综上所述,本研究结果提示DPF2可能参与胰腺肿瘤细胞PANC-1的增殖和凋亡过程,还可调控PANC-1的细胞周期,DPF2-RNAi干扰方法为我们寻找对抗胰腺肿瘤进展的新方法提供了实验基础。
[致谢:感谢安徽医科大学省部级重点实验室培育项目(No SBSYS-1404)和安徽医科大学基础医学院分子细胞中心实验室的支持。]
[1] Siegel R L, Miller K D, Jemal A.Cancer statistics, 2016[J].CACancerJClin, 2016,66(1): 7-30.
[2] Rahib L, Smith B D, Aizenberg R, et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States[J].CancerRes, 2014,74(11): 2913-21.
[3] Zhang Q, Wang H, Ran L, et al.The preclinical evaluation of TIC10/ONC201 as an anti-pancreatic cancer agent[J].BiochemBiophysResCommun, 2016,476(4): 260-6.
[4] Pan Y,Shan W, Fang H, et al. Sensitive and visible detection of apoptotic cells on Annexin-V modified substrate using aminophenylboronic acid modified gold nanoparticles(APBA-GNPs) labeling[J].BiosensBioelectron,2014,52:62-8.
[5] Wolfgang C L, Herman J M, Laheru D A, et al. Recent progress in pancreatic cancer[J].CACancerJClin, 2013,63(5): 318-48.
[6] Cruickshank V A, Sroczynska P, Sankar A,et al. SWI/SNF subunits SMARCA4, SMARCD2 and DPF2 collaborate in MLL-rearranged leukaemia maintenance[J].PLoSOne, 2015,10(11): e0142806.
[7] Tando T, Ishizaka A, Watanabe H, et al. Requiem protein links RelB/p52 and the Brm-type SWI/SNF complex in a noncanonical NF-kappaB pathway[J].JBiolChem, 2010,285(29): 21951-60.
[8] 夏丽杰,张富春. 肝癌治疗新靶点GPC3研究进展[J]. 中国药理学通报,2016, 32(11): 1486-9.
[8] Xia L J, Zhang F C.Research progress of a new therapeutic target in hepatocellular carcinoma glypican 3[J].ChinPharmacolBull,2016,32(11):1486-9.
[9] Zhao J, Wei X L ,Jia Y S, Zheng J Q .Silencing of herg gene by shRNA inhibits SH-SY5Y cell growthinvitroandinvivo[J].EurJPharmacol, 2008, 579(1-3): 50-7.
[10]Sabbineni H, Alwhaibi A, Goc A, et al. Genetic deletion and pharmacological inhibition of Akt1 isoform attenuates bladder cancer cell proliferation, motility and invasion[J].EurJPharmacol, 2015, 764: 208-14.
[11]Chen S F, Xia J, Lv Y P, et al.N,N′-di-(m-methylphenyi)-3,6-dimethyl-1,4-dihydro-1,2,4,5-tetrazine-1,4-dicarboam ide(ZGDHu-1) suppresses the proliferation of PANC-1 pancreatic cancer cells via apoptosis and G2/M cell cycle arrest[J].OncolRep, 2015,33(4): 1915-21.
[12]Liu C, Zhang D J, Shen Y X, et al.DPF2 regulates OCT4 protein level and nuclear distribution[J].BiochimBiophysActa, 2015,1853(12): 3279-93.
[13]Yadav V, Varshney P, Sultana S, et al. Moxifloxacin and ciprofloxacin induces S-phase arrest and augments apoptotic effects of cisplatin in human pancreatic cancer cells via ERK activation[J].BMCCancer, 2015,15: 581.
[14]Yi X, Li Y, Zai H, et al. KLF8 knockdown triggered growth inhibition and induced cell phase arrest in human pancreatic cancer cells[J].Gene, 2016,585(1): 22-7.
[15]Yadav V, Sultana S, Yadav J, et al. Gatifloxacin induces S and G2-phase cell cycle arrest in pancreatic cancer cells via p21/p27/p53[J].PLoSOne, 2012,7(10): e47796.
[16]Liu L, Liu C, Zhong Y, et al.ER stress response during the differentiation of H9 cells induced by retinoic acid[J].BiochemBiophysResCommun,2012,417(2): 738-43.
[17]Garrido-Laguna I, Hidalgo M. Pancreatic cancer: from state-of-the-art treatments to promising novel therapies[J].NatRevClinOncol,2015,12(6): 319-34.
[18]Li S, Gu Z, Xiao Z, et al. Anti-tumor effect and mechanism of cyclooxygenase-2 inhibitor through matrix metalloproteinase 14 pathway in PANC-1 cells[J].IntJClinExpPathol, 2015,8(2): 1737-42.
[19]路玉盼,董 宪,冯 霞,等. 血根碱抑制人乳腺癌细胞MCF-7增殖的机制研究[J].中国药理学通报,2016,32(6):858-62.
[19]Lu Y P, Dong X, Feng X, et al. Sanguinarine inhibits cell proliferation in MCF-7 human mammary adenocarcinoma cells[J].ChinPharmacolBull, 2016, 32(6): 858-62.
[20]谷满仓,钱亚芳,孙 悦,等. 薏苡仁脂调控凋亡相关蛋白Bax、Bcl-2及Survivin增强胰腺癌细胞对吉西他滨敏感性的研究[J].中国药理学通报, 2013, 29(4): 491-5.
[20]Gu M C, Qian Y F, Sun Y, et al. Coix seed lipids sensitize the activity of gemcitabine against pancreatic cancer cells through modulating Bax, Bcl-2 and Survivin[J].ChinPharmacolBull, 2013, 29(4): 491-5.
Effect of DPF2-RNAi on proliferation, apoptosis and cell cycle of PANC-1 cells
LIU Chao1, SUN Ru-yu1, HUANG Jian1, LIU Li-hua2,FANG Sheng-yun1,3
[1.SchoolofBasicMedicalSciences,2.InstituteofClinicalPharmacology,AnhuiMedicalUniversity,Hefei230032,China; 3.CenterforBiomedicalEngineeringandTechnology(BioMET),UniversityofMaryland,MDBaltimore21201,USA]
Aim DPF2 has been reported to be involved in pathogenesis of leukaemia and oncogenic activity.However, the role of DPF2 in oncogenesis and pathogenesis of pancreatic cancer remains unclear. Therefore, the present research aims to investigate the effects of DPF2-RNAi on proliferation, apoptosis and cell cycle regulation of a pancreatic cell line, PANC-1 cells.Methods The lentivirus-mediated DPF2-RNAi was employed to knockdown DPF2 expression in PANC-1 cells, and the role of DPF2-RNAi in proliferation, apoptosis and cell cycle regulation of the PANC-1 cells was examined through MTT assay, colony formation assay and flowcytometry assay.Results The lentivirus-mediated DPF2-RNAi middle and high doses(2 μL and 4 μL) significantly decreased the expression of DPF2 in the PANC-1 cells. DPF2-RNAi decreased cell viability and colony formation, and increased apoptosis of the PANC-1 cells. Besides, DPF2-RNAi inducedthe S-phase arrest and decreased G2/M phase population of the PANC-1 cells.Conclusions DPF2 may play a crucial role in proliferation, apoptosis and cell cycle regulation of PANC-1 cells. Knockdown of DPF2 through lentivirus-mediated DPF2-RNAi may provide experimental basis for finding a new method for therapy of pancreatic cancer.
DPF2; RNAi; lentivirus; PANC-1; proliferation; apoptosis; cell cycle
2017-02-07,
2017-02-24
国家自然科学基金资助项目(No 31271159);安徽省高校学科拔尖人才学术资助重点项目(No gxbjZD2016030)
刘 超(1974-),男,博士,副教授,硕士生导师,研究方向:干细胞和肿瘤发生,E-mail: chaol1974@ahmu.edu.cn
时间:2017-4-24 11:20
http://kns.cnki.net/kcms/detail/34.1086.R.20170424.1120.024.html
10.3969/j.issn.1001-1978.2017.05.012
A
1001-1978(2017)05-0647-07
R329.24;R329.25;R329.28;R373.9;R735.902.2;R977.6

