连枷腿综合征的临床特点(附1 例报告及文献复习)
李晶杨伟林王立新
·病例报告·
连枷腿综合征的临床特点(附1 例报告及文献复习)
李晶*杨伟林△王立新△
连枷腿综合征 肌萎缩侧索硬化 运动神经元病
运动神经元病(motor neuron disease,MND)是一组病因未明的选择性侵犯脊髓前角细胞、脑干后组运动神经元、皮质锥体细胞及锥体束的慢性进行性神经变性疾病。肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是MND的经典类型[1]。连枷腿综合征(flail leg syndrome,FLS)是ALS的一种变异型,临床较罕见,至今国内外详细报道的有5 例[2-5],另有少许相关研究[6-9]。本文对我院神经内科收治的1例FLS患者进行病例报告及文献复习,以期提高临床医生对该病的认识。
1 临床资料
1.1 发病情况 患者,男,51岁。因“双下肢乏力9个月余”于2015年3月30日入院。患者2014年7月自觉双下肢乏力,行走后明显,休息可缓解,无麻木疼痛感,日常活动不受限。当地医院查肌电图示神经源性损害(双下肢及胸段脊旁肌),头颅、胸腰椎MRI及腰穿未见异常。考虑“周围神经病”,给予营养神经及对症处理,症状未见好转出院。同年8月至上海某医院,考虑“下运动神经元综合征”,予营养神经、对症处理后,症状改善不明显出院。同年12月渐见抬腿困难、腰部乏力,双侧大腿部时有“肉跳感”,遂就诊于北京某医院,考虑“下运动神经元综合征”,予力鲁肽口服及对症处理,效果不佳出院。2015年3月出现行走困难,搀扶可行走十余米,双侧大腿部时有“肉跳感”,无麻木疼痛等,至我院就诊。既往史、个人史、家族史无特殊。1.2体格检查 心肺腹部查体未见异常。神经系统:高级神经活动及颅神经查体未见异常。运动系统:四肢肌肉未见萎缩或假性肥大,双下肢肌张力减低,右侧髂腰肌、股四头肌肌力4级,足趾背屈、伸肌肌力3级;左侧髂腰肌、股四头肌肌力3级,足趾背屈、伸肌肌力3-级;双上肢肌力肌张力未见异常。闭目难立试验(+),双侧指鼻试验、跟膝胫试验(-)。深浅感觉、复合觉检查未见异常。双侧膝腱反射、跟腱反射未引出,余生理反射未见异常,病理反射未引出。脑膜刺激征、植物神经系统检查未见异常。
1.3 辅助检查 头MRI未见异常,腰椎MRI提示腰椎退行性变。脑脊液检查,压力170 mmH2O,常规、生化、寡克隆带、液基细胞学、病原学培养、脑脊液IgG及IgM均未见异常。神经电生理提示双下肢运动纤维轴索损害,肌电图示延髓、颈、胸、腰骶段4个区域均存在神经源性损害(前角细胞损害可能性大)。左侧腓肠肌活检:符合神经源性损害病理改变。
1.4 诊断、治疗及随访 考虑“运动神经元病”,给予营养神经及对症治疗,症状未见改善出院。电话随访至今,2016 年3月患者不能下地行走;4月不能站立,出现双下肢肌肉萎缩,均匀变细。7月出现双上肢无力,持筷欠稳,能自主进食,上肢肌肉变硬无萎缩,被动屈肘阻力较大且肘关节活动范围减小。发病以来无饮水呛咳、构音障碍、二便障碍等。诊断:FLS。
2 文献复习
查阅文献发现国内外详细报道的FLS患者5例[2-5],与本例见表1。
3 讨论
FLS发病率低,尚缺乏FLS的流行病学研究,但国内外临床研究表明FLS占ALS的2-12.9%[2-3、10]。FLS发病机制尚未明确,在性别构成上与经典ALS不同,FLS男女比例为1~6:1,高于经典ALS的1.5:1[6-7]。FLS性别构成差异提示Y染色体、男性激素在FLS发病过程中可能发挥重要作用。基因研究方面,STRÖM等[11]发现铜锌超氧化物歧化酶(SOD)1的H46R基因突变可导致以下肢症状为主的家族性进展缓慢的ALS,临床表现类似FLS。Guillaume等[3]检测一个青年起病、进展迅速FLS患者的ALS相关基因,发现FUS基因的R521C片段突变,该片段突变是否与青年急进型FLS相关尚有待证实。MENON等[10]采用阈值跟踪经颅磁刺激技术证实与ALS类似,大脑皮质兴奋性增高也是FLS的重要特征,这有助于研究FLS潜在的病理生理及发病机制。
目前国内外大多数学者认为FLS的诊断标准首先需满足确诊或很可能级别的ALS诊断,然后按国内外大规模研究的标准进行判断[6-7],诊断要点如下:临床上显著的下肢下运动神经元受累体征,有进行性发展趋势,并以下肢远端的肌无力和肌肉萎缩为特征;在病程中允许出现下肢病理反射或深反射活跃,但不能有下肢肌张力增高或肌阵挛;在下肢下运动神经元体征出现12个月内不能出现明显的上肢或球部下运动神经元体征;仅有下肢近端无力或肌萎缩而不具备下肢远端受累的病例不能诊断为FLS。
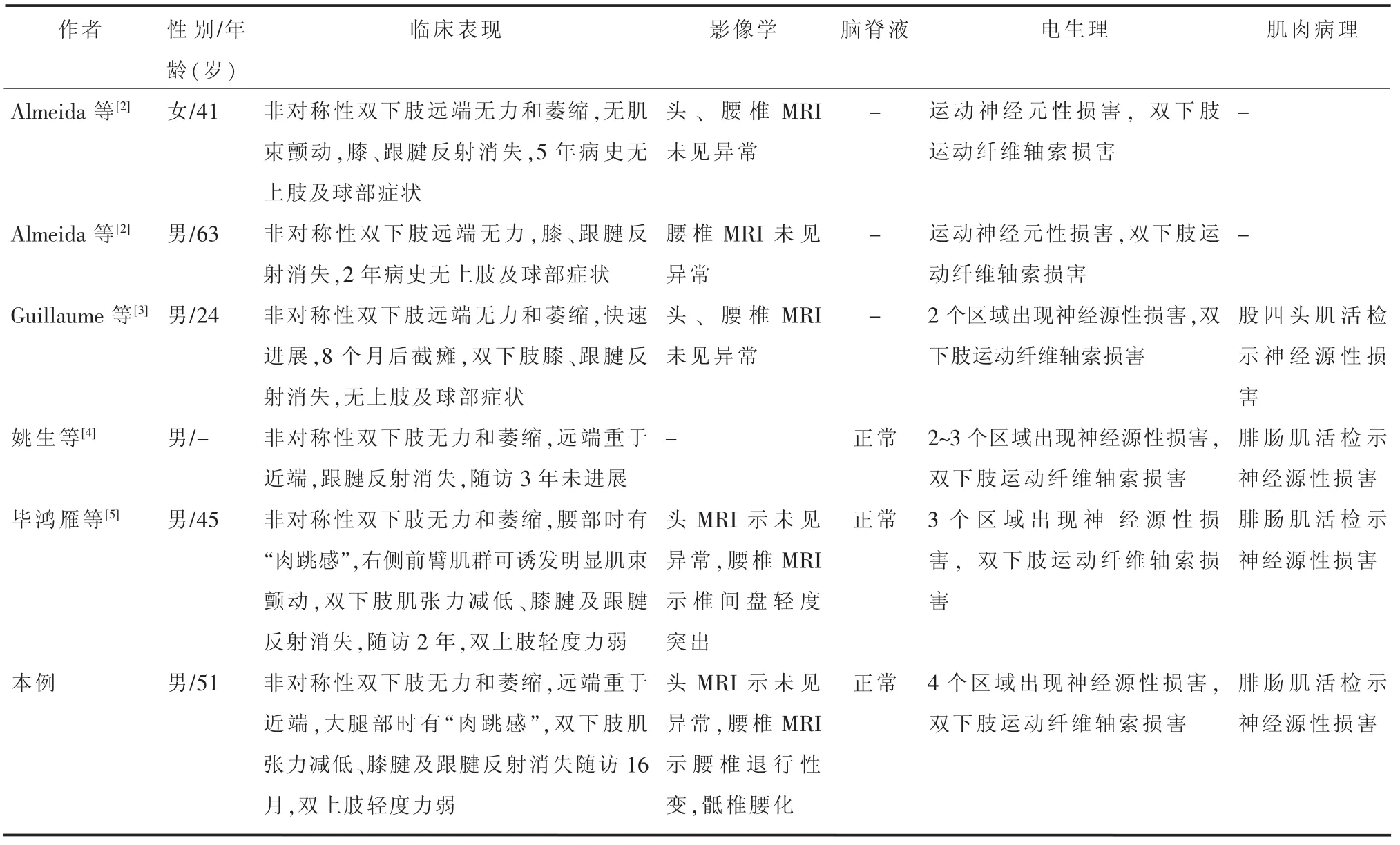
表1 既往文献报道及本例FLS患者临床资料
本例患者以双下肢下运动神经元损害起病,远端重于近端,逐渐出现双下肢肌肉萎缩。早期易误诊为周围神经病,给予营养神经及对症处理后,病情无改善而呈进行性发展,此时临床工作者应警惕FLS。晚期累及双上肢出现肌力减退、肌张力增高等上运动神经元体征,其分布不与下运动神经元体征在同一区域,与经典肢体起病的ALS不同[6-7]。研究表明,在首发临床症状后,临床症状向第2个脊髓节段扩展的时间越滞后,生存时间越长,发展速度比经典ALS慢[6-7、10]。本例患者在发病第25个月出现上肢受累表现,未见球部受累,症状从发病节段向第2个脊髓节段发展的时间较国内外报道的平均时间稍短。肌电图示延髓、颈、胸、腰骶部4个区域均见神经源性损害,较国内外FLS报道的2~3个区域受累为多[3-7]。资料示肌电图受累节段越多,临床症状向第2个脊髓节段扩展的时间越快,两者相关性仍需更多临床研究予以证实。患者头颅、腰椎MRI及脑脊液检查结果未见明显异常,主要用于排除其他疾病;腓肠肌活检病理符合神经源性损害特点,这与国内报道一致[4-5]。
FLS应注意鉴别以下疾病:①远端型脊肌萎缩症(distal spinal muscular,dSMA)是一种由脊髓前角运动神经元退行性变引起的神经系统遗传性疾病。dSMA以常染色体显性遗传为主,具有显著的遗传异质性。以四肢远端肌肉无力和萎缩为特征,腱反射减退或消失。神经电生理提示感觉和运动神经传导均正常,肌电图示神经源性损害;肌肉活检示失神经改变。本例患者无家族遗传史,以下肢远端无力为主,上肢受累轻微;且神经传导提示双下肢运动纤维轴索损害,故予排除。②多灶性运动神经病(multifocal motor neuropathy,MMN)是一种周围神经受累的疾病,以进行性、非对称性远端肢体无力为特征,感觉正常或轻度受累。上肢比下肢受累早且症状重,尤其是桡、尺、正中神经。电生理检查以持续性、多灶性、部分运动传导阻滞为特点。本例患者以下肢无力为主,上肢受累较轻;电生理检查提示神经源性损害,明显不符。
ALS平均生存期只有3~5年[12],尚缺乏有效治疗手段,一旦确诊给患者及家属带来极大压力和痛苦;而FLS进展相对缓慢,生存时间较长,FLS的诊断有助于减轻患者精神负担,更积极地配合治疗。利鲁唑是目前唯一批准的可延长ALS生存时间的药物[13],但价格昂贵,治疗周期长,疗效有限。FLS发病率极低,有关治疗均参考ALS,尚无独立研究。国外有小样本报道,ALMEIDA等[2]用丙种球蛋白、激素治疗2例FLS,发现丙种球蛋白对改善患者肢体无力症状有明显疗效,而激素则效果尚未明确。总之,目前对FLS知之甚少,分析其临床特点有助于临床医生早期识别,为进一步探索FLS的治疗方案提供可能。
[1]樊东升.运动神经元病[M].吴江.神经病学.北京:人民卫生出版社,2010:328-331.
[2]ALMEIDA V,OHAHA B,CARVALHO MD,et al.Patrikios syndrome in two patients with treatable flail-leg weakness[J].J Clin Neurosci,2012,19(2):318-321.
[3]GUILLAUME T,PIERRE L,PAULA AMD,et al.R521C mutation in the FUS/TLS gene presenting as juvenile onset flail leg syndrome[J].Muscle&Nerve,2013,48(6):993-994.
[4]姚生,戚晓昆,刘建国,等.连枷臂(腿)综合征的临床、电生理和病理特点 [J].中国神经免疫学和神经病学杂志,2012, 19(4):266-268.
[5]毕鸿雁,李继海,赵亚明,等.连枷臂(腿)综合征的临床特点(附4例报告)[J].北京医学,2014,36(7):559-561,615.
[6]WIJESEKERA LC,MATHERS S,TALMAN P,et al.Natural history and clinical features of the flail arm and flail leg ALS variants[J].Neurology,2009,72(12):1087-1094.
[7]王丽平,张新宇,张俊,等.连枷臂和连枷腿综合征:临床特征与病程特点 [J].现代预防医学,2011,38(9):1737-1739.
[8]PRUDLO J,BISSBORT C,GLASS A,et al.White matter pathology in ALS and lower motor neuron ALS variants:a diffusion tensor imaging study using tract-based spatial statistics[J]. J Neurol,2012,259(9):1848-1859.
[9]SCHUSTER C,KASPER E,MACHTS J,et al.Focal thinning of the motor cortex mirrors clinical features of amyotrophic lateral sclerosis and their phenotypes:a neuroimaging study[J].J Neurol,2013,260(11):2856-2864.
[10]MENON P,GEEVASINGA N,YIANNIKAS C,et al.Cortical contributions to the flail leg syndrome:Pathophysiological insights[J].Amyotroph Lateral Scler&Frontotemporal Degener, 2016,17(5-6):389-396.
[11]STRÖM AL,SHI P,ZHANG F,et al.Interaction of amyotrophic lateral sclerosis(ALS)-related mutant copper-zinc superoxide dismutase with the dynein-dynactin complex contributes to inclusion formation[J].J Biol Chem,2008,283(33):22795-22805.
[12]ANDERSEN PM,BORASIO GD,DENGLER R,et al.Good practice in the management of amyotrophic lateral sclerosis: Clinical guidelines.An evidence‐based review with good practice points[J].Amyotroph Lateral Scler,2007,8(4):195-213.
[13]Practice advisory on the treatment of amyotrophic lateral sclerosis with riluzole:report of the Quality Standards Subcommittee of the American Academy ofNeurology[J].Neurology,1997,49 (3):657-659.
R744.8 (
2016-11-07)
A (责任编辑:李立)
10.3969/j.issn.1002-0152.2017.02.014
* 广州中医药大学第二临床医学院(广州510405)△广东省中医院神经一科

