AHLs 对小球藻PS Ⅱ光化学活性与光合作用关键酶的影响
窦 勇 姜智飞 张文慧 高金伟 姜 淼 史谢尧 周文礼
(天津农学院水产学院, 天津市水产生态及养殖重点实验室, 天津 300384)
AHLs 对小球藻PS Ⅱ光化学活性与光合作用关键酶的影响
窦 勇 姜智飞 张文慧 高金伟 姜 淼 史谢尧 周文礼
(天津农学院水产学院, 天津市水产生态及养殖重点实验室, 天津 300384)
采用批次培养的方法,研究了100、200和300 nmol/LC10-HSL(N-癸酰-L-高丝氨酸内酯)对普通海水小球藻(Chlorella vulgaris)PSⅡ光化学活性与光合作用关键酶的影响。结果显示:在C10-HSL作用下,小球藻生长受到促进,细胞密度显著升高,而且存在着随C10-HSL浓度上升促进作用增强的剂量-效应关系;小球藻PSⅡ光化学活性指标——最大光能转化效率Fv/Fm、实际光能转化效率Yeild及表观光合电子传递效率ETR明显提高,而且C10-HSL对Yeild的作用强于对Fv/Fm的影响;小球藻光合作用关键限速酶——核酮糖-1,5-二磷酸羧化酶/加氧酶Rubisco、磷酸丙糖异构酶TPI、焦磷酸:果糖-6-磷酸-1-磷酸转移酶PFP、果糖-1,6-二磷酸醛缩酶FDA活性均不同程度上升,表明小球藻光合固碳及合成糖类的能力有所增强。
AHLs; 海水普通小球藻; 光化学活性; 光合作用关键酶
小球藻(Chlorella)是绿藻门的单细胞微藻, 细胞内氨基酸、维生素、糖蛋白等含量丰富, 它在水产养殖、生物能源生产和功能型保健食品开发领域有广泛的应用。另外小球藻对高盐和高浓度抗生素有较强的耐受性, 而且可以利用外源营养进行异养生长, 具备良好的培养特性, 因此被看做一种极具开发价值的资源生物[1,2]。
藻际环境中常存在着大量共栖细菌, 这些细菌在生长过程中会不断分泌一系列次级代谢产物, 这些物质积累超过阈值浓度后会被细菌感知进而启动细胞密度依赖的基因表达, 促使细菌产生独特而多样的生物学功能, 这一现象称为细菌的群感效应(Quorum sensing, QS), 而介导群感效应的细菌代谢产物称为群感信号物质[3], 研究证实微生物的生物发光、聚集生长、胞外多糖的合成与分泌、生物膜的形成都受到群感信号分子的调控[4—7]。群感信号分子主要分为三类, 其中N-酰基-高丝氨酸内酯类化合物(N-acyl-homoserine lactones, AHLs)是革兰氏阴性菌群感系统中最常见的信号物质, AHLs家族成员众多, 其共同点是分子上都含有一个高丝氨酸内酯环, 不同的AHLs分子含有不同的酰化支链且具有不同的生物活性[8], 而目前的研究多集中于N-己酰-L-高丝氨酸内酯(C6-HSL)、N-酮己酰-L-高丝氨酸内酯(OHHL)、N-辛酰-L-高丝氨酸内酯(C8-HSL)、N-癸酰-L-高丝氨酸内酯(C10-HSL)这几种分子上[9—14]。
近年来的研究表明群感信号分子不仅能对细菌自身的生物学功能进行反馈调节, 而且可以介导藻类-微生物的种间相互作用, 徐鲁燕等[15]发现某些海洋细菌产生的C6-HSL和C8-HSL显著抑制了东海原甲藻、赤潮异弯藻生长, 毕相东等[16]指出藻际异养菌产生的C6-HSL会诱导小球藻抗氧化酶系统应激表达, 而另有学者[17,18]证实微藻能通过降解AHLs分子或合成AHLs类似物来干扰共栖细菌的胞间通讯。以往的工作多集中于AHLs对藻类胁迫的负面影响, 对微藻生长的刺激与对光合生理的作用至今鲜见报道。本课题组前期发现藻际共栖细菌Pesudomonas sp.产生的微量C10-HSL可以促进海水普通小球藻Chlorella vulgaris生长, 本研究结合前期工作, 考察了C10-HSL对C. vulgaris细胞密度、PSⅡ光化学活性及光合作用关键酶的影响, 探讨了AHLs促进C. vulgaris生长及影响其光合速率的可能机制, 旨在为优化藻-菌共生系统提供理论依据,同时也为小球藻的集约化健康养殖提供参考。
1 材料与方法
1.1 藻种来源与培养条件
实验用小球藻由中国海洋大学生态学研究室提供, 采用f/2培养液培养, 培养温度(23±1)℃, 光暗比12h:12h, 光强为60 μmol/(m2·s)。培养期间每天摇瓶6次, 防止微藻细胞附壁下沉。选取处于对数生长期的小球藻细胞进行正式实验。
1.2 药品与试剂
N-癸酰-L-高丝氨酸内酯(C10-HSL)标准品购自sigma公司, 原药溶于无水乙醇配制成1 mmol/L的母液, 于4℃保存, 使用时根据实际情况加入无水乙醇配成总体积相同的工作液, 然后加入到不同的小球藻培养液中, 对照组(CK)藻液中加入的乙醇体积与各试验组相同。
1.3 实验体系构建和分析指标系统
根据前期预实验的结果, 将配制好的C10-HSL母液加入到处于对数生长期的100 mL小球藻培养液中, 使其在培养液中的最终浓度为100、200和300 nmol/L, 对照组按照1.2设置。每个实验组设置3个平行, 实验重复3次。在实验开始的0、12h、24h、36h、48h、60h、72h和84h测定各试验组和对照组的小球藻生长指标——细胞密度; PSⅡ光化学活性——PSⅡ最大光能转化效率(Fv/Fm)、PSⅡ的实际光能转化效率(Yeild)、表观光合电子传递效率(ETR); 光合作用关键限速酶——核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)、磷酸丙糖异构酶(TPI)、焦磷酸: 果糖-6-磷酸-1-磷酸转移酶(PFP)、果糖-1,6-二磷酸醛缩酶(FDA)。
1.4 测定方法
小球藻细胞密度测定 接种指数生长期的微藻至新配制的f/2培养液中, 用移液枪吸取等量藻液于血球计数板上, 用Lugol’s碘液固定, 计数细胞密度的变化。
小球藻PSⅡ光化学活性测定 使用德国Walz公司生产的IMAGING-PAM调制脉冲荧光仪测定PSⅡ光化学活性。向比色杯中依次加入3 mL蒸馏水和15 μL藻液, 混匀, 将样品暗适应15min, 读取Fv/Fm、Yeild和ETR数值。
小球藻光合作用关键酶活性测定 每次取样时量取各处理组藻液40 mL在4℃下以6000 r/min离心10min, 取沉淀藻泥加入3 mL生理盐水, 冰浴研磨, 4℃下12000 r/min离心10min, 上清液用于光合作用关键酶活性测定。将每毫克蛋白每分钟氧化1 nmol的NADH定义为1个Rubisco酶活力单位, 将每毫克蛋白每分钟生成1 nmol的NADH定义为1个TPI酶活力单位, 将每毫克蛋白每分钟消耗1 nmol的NADH定义为1个PFP和FDA酶活力单位, 4种酶活力单位均为U/mgprot。所有酶活力分析均采用比色法, 吸光度值使用UV-1240紫外-可见分光光度计测定
1.5 数据处理与分析
所有实验数据均以平均值±标准误(mean±SE)表示。使用SPSS 17.0软件进行单因素方差分析, 并采用Duncan多重比较进行处理组间差异性比较, 处理组间没有相同字母的表示差异显著(P<0.05), 有相同字母的表示差异不显著(P>0.05)。
2 结果
2.1 C10-HSL对小球藻细胞密度的影响
如图 1所示, 随培养时间的延长各试验组小球藻细胞密度均呈不断上升的趋势, 而相较于对照组C10-HSL对小球藻生长具有明显的促进作用, 各实验组的微藻细胞密度呈现显著差异(P<0.05), 说明存在着随C10-HSL浓度升高促进作用增强的剂量-效应关系。在实验的0—36h内小球藻细胞密度升高较快, 此后增加速率有所降低, 说明C10-HSL对微藻生长的促进作用有随时间衰减的特征。在培养期间, 3个C10-HSL处理组微藻细胞密度和增加速率均明显高于对照组, 至实验结束时100、200和300 nmol/L处理组的小球藻细胞密度已经分别达到426×105、464×105和522×105cells/mL, 较各组起始密度分别提高了1.71、1.95和2.32倍。
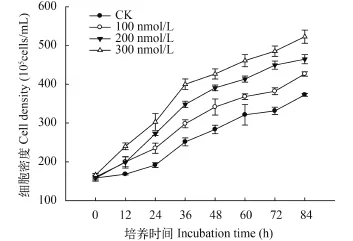
图 1 C10-HSL对小球藻细胞密度的影响Fig. 1 The effect of C10-HSL on cell density of Chlorella vulgaris
2.2 C10-HSL对小球藻PSⅡ光化学活性的影响
C10-HSL对小球藻Fv/Fm的影响 Fv/Fm为最大量子产量, 反映了植物PSII潜在最大光合能力,有研究表明环境条件改变时微藻Fv/Fm会发生显著变化[19,20]。如图 2所示, 实验进行过程中各试验组Fv/Fm呈不断上升的趋势, 同时相较于对照组C10-HSL处理明显促进了小球藻Fv/Fm的提高, 且表现出C10-HSL浓度越高促进作用越强的规律。在实验期间,对照组小球藻Fv/Fm变化幅度很小, 表现出微藻自然生长状态下Fv/Fm维持相对稳定的特征。C10-HSL处理组小球藻Fv/Fm均明显高于对照组, 而且不同浓度的C10-HSL对微藻Fv/Fm的影响规律近乎一致,均呈现出0—48h缓慢上升, 48—84h快速上升的变化趋势。至实验结束时, 100、200和300 nmol/L处理组的小球藻Fv/Fm已经分别达到0.72、0.75和0.76, 较各组起始数值分别提高了18.03%、22.95%和24.59%。结果说明, C10-HSL处理有助于PSII光合反应中心活性的发挥, 显著增强了小球藻的潜在最大光合能力。
C10-HSL对小球藻Yeild的影响 Yeild为实际光化学量子产量, 反映植物PSII在部分关闭情况下的实际原初光能捕获效率。如图 3所示, 培养期间各试验组Yeild呈单调上升的变化趋势, 而相较于对照组C10-HSL对小球藻Yeild提高具有明显的促进作用, 且显示出C10-HSL浓度越高促进作用越强的特性, 说明C10-HSL增强了小球藻PSII的实际光合能力。在实验过程中, C10-HSL处理组小球藻Yeild均明显高于对照组, 而且不同浓度的C10-HSL对微藻Yeild的影响规律近乎一致, 均表现出0—24h快速上升, 24—36h缓慢变化, 36h之后继续快速提高的变化趋势。至实验结束时, 100、200和300 nmol/L处理组的小球藻Yeild已经分别达到0.45、0.46和0.47, 较各组起始数值分别提高了25.00%、27.77%和30.56%。另外, 通过比较实验期间处理组Yeild和Fv/Fm的增量变化, 发现C10-HSL处理后小球藻Yeild变化幅度高于Fv/Fm, 说明C10-HSL对微藻实际光合能力的影响强于对其最大光合潜力的作用。
C10-HSL对小球藻ETR的影响 ETR为表观光合电子传递速率, 是反映植物PSII反应中心活性与光合电子传递效率强弱的一个重要指标, 其数值与光强、植物吸收入射光和能量分布比例以及光子通量密度有关。如图 4所示, 各试验组ETR随培养时间延长不断上升, 同时与对照组相比C10-HSL处理明显促进了小球藻ETR的升高, 且C10-HSL浓度越高促进作用越强。培养期间, C10-HSL处理组小球藻ETR均明显高于对照组, 但是处理组间差异并不显著。另外与Fv/Fm和Yeild的变化趋势不同,小球藻ETR在实验初期即0—24h时上升幅度最大,此后ETR增加率逐渐趋于平稳。微藻PSII反应中心吸收光能后激发电子, 然后通过光合电子传递链将高能电子向其他受体传递, 电子传递速率和传递通路的情况直接决定了光合作用后续反应的进程[21]。结果表明, C10-HSL有助于小球藻PSII反应中心活性的发挥, 同时对保证光合电子传递效率也有一定的积极作用。
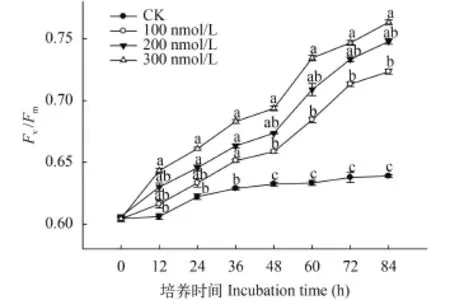
图 2 C10-HSL对小球藻Fv/Fm的影响Fig. 2 The effect of C10-HSL on Fv/Fmof Chlorella vulgaris
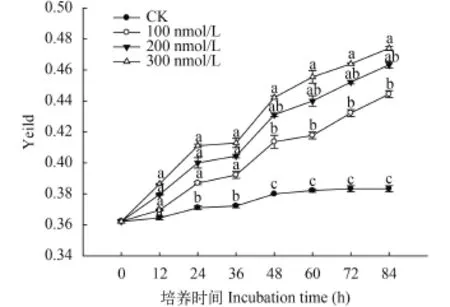
图 3 C10-HSL对小球藻Yeild的影响Fig. 3 The effect of C10-HSL on Yeild of Chlorella vulgaris
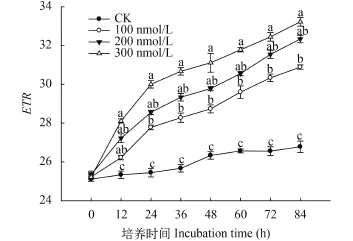
图 4 C10-HSL对小球藻ETR的影响Fig. 4 The effect of C10-HSL on ETR of Chlorella vulgaris
2.3 C10-HSL对小球藻PSⅡ光合作用关键酶活性的影响
C10-HSL对小球藻Rubisco活性的影响 Rubisco是光合作用中最重要的酶之一, 既控制着CO2的固定, 同时又制约着碳向calvin循环和光呼吸过程的分流, 其活性大小直接影响着光合速率。如图 5所示, 在实验过程中Rubisco活性呈不断上升的趋势, 而C10-HSL处理明显促进了Rubisco活力, 且C10-HSL浓度越高促进作用越强, 另外C10-HSL对Rubisco活力诱导的增长率也随时间延长不断提高, 实验初始阶段Rubisco活力上升缓慢, 到达48h时出现拐点, 此时各实验组酶活存在显著差异(P<0.05), 100、200和300 nmol/L处理组的酶活力分别达到5.99、7.80和10.76 U/mg prot, C10-HSL影响Rubisco活力的剂量-效应特征充分显现, 此后小球藻Rubisco活力迅速升高, 光合固碳能力迅速增强。至实验结束, C10-HSL处理组的小球藻Rubisco活力分别达到14.92、20.94和29.23 U/mg prot, 为对照组的1.43、2.01和2.80倍。Rubisco良好的活性保证了微藻光合固碳生产有机物的能力, 也为种群的发展提供了物质基础[22], 实验中小球藻细胞密度与Rubisco活力近乎一致的变化趋势很好的印证了这一点, 而C10-HSL促进了这种共变关系的发展。
C10-HSL对小球藻TPI活性的影响 TPI是光合作用中参与calvin循环的关键酶, 催化磷酸甘油醛和磷酸二羟丙酮之间的转化, 磷酸二羟丙酮可以穿越叶绿体膜进入胞浆, 并在其中逐步转化为蔗糖, 因此TPI是调控植物糖类合成的限速酶之一。如图 5所示, 实验过程中TPI活性持续升高, 而C10-HSL处理明显促进了酶活力, 且C10-HSL浓度越高促进作用越强。与Rubisco相比TPI活性随时间上升的速率较为缓慢, 60h时100、200和300 nmol/L处理组酶活力分别为1.65、2.90和4.46 U/mg prot, 仅比初始水平提高了1.59、2.26和3.96倍, 此后酶活增速加快直至实验结束达到峰值, 这时C10-HSL处理组酶活力分别达到4.41、9.95和11.71 U/mg prot, 较初始数值提高了5.89、10.18和12.01倍。实验中C10-HSL明显促进了小球藻TPI活力的持续升高, 说明C10-HSL有助于增强微藻合成糖类的能力。
C10-HSL对小球藻PFP活性的影响 PFP催化果糖-6-磷酸与果糖-1,6-二磷酸之间的可逆转化,是光合作用碳代谢过程的关键酶。如图 7所示, 各组小球藻PFP活性随培养时间延长出现先升高后降低的趋势, 在实验的48h时PFP活性出现峰值。与对照相比C10-HSL处理可以明显增强微藻PFP活力,且C10-HSL浓度越高促进作用越强。在实验的0—24h酶活力变化速率较低, 在36h时开始迅速上升,尤其是300 nmol/L处理组PFP活力已经达到14.46 U/ mg prot, 为对照的4.42倍。培养到48h时PFP活性达到峰值, 100、200和300 nmol/L处理组的酶活力分别为8.64、12.05和17.54 U/mg prot, 较起始阶段分别提高了4.53、7.43和10.24倍。此后酶活性迅速下降, 在实验结束时PFP活性达到最低值, C10-HSL处理组的酶活仅为0.93、1.62和2.20 U/mg prot, 较峰值分别下降了89%、86%和87%。果糖-6-磷酸与果糖-1,6-二磷酸是光合作用不同反应阶段的底物和产物, 二者作用的双重性决定了它们在细胞中的含量与转化必须达到合适的平衡[23], 实验中PFP活力先升高后降低的趋势反映了微藻细胞中果糖-6-磷酸与果糖-1,6-二磷酸转化速率的变化, 峰值则代表了二者相对含量平衡点的位置, 结果显示C10-HSL明显提高了PFP活力的变动幅度和峰值, 表明C10-HSL的作用影响了果糖-6-磷酸与果糖-1,6-二磷酸的转化速率和平衡点。
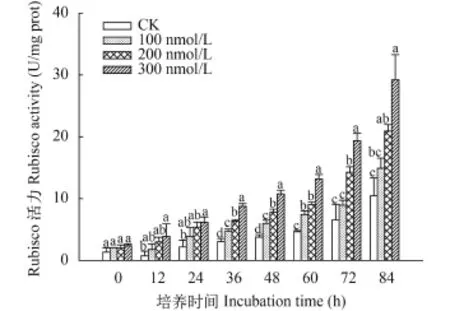
图 5 C10-HSL对小球藻Rubisco活力的影响Fig. 5 The effect of C10-HSL on Rubisco of Chlorella vulgaris
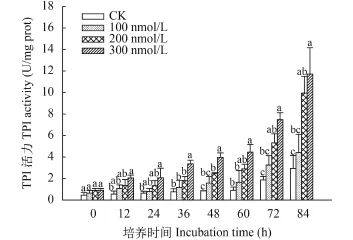
图 6 C10-HSL对小球藻TPI活力的影响Fig. 6 The effect of C10-HSL on TPI of Chlorella vulgaris
C10-HSL对小球藻FDA活性的影响 FDA
是参与磷酸戊糖途径和calvin循环的重要酶, 催化果糖-1,6-二磷酸和景天庚酮糖-1,7-二磷酸的合成反应, 是细胞能量代谢的关键限速酶之一。与PFP活性变化类似, 小球藻FDA活力随培养时间延长呈先升高后降低的趋势, 酶活性峰值出现在实验的60h时, 较PFP相对滞后(图 8)。与对照相比处理可以明显增强微藻FDA活力, 且C10-HSL浓度越高促进作用越强。在实验初始阶段FDA即表现较高的活性水平, 此后酶活力稳步上升直至达到峰值, 此时C10-HSL处理组的FDA活力分别为15.66、18.87和24.69 U/mg prot, 较起始阶段分别提高了5.53、6.15和11.47倍。此后酶活性缓慢回落, 实验结束时C10-HSL处理组PFP活力为5.05、8.65和10.04 U/mg prot, 较峰值分别下降了68%、54%和59%。果糖-1,6-二磷酸是光合磷酸化过程的重要参与者, 景天庚酮糖-1,7-二磷酸是光合固碳反应中CO2受体核酮糖-1,5-二磷酸的前体, 二者的合成速率对光合反应进程有重要影响[24], 实验中PFP活力的波动反映了微藻细胞中光合磷酸化与CO2固定速率的变化, 而C10-HSL明显提高了FDA活性的变动幅度和峰值,说明C10-HSL的作用影响了小球藻光合磷酸化与CO2固定的过程。

图 7 C10-HSL对小球藻PFP活力的影响Fig. 7 The effect of C10-HSL on PFP of Chlorella vulgaris
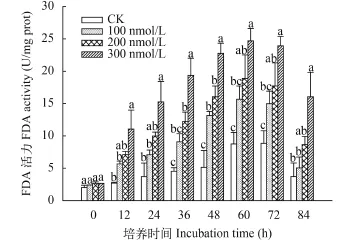
图 8 C10-HSL对小球藻FDA活力的影响Fig. 8 The effect of C10-HSL on FDA of Chlorella vulgaris
3 讨论
以往的研究多把AHLs看做藻类生长的胁迫因子, 在其作用下藻类生长及一系列正常生理指标受到抑制[25—27]。与此不同的是, 本研究发现微量C10-HSL促进了普通海水小球藻生长, 显著提高了微藻细胞密度(P<0.05), 这与Rivas等[28]证实的藻际共栖菌Pseudomonas sp.和Rhizobium sp.产生的C6-HSL会显著提高布朗葡萄藻Botryococcus braunii生物量的结论相吻合。由于微藻主要依靠光合作用来积累生物量并发展种群, 因此微量C10-HSL提高小球藻细胞密度的原因很有可能就在于AHLs对微藻光合生理的促进。有文献[29]指出, 在正常状态下藻类的最大量子产量Fv/Fm值稳定在0.65左右, 当受到环境胁迫时该值会显著下降, 而在本研究中小球藻的Fv/Fm值处于0.60—0.77, 且表现出随C10-HSL浓度升高Fv/Fm增大的趋势, 说明C10-HSL对小球藻最大潜在光合能力的提高起到了促进作用, 而非胁迫影响。另外决定光合速率的关键限速酶Rubisco在C10-HSL作用下活性显著上调, 进一步在酶学水平上证明了C10-HSL对小球藻光合生理过程的促进作用。需要指出的是植物光合作用是由许多代谢过程构成的复杂反应网络, 本研究只是考察了AHLs对其中几个重要节点反应的作用, 因此并不能把握AHLs影响光合生理的全貌, 所以后续的研究应朝着高通量全局分析的方向发展。
另外AHLs家族的不同分子及处理浓度对其生物活性的发挥存在很大差异, 毕相东[30]发现在400 nmol/L的C6-HSL胁迫下小球藻PSII的D1蛋白表达量显著下调, 而烯醇酶的表达量显著上调, 表明C6-HSL在损伤微藻细胞光合机构的同时加强了其厌氧呼吸速率, 周丽娟等[31]证实10—80 μmol/L的α-氨基-γ-丁内酯氢溴酸(AHLs的一种)可以明显抑制铜绿微囊藻Microcystis aeruginosa和集胞藻Synechocysti sp.的生物量及蛋白表达, 以上结果均与本研究的结论不同, 但也从另一方面说明AHLs的生物活性取决于其分子结构、作用浓度及作用对象, 因此摸索不同AHLs对资源微藻的生物活性差异有助于优化藻-菌共生系统, 同时也可以为微藻的集约化健康养殖提供参考, 本研究的结果说明C10-HSL (有效作用浓度300 nmol/L)有成为养殖环境中小球藻生长促进剂的潜力。
有研究[8]表明AHLs介导的LuxI/LuxR双元件系统是革兰氏阴性菌群感信号途径的物质基础, 该系统调控着微生物的种群动态和代谢生理, 其中AHLs发挥了类似转录因子的作用, 但目前AHLs影响藻类生理的机制尚不明晰, AHLs分子是否同样作为转录因子类似物影响藻类相关基因的表达进而影响其生理代谢的强度和途径的疑问至今未得到圆满回答, 所以在基因转录和表达水平上探讨AHLs对藻类生理过程的作用机制应该作为未来研究的重要方向。
4 结论
(1) 在100、200和300 nmol/L C10-HSL作用下,小球藻生长受到促进, 细胞密度显著升高, 而且存在着随C10-HSL浓度上升促进作用增强的剂量-效应关系。(2) 在C10-HSL作用下小球藻PSⅡ光化学活性指标——最大光能转化效率Fv/Fm、实际光能转化效率Yeild及表观光合电子传递效率ETR明显提高, C10-HSL对Yeild的作用强于对Fv/Fm的影响。(3) 小球藻光合作用关键限速酶——核酮糖-1,5-二磷酸羧化酶/加氧酶Rubisco、磷酸丙糖异构酶TPI、焦磷酸: 果糖-6-磷酸-1-磷酸转移酶PFP、果糖-1,6-二磷酸醛缩酶FDA活性均不同程度上升, 表明小球藻光合固碳及合成糖类的能力有所增强。
[1]Liu J H, Yang H S, Wang H. Combined effects of temperature, salinity and pH on the specific growth rate of Chlorella [J]. Acta Hydrobiologica Sinica, 2014, 38(3): 446—453 [刘加慧, 杨洪帅, 王辉. 温度、盐度和pH对小球藻生长率的联合效应. 水生生物学报, 2014, 38(3): 446—453]
[2]Shi X, Luo Z, Huang C, et al. Effect of substituting Chlorella sp. for regular fishmeal on growth, body composition, hepatic lipid metabolism and histology in crucian carp Carassius auratus [J]. Acta Hydrobiologica Sinica, 2015, 39(3): 498—506 [石西, 罗智, 黄超, 等. 小球藻替代鱼粉对鲫生长、体组成、肝脏脂肪代谢及其组织学的影响. 水生生物学报, 2015, 39(3): 498—506]
[3]Fuqua W C, Winans S C, Greenberg E P. Quorum sensing in bacteria: the LuxR-LuxI family of cell density responsive transcriptional regulators [J]. Journal of Bacteriology, 1994, 176(2): 269—275
[4]Paerl H W, Pinckney J L. A mini-review of microbial consortia: Their roles in aquatic production and biogeochemical cycling [J]. Microbiology Ecology, 1996, 31(3): 225—247
[5]Ianora A, Boersma M, Casotti R, et al. New trends in marine chemical ecology [J]. Estuaries and Coasts, 2006, 29(4): 531—551
[6]Qian Y P, Lau C S, Dahms U H, et al. Marine biofilms as mediators of colonization by marine macroorganisms: implications for antifouling and aquaculture [J]. Marine Biotechnology, 2007, 9(4): 399—410
[7]Merchant S S, Prochnik E S, Vallon O, et al. The Chlamydomonas genome reveals the evolution of key animal and plant functions [J]. Science, 2007, 318(5848): 245—251
[8]Miller M, Bassler B. Quorum sensing in bacteria [J]. Annual Review of Microbiology, 2001, 55(3): 165—199
[9]Liu B H, Koh P K, Kim S J, et al. The effects of betonicine, floridoside, and isethionic acid from the red alga Ahnfeltiopsis flabelliformis on quorum-sensing activity [J]. Biotechnology and Bioprocess Engineering, 2008, 13(4): 458—463
[10]Xu L Y. Preliminary study on the algicidal activity of commensalism bacteria associated with marine microalgae and genes related with quorum-sensing effects [D]. Qingdao: The First Institute of Oceanography, SOA. 2013 [徐鲁燕. 海洋微藻共栖细菌抑藻活性及群体感应相关基因的初步研究. 青岛: 国家海洋局第一海洋研究所. 2013]
[11]Priha O, Virkajarvi V, Juvonen R, et al. Quorum sensing signalling and biofilm formation of brewery-derived bacteria, and inhibition of signaling by natural compounds [J]. Current Microbiology, 2014, 69(5): 617—627
[12]Hou B L, Li A J, Sun Q. The effect of N-acy-homoserine lactones mediated quorum-sensing on the adhesion growth and nitrification of nitrifying sludge [J]. Acta Scientiae Circumstantiae, 2015, 35(9): 2773—2779 [侯保连, 李安婕, 孙趣. AHLs群体感应信号分子对硝化污泥附着生长及硝化效果的影响. 环境科学学报, 2015, 35(9): 2773—2779]
[13]Pande S G, Natrah M F, Flandez V A, et al. Isolation of AHL-degrading bacteria from micro-algal cultures and their impact on algal growth and on virulence of Vibrio campbellii to prawn larvae [J]. Applied Microbiology and Biotechnology, 2015, 99(24): 10805—10813
[14]Teplitski M, Chen H C, Rajamani S, et al. Chlamydomonas reinhardtii secretes compounds that mimic bacterial signals and interfere with quorum sensing regulation in bacteria [J]. Plant Physiology, 2004, 134(1): 137—146
[15]Xu L Y, Zheng L, Han X T, et al. Screening of microalgae associated bacteria with quorum sensing system and their algicidal activity [J]. Oceanologia et Limnologia Sinica, 2012, 43(6): 1149—1155 [徐鲁燕, 郑立, 韩笑天,等. 具有群体感应系统微藻共栖细菌的筛选及抑藻活性的研究. 海洋与湖沼, 2012, 43(6): 1149—1155]
[16]Bi X D, Zhou W L, Xing K Z, et al. Effects of AHLs (N-hexanoyl-DL-homoserine lactone, C6-HSL) on growth and antioxidant defense system of Chlorella vulgaris [J]. Marine Environmental Science, 2012, 31(6): 897—900 [毕相东, 周文礼, 邢克智, 等. AHLs信号分子对小球藻生长及抗氧化酶系统的影响. 海洋环境科学, 2012, 31(6): 897—900]
[17]Natrah M F, Defoirdt T, Sorgeloos P, et al. Disruption of bacterial cell-to-cell communication by marine organisms and its relevance to aquaculture [J]. Marine Biotechnology, 2011, 13(2): 109—126
[18]Wietz M, Duncan K, Patin V N, et al. Antagonistic interactions mediated by marine bacteria: the role of small molecules [J]. Journal of Chemical Ecology, 2013, 39(7): 879—891
[19]Zhang H, Zhang G Y, Wen X B, et al. Effect of pH on thephotosynthesis, growth and lipid production of Chlorella sp. XQ-200419 [J]. Acta Hydrobiologica Sinica, 2014, 38(6): 1084—1091 [张虎, 张桂艳, 温小斌, 等. pH对小球藻Chlorella sp. XQ-200419光合作用、生长和产油的影响. 水生生物学报, 2014, 38(6): 1084—1091]
[20]Wen X, Liu B N, Zhou C X, et al. Characterization of anti-predator abilities of Pleurochrysis carterae [J]. Acta Ecologica Sinica, 2016, 36(2): 525—534 [文欣, 刘宝宁,周成旭, 等. 颗石藻Pleurochrysis carterae抗捕食特征.生态学报, 2016, 36(2): 525—534]
[21]Xu X L, Song X K, Yue R, et al. Effects of nitrogen limitation on photosystem Ⅱ photochemistry reaction in diatom Phaeodactylum tricornutum [J]. Chinese Journal of Ecology, 2016, 35(1): 183—188 [徐兴莲, 宋熙坤, 岳瑞,等. 氮限制对硅藻三角褐指藻光系统Ⅱ光化学反应的影响. 生态学杂志, 2016, 35(1): 183—188]
[22]Xia S, Wan W L, Li A F, et al. Effects of nutrients and light intensity on the growth and biochemical composition of a marine microalga Odontella aurita [J]. Chinese Journal of Oceanology and Limnology, 2013, 31(6): 1163—1173
[23]Wang G X, Roux B, Feng F, et al. The decoy substrate of a pathogen effect and a pseudokinase specify pathogeninduced modified-self recognition and immunity in plants [J]. Cell Host & Microbe, 2015, 18(3): 285—295
[24]Ding C C, Xu N J, Zhang L, et al. Effects of salicylic acid on growth and stress-related genes of Chlorella pyrenoidosa [J]. Oceanologia et Limnologia Sinica, 2015, 46(6): 1451—1460 [丁聪聪, 徐年军, 张琳, 等. 水杨酸对蛋白核小球藻(Chlorella pyrenoidosa)生长及抗逆相关基因的影响. 海洋与湖沼, 2015, 46(6): 1451—1460]
[25]Syrpas M, Ruysbergh E, Blommaert L, et al. Haloperoxidase mediated quorum quenching by Nitzschia cf pellucida: study of the metabolization of N-acyl homoserine lactones by a benthic diatom [J]. Marine Drugs, 2014, 12(1): 352—367
[26]Zhou W L, Xiao H, Wang Y, et al. A study on the interaction between Chlorella vulgaris and heterotrophic bacteria in phycosphere [J]. Transactions of Beijing Institute of Technology, 2008, 28(7): 643—647 [周文礼, 肖慧, 王悠, 等. 小球藻与2株藻际异养细菌相互作用的研究. 北京理工大学学报(自然科学版), 2008, 28(7): 643—647]
[27]Bi X D, Xing K Z, Zhou W L, et al. Detection of acylated homoserine lactone (AHL) in the heterotrophic bacteria Z-TG01 and its ecological action on the algae, Chlorella vulgaris [J]. The Israeli Journal of Aquaculture-Bamidgeh, 2012, 64(404): 776—782
[28]Rivas O M, Vargas P, Riquelme E C. Interactions of Botryococcus braunii cultures with bacterial biofilms [J]. Microbial Ecology, 2010, 60(3): 628—635
[29]Liu K. In situ photosynthesis of immobilized Chlorella sorokiniana Gxnn01 and removal of nitrogen and phosphorus from waste water [D]. Tianjin: Tianjin University of Science & Technology, 2012 [刘凯. 固定化小球藻的原位光合作用及其对废水中无机氮磷的影响. 天津: 天津科技大学. 2012]
[30]Bi X D. Ecological effects between Chlorella vulgaris and dominant associated heterotrophic bacteria and response to quorum sensing signal molecules [D]. Qingdao: Ocean University of China. 2013 [毕相东. 小球藻与优势共栖异养菌间的相互作用及其对细菌群体感应信号分子的响应. 青岛: 中国海洋大学. 2013]
[31]Zhou L J, Chen X L, Wang B, et al. The effects of exogenous AHLs on the growth and metabolism of bluegreen algae [J]. Journal of Yunnan University, 2007, 29(3): 303—307 [周丽娟, 陈小兰, 王波, 等. 外源AHLs信号物质对蓝藻生长代谢的影响. 云南大学学报(自然科学版), 2007, 29(3): 303—307]
EFFECTS OF AHLS ON PSⅡ PHOTOCHEMISTRY ACTIVITY AND PHOTOSYNTHESIS CRUCIAL ENZYMES OF CHLORELLA VULGARIS
DOU Yong, JIANG Zhi-Fei, ZHANG Wen-Hui, GAO Jin-Wei, JIANG Miao, SHI Xie-Yao and ZHOU Wen-Li
(Tianjin Key Lab for Aquaculture Ecology and Cultivation, Fisheries College of Tianjin Agriculture University, Tianjin 300384, China)
As an excellent resource microalgae, Chlorella has wide applications for aquaculture, production of biofueland development of functional food, which requires to develop the intensive cultivation pattern and optimize the breeding environment of Chlorella. AHLs(N-acyl-homoserine lactones)are known as the quorum sensing signal molecule produced by commensalism bacteria in phycosphere to regulate the biological function of bacteria and life activities of algae. This study was conducted to evaluate the effects of 100, 200, 300 nmol/LC10-HSL (N-decanoyl-L-homoserine lactones) on PS photochemistry activity and photosynthesis crucial enzymes of the marine microalgae Chlorella vulgaris in the photoautotrophic culture process. The results indicated that C10-HSL significantly increased the growth of C. vulgaris by enhanced cell density in dosage-dependent pattern. PS photochemistry activity indicators—Fv/Fm(maximal photochemical efficiency), Yeild (actual photochemical efficiency) and ETR (apparent photosynthetic electron transport ratio) increased obviously by C10-HSL. C10-HSL had higher effect on Yeild than Fv/Fm. The photosynthesis crucial enzymes—Rubisco (ribulose bisphosphate carboxylase oxygenase), TPI (triose-phosphate isomerase), PFP (pyrophosphate: fructose-6-phosphate-1-phosphoric acid transferase) and FDA (fructose-1,6-bisphosphate aldolase) induced significantly by C10-HSL, indicating enhanced photosynthetic carbon fixation and carbohydrate synthesis.
AHLs; Marine Chlorella vulgaris; Photochemistry activity; Photosynthesis crucial enzymes
X173
A
1000-3207(2017)03-0629-08
10.7541/2017.80
2016-06-16;
2016-10-17
天津市应用基础与前沿研究计划重点项目(13JCZDJC29300); 农业部南海渔业资源开发利用重点实验室开放基金(FREU2015-04); 天津农学院科学研究计划项目(2013NO8)资助 [Supported by the Key Projects of Applied Basic and Frontior Technology Research of Tianjin (13JCZDJC29300); Fund of Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization, Ministry of Agriculture, P. R. China (FREU2015-04); Scientific Research Plan Program of Tianjin Agricultural University (2013NO8)]
窦勇(1985—), 男, 山东淄博人; 博士, 讲师; 主要从事微藻生理生态学研究。E-mail: douyonghero@163.com
周文礼, E-mail: saz0908@126.com

