秀丽高原鳅种群生存力分析及最小可存活种群数估算
武祥伟李光华毕保良于虹漫孔令富冷 云张 宇姜志武
(1. 云南农业大学动物科学技术学院, 昆明 650601; 2. 云南省渔业科学研究院, 昆明 650111;
3. 云南农业大学农学与生物技术学院, 昆明 650201; 4. 云南华电鲁地拉水电有限公司, 昆明 650228)
秀丽高原鳅种群生存力分析及最小可存活种群数估算
武祥伟1李光华2毕保良1于虹漫3孔令富1冷 云2张 宇4姜志武4
(1. 云南农业大学动物科学技术学院, 昆明 650601; 2. 云南省渔业科学研究院, 昆明 650111;
3. 云南农业大学农学与生物技术学院, 昆明 650201; 4. 云南华电鲁地拉水电有限公司, 昆明 650228)
秀丽高原鳅(Triplophysa venusta)系金沙江的土著种, 是云南省重要保护鱼类; 由于其栖息水域建设水电站, 加之云南连年干旱, 导致其种群数量锐减。采用漩涡模型对不同生境下的秀丽高原鳅种群生存力进行了模拟分析, 并估算了其最小可存活种群数。结果表明: 灾害是影响种群长期存活的关键因子, 种群繁殖率和性未成熟个体死亡率对种群生存力影响较大, 而种群的环境容纳量大小则无显著影响; 若连续进行40年的成鱼捕获(2000尾/年), 可使种群在100年内的灭绝概率增至100%, 而若连续进行20年的人工增殖放流(1000尾1龄鱼/年), 可使100年内的灭绝概率降至35.8%。通过模拟计算, 使种群在当前生境下以95%的概率存活100年所需的最小种群数为16000尾。由此可见, 减少灾害发生频率、降低性未成熟个体死亡率、增加繁殖率以及进行人工增殖放流是秀丽高原鳅种群保护与恢复的有效措施。研究为秀丽高原鳅种群保护、渔政管理与人工增殖放流提供了理论依据。
秀丽高原鳅; 种群生存力; 最小可存活种群; 漩涡模型; 土著鱼类; 金沙江
秀丽高原鳅(Triplophysa venusta)属鲤形目(Cypriniformes)爬鳅科(Balitoridae), 条鳅亚科(Nemacheilinae), 高原鳅属(Triplophysa), 主要分布于云南省鹤庆县的金沙江水系[1]。秀丽高原鳅不仅是高原鱼类多样性的重要组成部分, 而且由于其适应了高原环境特点, 其所属的条鳅亚科是青藏高原鱼类区系的构成主体之一, 对研究青藏高原鱼类区系划分与进化具有重要意义[2]。但由于在秀丽高原鳅栖息地建设水电站, 阻断了种群洄游、破坏了产卵场[3], 加之始于2009年的云南连续干旱, 进一步挤压了种群栖息地空间[4], 导致种群数量急剧减少。目前, 水电站与干旱对鱼类种群存活概率和种群数量的影响机制还不十分明确[5,6], 给种群保护与管理带来了严峻挑战。种群生存力分析(Population viability analysis, PVA)即利用数学模型研究种群动态与种群命运; 它可识别种群变化的生态学过程,发现致危原因, 为鱼类种群变化的机制研究提供可靠依据[7]。此外, 小种群具有较高的灭绝风险, 必须具有一定的个体数量以保证种群长期存活[8]; 最小可存活种群数(Minimum viable population, MVP)即种群长期存活所要求的最少个体数量, 已广泛应用于种群保护与管理中[7,9]。MVP可通过PVA确定[10],漩涡模型是进行PVA分析的常用数学模型[11,12]。该模型全面概括了种群统计、环境、遗传与灾害,引入种群密度制约、年龄结构、性别比例与繁殖体制等因素, 并包含了环境容纳量、人工种群捕获与补充等过程, 最大限度的模拟了种群的真实动态[13]。该模型已应用于多个陆生动物PVA模拟分析中[14—17]。在鱼类中, 江豚(Neophocaena phocaenoides asiaeorientalis)[18]、白鳍豚(Lipotes vexillifer)[19]、中华鲟(Acipenser sinensis)[20]和中甸叶须鱼(Ptychobarbus chungtienensis chungtienensis)[21]亦采用该模型进行了PVA模拟分析。但目前国内还未有关于鱼类种群MVP的报道。
本文采用漩涡模型, 模拟了秀丽高原鳅种群在不同生境下的种群生存力, 并估算了最小可存活种群数。本研究将为秀丽高原鳅种群的保护、渔政管理和人工增殖放流提供理论参考依据。
1 材料与方法
1.1 材料
2013年3月—2014年2月, 对分布于云南省鹤庆县漾弓江流域清水河的秀丽高原鳅进行了12次调查采样, 每次均捕捞位于秀丽高原鳅栖息地100°11′03.88″E 26°37′28.63″N与100°11′04.99″E 26°37′22.16″N之间约200 m河道内的鱼类样本。采用网捕等方法获得标本568尾, 随机抽取258尾, 测量体重、全长、体长等, 并解剖辨识性别、性腺发育程度、怀卵量等。
1.2 PVA分析模型与参数设置
采用漩涡模型与Vortex (version 9.99)软件[22]分析秀丽高原鳅种群生存力。根据秀丽高原鳅种群当前生境条件, 并结合数据输入的要求, 确定漩涡模型参数。
1.3 PVA模拟分析
根据种群当前生境条件与未来发展趋势, 设置6种情景, 模拟分析秀丽高原鳅种群在未来100年内的种群生存力; 并采用双尾t-检验, 分析不同情景下的种群增长率和种群数量与基础值(即当前生境下的种群生存力)的差异显著性。
死亡率变化: a. 0—1龄个体死亡率降低5%; b.性未成熟个体死亡率降低10%。
灾害变化: c. 无灾害; d. 灾害发生频率降低10%。
环境容纳量变化: e. 环境容纳量增加5%; f. 环境容纳量增加10%。
繁殖率变化: g. 繁殖率提高20%。
捕捞: h. 第10至第49年, 捕捞雌雄成鱼各1000尾/年; i. 第10至第49年, 捕捞雌雄成鱼各1500尾/年; j. 第10至第49年, 捕捞雌雄成鱼各2000尾/年。
个体补充: k. 第1至第20年, 补充1龄雌雄个体各1000尾/年。
1.4 最小可存活种群的定义与估算
在本研究中, MVP定义为以95%的概率健康存活100年所需的最小种群数量, 即种群在95%存活概率下的环境容纳量, MVPK。参考Reed等的报道[23],本研究中MVPK的估算方法为: 分析不同初始种群数量(Initial population size, Ni)在100年内的种群生存力, 当种群存活概率达到95%时Ni即为MVPK。
2 结果
2.1 漩涡模型的参数
在秀丽高原鳅群体中, 雌雄比例通过性腺确定;解剖258尾个体, 其中235尾可辨识性别(表 1)。采用秀丽高原鳅星耳石作为磨片材料, 鉴定个体年龄[24](图 1), 结果显示具有Ⅴ期性腺的最小雌雄个体年龄均为3龄, 最大年龄为8龄; 性成熟雌雄个体分别为71尾与98尾, 性未成熟雌雄个体分别为24尾与42尾, 由此得出雌雄比为1:1.48, 性成熟个体雌雄比为1:1.38, 性未成熟个体雌雄比为1:1.75。根据长期的野外调查(作者在水电站进行秀丽高原鳅人工增殖放流工作), 秀丽高原鳅在栖息地分布密度较低; 漾弓江清水河长约21 km, 在约200 m河段上平均每次采集47尾个体, 因此现存种群数量约为5000尾。采用漩涡模型中的自定义模式, 由Vortex软件计算种群的年龄分布(表 2); 3龄及以上个体为成体, 由此得出成幼比为1:1.56。由于1龄个体捕获几率较小, 易出现统计偏差, 本研究以2龄个体的性比作为受精孵化后的性比, 即雄鱼比例为60%, 雄鱼中参加繁殖的个体占比为51.9%。

表 1 不同采样批次秀丽高原鳅体长与体重的分布Tab. 1 The body length and weight distribution of T. venusta

图 1 秀丽高原鳅耳石磨片与年轮特征(箭头示年轮; A. 7龄, 体长10.60 cm, 体重10.12 g; B. 5龄, 体长9.27 cm, 体重6.16 g)Fig. 1 Sections of the otolith of T. venusta (arrows present annuli; A. 7 years old, 10.60 cm of body length, 10.12 g of body weight; B. 5 years old, 9.27 cm of body length, 6.16 g of body weight)
雌鱼最大怀卵为4500粒; 作者通过秀丽高原鳅人工繁殖实验, 得出其受精率与孵化率分别约为70%与50%; 因此, 1尾雌鱼最多可繁育1570尾初孵仔鱼, 标准差为10%[13]。此外, 生存环境的随机变化易使雌鱼繁殖失败[21]; 野外调查发现, 在当前生境下(干旱、人为捕捞、栖息地遭破坏)种群的繁殖失败率为10%。由于自然条件的限制, 准确计算秀丽高原鳅栖息地的环境容纳量较为困难。漾弓江清水河全长约21 km, 全年平均水面宽度约为3.8 m,平均水深约为0.5 m; 该河流处于高海拔区域, 属于寡营养性水体, 根据野外调查测试, 约1 m3水体可支持1尾秀丽高原鳅存活; 据此计算其环境容纳量约为40000尾。此外, 由于该区域水电站运行、连年干旱等因素导致水面逐步减少, 根据长期观察测算, 漾弓江清水河河宽平均每年缩小约7.6 cm, 据此计算其每年减少2%的水体; 水电站对河流生态系统的影响常在5年内达到稳定状态; 因此, 本文设定未来5年内环境容纳量每年减少2%, 之后处于稳定态。由于现存种群数量较大, 可忽略近交衰退效应[22]。

表 2 秀丽高原鳅种群的年龄分布Tab. 2 Age distribution of T. venusta
较小的环境容纳量易导致繁殖密度制约。P为参加繁殖雌鱼的比例, P (0)与P (K)分别为种群数量接近于0和达到环境容纳量时参加繁殖雌鱼的比例。当种群数量较小时所有性成熟雌鱼均参加繁殖, P (0)等于性成熟雌鱼比例, 即38.9%(表 2)。当达到环境容纳量时, P (K) 等于繁殖雌鱼的比例, 此时, 雌鱼总数N=40000×(1/1.48)=23870; 调查发现,秀丽高原鳅繁殖时间约60d, 平均1d完成繁殖, 1d内可捕获性成熟雌鱼约7尾, 则P (K)=(60×7)/23870= 1.76%。
根据野外调查, 种群中主要存在干旱、疾病与人类影响等3种灾害事件。连年干旱对种群影响较大, 发生频率约为2.5%(约40年/次), 种群繁殖率与存活率均降低60%; 采集的部分个体发生水霉病、烂鳃病、烂尾病等, 调查发现病害发生概率为90%,使种群繁殖率和存活率均下降10%; 种群栖息地人类活动较频繁(修建水坝、筑路、取水等), 发生概率约为90%, 可使种群的繁殖率和存活率均降低40% (表 3)。
根据捕获的各年龄段个体的分布情况, 设定不同年龄段的死亡率, 其中0—1龄个体死亡率由人工繁殖实验得出(表 4)。此外, 由于渔政管理的加强,秀丽高原鳅无捕获和群体补充事件发生。由以上得出漩涡模型参数设置如表 4所示。
2.2 当前生境下的种群生存力
在当前生境条件下, 种群数量达到环境容纳量之前的平均增长率为r = –0.057±0.059, 100年内平均种群数量为1395尾, 灭绝概率为54.8%, 平均灭绝时间为61.4年; 表明100年内种群至少灭绝一次(表 5)。

表 3 灾害种类及其发生概率与影响程度Tab. 3 The catastrophes, their frequencies, and the degree of influence
2.3 不同模拟参数下的种群生存力
在6种生境中, 除环境容纳量变化(表 6, e和f)与捕捞变化(表 6, h和h+d+e)外, 其种群增长率均与基础值呈显著差异(P<0.001或P<0.05); 除环境容纳量变化(表 6, e和f)与捕捞变化(表 6, j+a+b+c)外, 其平均种群数量均与基础值呈显著差异(P<0.001)。

表 4 基于秀丽高原鳅当前生境的漩涡模型中主要参数及其数值Tab. 4 The parameters and their values in VORTEX based on the current habitat of T. venusta

表 5 秀丽高原鳅100年内种群生存力模拟结果Tab. 5 PVA in future 100 years for T. venusta

表 6 不同情景下的秀丽高原鳅种群生存力Tab. 6 The population viability and their comparisons between basic and empirical assumptions
(1)死亡率变化: 降低性未成熟个体的死亡率,可显著提高种群增长率和平均种群数量(P<0.001); 0—1龄个体的死亡率对种群影响最大, 秀丽高原鳅种群的补充群体大小影响种群发展趋势(表 6, a与b; 图 2A)。
(2)灾害变化: 无灾害和灾害发生频率降低10%时, 种群灭绝概率分别为0与1%, 平均种群数量比基础值分别增大3.89倍与6.96倍(表 6, c与d; 图 2B),表明灾害对种群生存力影响显著。
(3)环境容纳量变化: 环境容纳量提高, 种群存活概率与种群数量增加不显著(表 5, e与f), 表明环境容纳量对种群影响不显著(P>0.05); 但与其他参数同步变化时可提高种群生存力(P<0.001; 表 6, f+d; 图 2C)。

图 2 不同情景下秀丽高原鳅种群数量的变化趋势Fig. 2 Population size evolution within 100 years simulated based on 6 scenarios in T. venustaA. 死亡率变化; B. 灾害发生频率变化; C. 环境容纳量变化; D. 繁殖率变化; E. 捕捞变化; F. 补充变化A. morality; B. catastrophe; C. carrying capacity; D. fecundity; E. harvest; F. supplementation
(4)繁殖率变化: 若群体繁殖率提高20%, 种群增长率与种群数量分别增大6.3倍与4.8倍(P<0.001;表 6, g; 图 2D), 表明繁殖率大小对种群生存力影响较显著。
(5)捕捞变化: 当连续40年(第10至第49年)进行2000尾/年的成鱼捕捞, 种群灭绝概率与基础值呈不显著差异(P>0.05), 表明成鱼的死亡率对种群灭绝概率影响较小, 但对种群数量影响显著, 第15年时种群数量已降为0(图 2E)。但若捕捞发生时无灾害发生, 种群增长率和种群数量均显著增加(P<0.001; 表 6, h+c+e), 可平衡捕捞的负面影响。此外,当其他参数不变, 增加捕捞数量, 种群增长率和种群数量迅速降低, 表明捕捞数量也显著影响种群生存力(表 6, h+a+b+c、i+a+b+c和j+a+b+c; 图 2E)。
(6)补充变化: 个体补充可显著提高种群增长率和种群数量(P<0.001), 降低种群灭绝概率(表 6;图 2F)。
2.4 最小可存活种群
当Ni由1000尾增至17000尾, 秀丽高原鳅的种群生存力逐渐提高, 平均种群数量增长先慢后快,而种群存活概率增长较平稳(表 7)。当Ni为16000尾时, 种群存活概率达95%, 种群增长率r=0.014, 100年内平均种群数量为11883尾。因此, 秀丽高原鳅的最小可存活种群数为16000尾。
3 讨论
在当前生境下, 秀丽高原鳅种群在未来100年内的灭绝概率已达54.8%, 是一个较脆弱的群体。灾害是影响种群长期健康存活的主要因素之一, 这与已报道的鱼类种群生存力相一致[18—21]。野外调查也发现秀丽高原鳅种群数量呈快速下降趋势, 这与种群栖息地建设水电站及连年干旱等灾害密切相关。水电站导致鱼类性腺发育、繁殖相关的水文条件消失, 种群繁殖量迅速减少; 水电站还导致种群栖息地大量减少, 种群被迫集中到少数残存的栖息地中, 造成生存空间拥挤, 更易受到人类活动的影响[5]。始于2009年的云南连年干旱亦造成种群栖息地大幅减少, 进一步挤压了秀丽高原鳅的生存空间。灾害是影响种群生存力的关键性因素, 灾害发生频率降低5%即可使种群存活概率从当前的45.2%增至99%。在降低灾害发生频率的同时, 若减少个体死亡率, 则可使种群灭绝概率降至0; 尤其是0—1龄个体, 作为补充群体, 其死亡率减少5%,即可使种群灭绝概率由当前的54.8%降至21.8%,这与已报道的黄腹角雉和黑长臂猿种群生存力相似[16,25]。因此, 在种群保护管理中, 努力降低灾害发生频率、减少个体死亡率将是直接有效的方法。环境容纳量变化对种群增长率无显著影响, 但已有的研究表明增加环境容纳量可显著提高种群基因杂合度, 以应对环境的随机变化、补偿遗传漂变的损失[25,26], 对种群的长期发展有利。人为捕获数量的变化对种群数量影响较大, 年捕获数量越多种群灭绝概率越大, 即使捕获的同时灾害发生频率降低10%, 平均种群数量也降为0。个体补充可显著提高种群增长率(P<0.05), 并且当与其他参数组合变化时, 如降低个体死亡率或灾害发生频率, 可使未来100年内的种群灭绝概率降为0。因此, 个体补充与其他措施并用亦是种群保护的有效措施之一[27]。
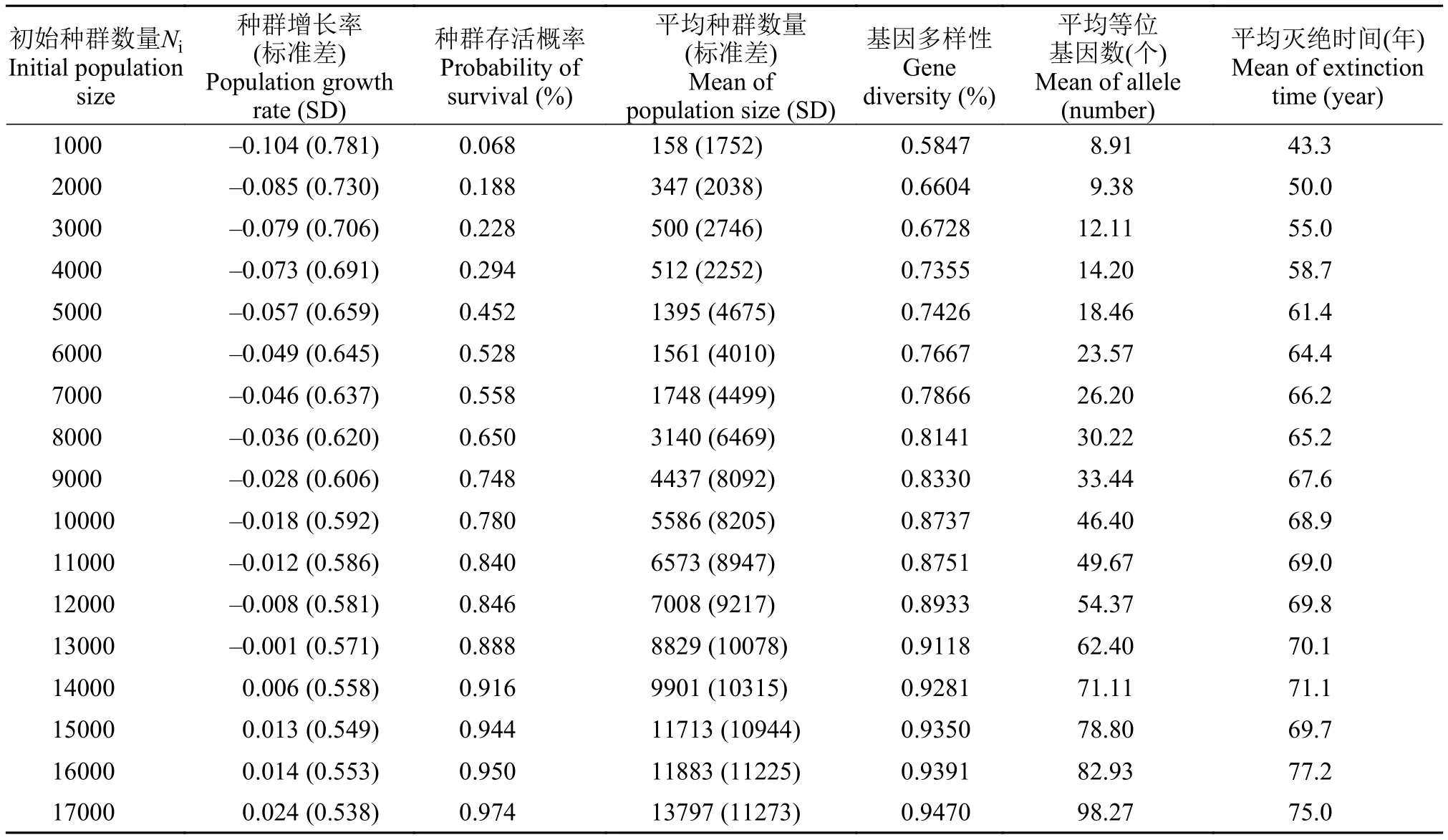
表 7 不同初始种群数量下秀丽高原鳅种群在100年内的种群生存力Tab. 7 The population viability within 100 years simulated based on different Ni in T. venusta
不同研究者对MVP的定义不同[28]: 定义MVP的主要目的是确定合适的有效群体数量(Effective population size), 确保种群在长期的进化过程中具有足够多的遗传变异, 保证种群长期存活与发展[10]。在高等脊椎动物中MVP为4500时可保证有效群体数量达500个[29]; 而波动较大、数量较少的蝴蝶种群, 当其MVP为5500时可避免种群灭绝[30]。本研究结果表明在当前环境条件下, 秀丽高原鳅种群以95%的概率健康存活100年时其MVP为16000, 高于上述报道的高等脊椎动物和陆生无脊椎动物, 这可能与现存种群数量的多少、当前的生境条件以及MVP估算时设定的存活年限有关[23]。
[1]Zhu S Q, Cao W X. Discriptions of two new species and a new subspecies of noemacheilinae from Yunnan province [J]. Acta Zootaxonomica Sinica, 1988, 13(1): 95—100 [朱松泉, 曹文宣. 云南省条鳅亚科鱼类两新种和一新亚种(鲤形目: 鳅科). 动物分类学报, 1988, 13(1): 95—100]
[2]Chen Y Y. Fauna Sinica, Osteichthyes, Cypriniformes II [M]. Beijing: Science Press. 1998, 1—531 [陈宜瑜. 1998.中国动物志•硬骨鱼类•鲤形目(中卷). 北京: 科学出版社. 1998, 1—531]
[3]Dudgeon D. Large-scale hydrological changes in tropical Asia: prospects for riverine biodiversity [J]. BioScience, 2000, 50(9): 793—806
[4]Matthews W J, Marsh-Matthews E. Effects of drought on fish across axes of space, time and ecological complexity [J]. Freshwater Biology, 2003, 48(7): 1233—1255
[5]Xie P, Wu J G, Huang J G, et al. Three-Gorges Dam: risk to ancient fish [J]. Science, 2003, 302(5648): 1149—1151
[6]Bond N R, Lake P S, Arthington A H. The impacts of drought on freshwater ecosystems: an Australian perspective [J]. Hydrobiologia, 2008, 600(1): 3—16
[7]Shaffer M L. Population viability analysis [J]. Conservation Biology, 1990, 4(1): 39—40
[8]Schoener T W, Spiller D A. High population persistence in a system with high turnover [J]. Nature, 1987, 330(6147): 474—477
[9]Traill L W, Bradshaw C J A, Brook B W. Minimum viable population size: A meta-analysis of 30 years of published estimates [J]. Biological Conservation, 2007, 139(1): 159—166
[10]Reed D H, Bryant E H. Experimental tests of minimum viable population size [J]. Animal Conservation, 2000, 3(1): 7—14
[11]Brook B W, O’Grady J J, Chapman A P, et al. Predictive accuracy of population viability analysis in conservation biology [J]. Nature, 2000, 404(6776): 385—387
[12]Lunney D, O’Neill L, Matthews A, et al. Modelling mammalian extinction and forecasting recovery: koalas at Iluka (NSW, Australia) [J]. Biological Conservation, 2002, 106(1): 101—113
[13]Bach L A, Pedersen R B F, Hayward M, et al. Assessing re-introductions of the African Wild dog (Lycaon pictus) in the Limpopo Valley Conservancy, South Africa, using the stochastic simulation program VORTEX [J]. Journal for Nature Conservation, 2010, 18(4): 237—246
[14]Miao L J, Li Y K, Ye J, et al. Population viability analysis for Hydropotes inermis in Poyang Lake [J]. Sichuan Journal of Zoology, 2015, 34(1): 133—140 [缪泸君, 李言阔, 叶晶, 等. 鄱阳湖区獐种群生存力分析. 四川动物, 2015, 34(1): 133—140]
[15]Thirstrup J P, Bach L A, Loeschcke V, et al. Population viability analysis on domestic horse breeds (Equus caballus) [J]. Journal of Animal Science, 2009, 87(11): 3525—3535
[16]Fan P F, Jiang X L. Population viability analysis for black crested gibbon (Nomascus concolor jingdongensis) in Dazhaizi [J]. Acta Ecologica Sinica, 2007, 27(2): 620—626 [范朋飞, 蒋学龙. 无量山大寨子黑长臂猿(Nomascus concolor jingdongensis) 种群生存力. 生态学报, 2007, 27(2): 620—626]
[17]Barri F R. Reintroducing guanacoin the upper belt of central Argentina: using population viability analysis to evaluate extinction risk and management priorities [J]. PLoS One, 2016, 11(10): e0164806
[18]Zhang X F, Wang K X. Population viability analysis for the Yangtze finless porpoise [J]. Acta Ecologica Sinica, 1999, 19(4): 529—533 [张先锋, 王克雄. 长江江豚种群生存力分析. 生态学报, 1999, 19(4): 529—533]
[19]Zhang X F, Wang D, Wang K X. Vortex model and its application on the management of Chinese River Dolphin (Lipotes vexillifer) population [J]. Chinese Biodiversity, 1994, 2(3): 133—139 [张先锋, 王丁, 王克雄. 漩涡模型及其在白暨豚种群管理中的应用. 生物多样性, 1994, 2(3): 133—139]
[20]Gao X, Brosse S, Chen Y B, et al. Effects of damming on population sustainability of Chinese sturgeon, Acipenser sinensis: evaluation of optimal conservation measures [J]. Environmental Biology of Fishes, 2009, 86(2): 325—336
[21]Wang W Y, Zhao T Y, Jiang W S, et al. A preliminary analysis on population viability for Ptychobarbus chungtienensis chungtienensis [J]. Journal of Hydroecology, 2012, 33(5): 47—53 [王伟营, 赵婷怡, 蒋万胜, 等. 中甸叶须鱼种群生存力初步分析. 水生态学杂志, 2012, 33(5): 47—53]
[22]Zeng L, Tang W Q. Discussion on age determination methods for two esquamate Triplophysa fishes [J]. Chinese Journal of Zoology, 2010, 45(1): 94—103 [曾霖,唐文乔. 两种无鳞高原鳅年龄鉴定方法探讨. 动物学杂志, 2010, 45(1): 94—103]
[23]Lacy R C, Borbat M, Pollak J P. Vortex: A stochastic simulation of the extinction process. Version 9.95 [J]. Chicago Zoological Society. Brookfield, Illinois, 2009.
[24]Reed D H, O’Grady J J, Brook B W, et al. Estimates of minimum viable population sizes for vertebrates and factors influencing those estimates [J]. Biological Conservation, 2003, 113(1): 23—34
[25]Gui X J, Xiang Z F, Li L. A preliminary population viability analysis of cabot’s Tragopan (Tragopan caboti) [J]. Zoological Research, 2007, 28(6): 626—633 [桂小杰, 向左甫, 李立. 黄腹角雉人工种群生存力初步分析. 动物学研究, 2007, 28(6): 626—633]
[26]Lande R, Barrowclough G F. Effective population size, genetic variation and their use in population management [J]. Viable Populations for Conservation, 1987, 23(87): 87—123
[27]Zhou Z, Zheng J S, Chen M M, et al. Genetic evaluation and development prognosis on ex situ conserved Yangtze finless porpoises living in Tian-e-Zhou national natural reserve [J]. Acta Hydrobiologica Sinca, 2012, 36(3): 403—411 [周钊, 郑劲松, 陈敏敏, 等. 天鹅洲迁地保护江豚群体的遗传评估与发展预测. 水生生物学报, 2012, 36(3): 403—411]
[28]Shaffer M L. Minimum population sizes for species conservation [J]. Bioscience, 1981, 31(2): 131—134
[29]Frankham R. Effective population size/adult population size ratios in wildlife: a review [J]. Genetical Research, 1995, 89(5): 491—503
[30]Thomas C D. What do real populations dynamics tell us about minimum viable population sizes [J]. Conservation Biology, 1990, 4(3): 324—327
A STUDY ON POPULATION VIABILITY ANALYSIS AND ESTIMATION OF MINIMUM VIABLE POPULATION IN TRIPLOPHYSA VENUSTA
WU Xiang-Wei1, LI Guang-Hua2, BI Bao-Liang1, YU Hong-Man3, KONG Ling-Fu1, LENG Yun2, ZHANG Yu4and JIANG Zhi-Wu4
(1. College of Animal Science and Technology, Yunnan Agricultural University, Kunming 650601, China; 2. Yunnan Academy of Fisheries Science, Kunming 650111, China; 3. College of Agronomy and Biotechnology, Yunnan Agricultural University,
Kunming 650201, China; 4. Yunnan Huadian Ludila Hydropower Co., Ltd., Kunming 650228, China)
Triplophysa venusta, one of the native fish species of Jinsha River with well conserved in Yunnan province, have been dramatically decreased because of the construction of hydropower station in its natural habitat and the continuous drought in Yunnan province. In this study, the population viability analysis (PVA) for T. venusta was simulated by VORTEX model under different scenarios. Its minimum viable population (MVP) was also estimated. The results suggested that catastrophe is the key factor for population survival. The population reproductive rate and the mortality of immature individuals are also important factors that affected the population viability in T. venusta. In contrast, there was no significant influence by environmental carrying capacity on population viability. Moreover, the continuing harvest of 2000 mature individuals per year for 40 years could make 100% extinction in 100 years. In contrast, the extinction probability could reduce to 35.8% in 100 years by the continuing supplementation of 1000 one-year-old individuals per year for 20 years. Simulation analysis using VORTEX model suggested that 16000 individuals could permit a survival of 95% probability in 100 years and it is the MVP in T. venusta. Consequently, our study displays that the effective methods of conservation and recovery in T. venusta are diminishing the frequency of catastrophe, cutting the immature individual mortality, and increasing the population fecundity. This study provides a good theoretical foundation for population protection, fishery management, as well as artificial breeding and releasing for T. venusta.
Triplophysa venusta; Population viability analysis; Minimum viable population size; Vortex model; Indigenous fish; Jinsha River
Q145+.1
A
1000-3207(2017)03-0543-09
10.7541/2017.70
2016-01-01;
2016-10-14
云南华电鲁地拉水电有限公司项目(LDL2011/023(P)); 云南省科技厅应用基础研究项目(2014FD019); 云南省科学技术厅项目(2013HB125)资助 [Supported by the Project of Yunnan Huadian Ludila Hydropower CO, LTD (LDL2011/023(P)); the Applied Basic Research Program of Science and Technology Committee of Yunnan Province (2014FD019); the Foundation of Science and Technology Committee of Yunnan Province (2013HB125)]
武祥伟(1984—), 男, 山东菏泽人; 在读博士, 讲师; 主要从事水产种质资源保护与利用研究。E-mail: xwwu@ynau.edu.cn
孔令富(1975—), E-mail: wzlklf@sina.com; 冷云(1970—), E-mail: lengyun871@126.com

