合成生物学技术在材料科学中的应用
赵田鑫,钟超
合成生物学技术在材料科学中的应用
赵田鑫,钟超
上海科技大学物质科学与技术学院,上海 201210

赵田鑫, 钟超. 合成生物学技术在材料科学中的应用. 生物工程学报, 2017, 33(3): 494–505.Zhao TX, Zhong C. Applications of synthetic biology in materials science. Chin J Biotech, 2017, 33(3): 494–505.
材料是人类赖以生存与发展的物质基础,科技和社会的进步都离不开材料技术的发展,未来先进材料的合成和制备必然朝着绿色可持续、低耗高产出、精细可调控、高效多功能的方向发展。以“基因调控·工程设计”为核心的合成生物学技术从分子、细胞层面极大地推动了生命科学的发展,也已经并继续为材料科学的发展注入新的思路和活力。本文将围绕合成生物学技术在材料科学中的应用,以基因回路设计为核心,概念应用为线索,重点介绍合成生物学技术在高分子生物材料和无机纳米材料领域的开发和生产,细胞展示和蛋白定向进化战略对分子材料的筛选和优化,“活体”功能材料、工程菌调节的人工光合系统功能材料体系以及基因回路在材料科学中的应用。
合成生物学,材料科学,基因回路,生物材料
材料是人类赖以生存与发展的物质基础,是人类进步的标志。从石器时代到青铜器时代,再过渡到铁器时代,人类衣食住行的质量因为材料的发展而得到了巨大的提高。早在20年前,传统的材料科学已经开始经历由宏观研究到微观探索的过程,纳米材料应运而生。对材料在微纳尺度性质的系统研究使人们对材料在纳米、微米尺度的各方面性能都有所了解,因而材料的设计可以说从完全依赖经验尝试过渡到理性设计。而理性设计最直接的灵感往往来自于自然,自然界中各式各样的多级自组装材料展现出精密的纳米结构,优异的材料性能,其结构稳定性和性能优异性是当前的人工合成材料无法比拟的。人们亟待对“生物灵感和生物仿生材料”做出更合理的诠释,对材料进一步优化升级。以水下粘合剂为例,传统的高分子粘合剂耐水性差、水下粘合强度不高[1-2],在针对伤口愈合、组织修复以及船体、大坝等精细修复方面存在着先天不足。人们发现,在海岸潮间带岩石上附着的生物,如贻贝[1,3]、藤壶[2]、沙堡蠕虫[4]等,在海风、海浪的吹打下依旧紧紧地贴附在岩石表面。因而这类粘合生物,如贻贝[5]等,为粘合剂领域的发展提供了新的思路。通过对贻贝分析发现,贻贝足丝蛋白Mfp3/5中富含有大量的邻苯二酚 (3,4-dihydroxyphenyl-L- alanine,DOPA) 结构[3],在此基础上人们将DOPA结构嵌入到高分子材料中,发展出系列水下粘合剂,如Poly[(3,4-dihydroxystyrene)-co-styrene][6],PEO、PPO和DOPA的共聚物[7],以及多功能涂层材料,如多巴胺[8]。但是设计智能、动态可控粘合,以及自我修复粘合仍是粘合材料领域的重要瓶颈,而合成生物学的发展有望突破上述瓶颈,给粘合材料设计带来新的思路。
生命体是最智能、最精细的有机体,基于“基因回路”代谢流的物质调控,使得生命体尽可能始终处在最适的生存条件,合理高效地利用物质能源。为了满足人们了解和改造生命体 (从分子水平、代谢水平到细胞水平) 的需要,合成生物学应运而生。1910年,Stéphane Leduc首次提出了合成生物学概念;1974年,Wacław Szybalski向合成生物学概念中加入了“应用”的思想。当前合成生物学的发展可谓日新月异,其自身的发展也为其他领域带来了更多的机会。在材料领域,科学家不仅利用合成生物学方法在制造和设计生物材料方面作了很多探索,而且从概念上也大大推进了新材料的定义范畴,其中的贡献包括但不限于以下几方面:1) 细胞工厂合成高分子生物材料;2) 生物体制备无机纳米材料;3) 噬菌体展示和蛋白定向进化战略筛选和优化分子材料;4) 活体功能材料;5) 工程菌调节的人工光合系统功能材料;6) 基因回路在材料科学中的应用。本文简要综述了这几方面的进展,旨在抛砖引玉,探讨合成生物学技术在材料科学领域的发展趋势。同时因为篇幅和水平有限,作品遗漏之处还望同行见谅。
1 细胞工厂合成高分子生物材料
实现材料生产的绿色可持续性以及材料的高效多功能性,是材料科学发展的重要目标。合成生物学具有模块化、标准化操作、智能化、精细化调控等优良特点,这些特点与材料科学的结合,必将从材料生产方式和材料性能两个方面极大地推动材料科学的发展。生物工厂具有绿色可持续和低耗高产出的特点,自然也就成为一种重要的材料制备手段。广为熟知的工作包括利用微生物、细胞等来生产医用药物制剂,如酶制剂、胰岛素等。Lee等[9]利用微生物生产各种塑料单体。清华大学陈国强教授实验室通过改造细菌β-氧化途径,成功地提高了聚羟基脂肪酸酯的产量以及性能[10-11]。聚羟基脂肪酸酯作为一种性质优良的塑料,具有生物可降解和生物相容性等特点。上述方案是将微生物作为生产工厂,利用细菌自身的代谢通路制备相应的材料分子;而另外一种战略是通过基因模块化操作理性设计材料。加州理工大学的Tirrell课题组借助基因工程战略构建出的蛋白分子具有较好的细胞相容性,同时在生理条件下形成凝胶[12]。麻省理工大学Lu课题组则借助合成生物学技术将CsgA (大肠杆菌生物膜的主要结构蛋白,可以自组装形成纤维状结构) 和Mgfp3/5 (贻贝的两种主要粘合蛋白) 进行融合表达,该融合蛋白充分结合了CsgA的内在粘合特性和Mfp的界面粘合特性,发挥出了强大的水下粘合特性[13](图1)。

图1 基因模块战略构建自组装水下粘合剂[13] (A:用于构造水下粘合剂的两种结构域示意图,Curli纤维是由富含交叉β折叠结构的CsgA蛋白组成,Mfp3和Mfp5在溶液中呈非结构化线圈结构;B:通过Gibson组装方法构建CsgA-Mfp3和Mfp5-CsgA基因;C:CsgA-Mfp3和Mfp5-CsgA可形成交叉的β-折叠结构;D:两种单体的共聚可以形成分层组装的粘性纤维)
2 生物体制备无机纳米材料
天然的或经过工程改造的微生物细胞器结构可以作为模板用于制备不同维度的纳微米材料。生物界存在的微格室直径从9 nm到500 nm不等[14],利用这种结构可以合成不同尺度的纳米材料;同时利用不同的微结构作为模具,如病毒颗粒,可以合成不同排布的纳米材料[15-16]。在制备过程中可以直接对纳米材料进行功能化修饰,满足人们多方面的需求[15]。
除了利用各种纳米结构作为模板合成纳米材料,生物体自身也可以作为合成无机纳米材料的工厂。一些原核生物,如MV-4[17]等,通过代谢可以产生氧化铁或硫化铁磁性纳米颗粒。相比于人工磁性纳米颗粒,细菌磁性纳米颗粒具有良好的分散性、粒径均一等特点,而且纳米颗粒在生物体内合成,反应条件温和,不需要额外的还原性添加剂,节约了能源,保护了环境。
Park等介绍了利用大肠杆菌合成多种纳米颗粒(图2)。利用大肠杆菌外源表达植物络合素合酶 (PCS) 或金属硫蛋白 (MT),通过改变金属离子的初始加入量可以调节合成的纳米颗粒大小。利用透射电子显微镜 (TEM)、共聚焦显微镜 (Confocal microscope) 等表征手段对合成的纳米颗粒进行分析,发现利用大肠杆菌合成的纳米颗粒在物理、化学以及电学性能方面都达到良好的指标[18]。Stürzenbaum等利用蚯蚓可以合成发冷光的量子点[19]。除此之外,科学家利用深红红螺菌表达了与合成磁纳米材料相关的外源基因簇,在该细菌体内成功合成了磁纳米颗粒[20]。
这些例子指出了一种新型的无机纳米材料制备路径。未来通过合成生物学技术可以更加理性地合成化学组成、形貌、甚至结晶取向都可控的纳米材料,包括运用于生物影像的生物相容纳米材料以及在催化、能源和环境中发挥作用的金属和金属半导体纳米材料。

图2 透射电镜揭示重组大肠杆菌体内合成的各种半导体纳米颗粒[18](表达拟南芥络合素合酶的重组大肠杆菌分别合成了锌化镉(A),硒化镉(B),碲化镉(C)和锌化硒纳米颗粒(D)。对应右图中数值代表纳米颗粒晶格的晶面间距)
3 噬菌体展示和蛋白定向进化战略筛选和优化分子材料
进化论有言“物竞天择,适者生存”。达尔文进化论的启发,人们模拟自然筛选的过程,创造性地发明了分子生物学技术——蛋白定向进化 (Directed protein evolution)。该技术模拟自然选择,在给定的实验筛选条件下,从庞大的变种基因文库中快速筛选得到能满足特定性能要求的蛋白分子 (图3)。由于该技术的高效性,因而广泛地应用于提高蛋白酶活性、蛋白稳定性以及增强特定的蛋白相互作用等方面。噬菌体展示技术是将一种外源短肽或蛋白基因与噬菌体特定蛋白基因在其表面进行融合表达的技术。从一定意义上讲,这是一种初级版本的蛋白定向进化技术。噬菌体展示技术作为一门成熟的筛选技术,广泛应用在抗体筛选、蛋白质相互作用研究领域,同时在材料科学中也广泛发挥作用。美国西雅图华盛顿大学Sarikaya课题组通过噬菌体展示技术筛选出各种金属或半导体绑定短肽,这些短肽可运用于无机材料的表面修饰[21],在生物传感器检测方面有着重要的应用。另外,早在2000年初,美国的Belcher实验室利用该技术在噬菌体表面展示了识别无机纳米材料的多肽,并将噬菌体作为模板,定向合成磁性纳米线和半导体纳米线[16],作为离子电池的电极[22-23]。除此以外,美国伯克利大学的Lee团队发展了基于噬菌体的“自我为模板组装”技术 (Self-templating assembly)[24],利用噬菌体螺旋形纳米纤维,形成光学性质、生物材料性质和电学性质都可调控的结构,在组织再生[24-25]和产能材料领域有重要的应用[26]。
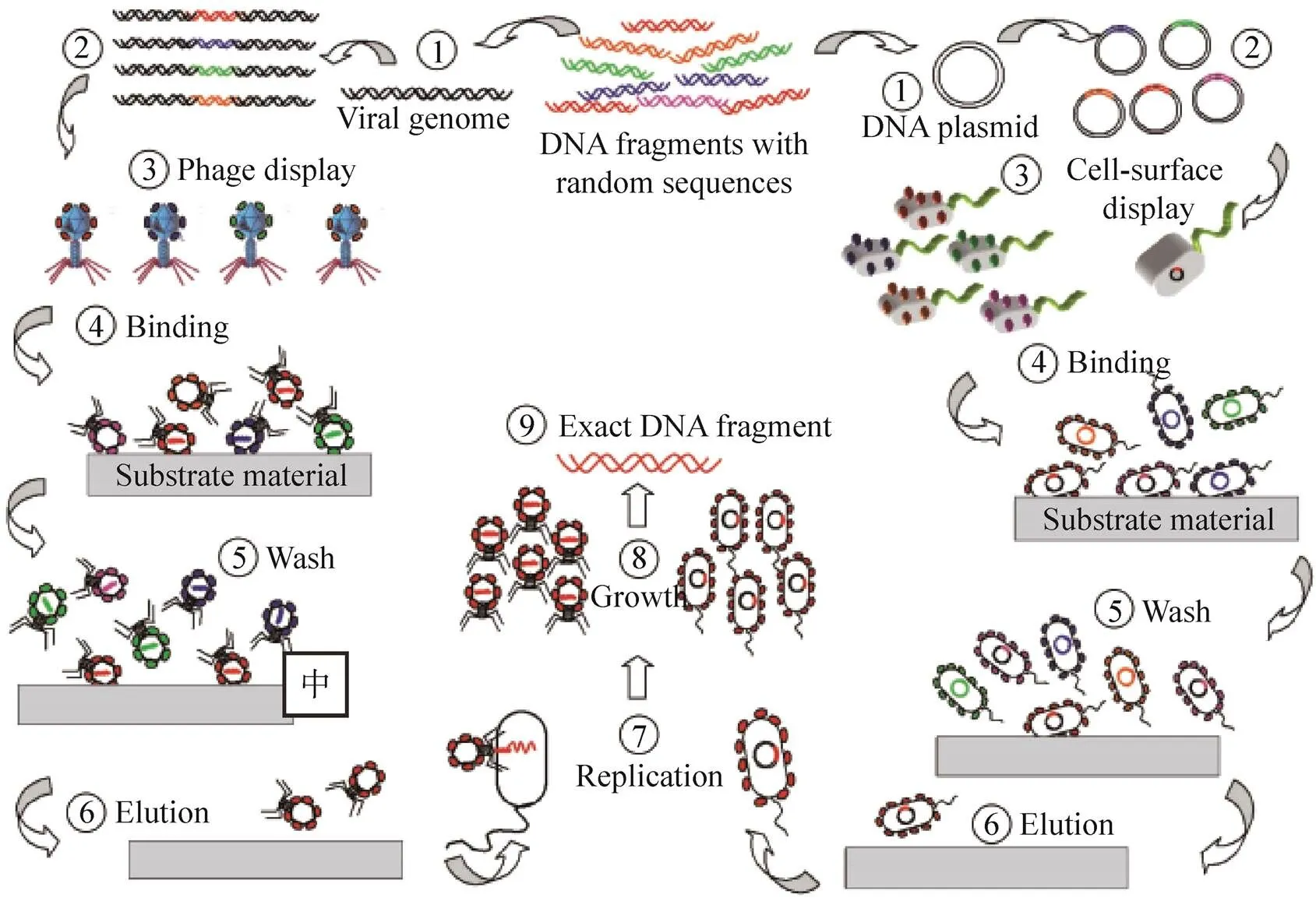
图3 噬菌体展示和细胞表面展示的筛选原理[21]
2014年,Wilke等利用噬菌体展示技术,将具有粘合性质的短肽库展示在噬菌体表面,以铝为基底进行筛选。经过“展示-筛选-放大” 3次循环之后,得到了粘合性能较强的肽段[27]。对筛选出的短肽从DOPA含量、DOPA周边氨基酸的性质以及整个短肽的亲疏水性进行分析,为下一步理性设计基于贻贝足丝蛋白的粘合剂提供了思路。需要指出的是,筛选出的粘合蛋白实际上也是一种固体绑定多肽。除此以外,加州大学Morse团队利用蛋白进化战略对矿化蛋白进行筛选[28]。他们利用非细胞体系,搭建“类细胞”平台,借助于微粒表面展示技术和流式细胞仪 (FACS) 等筛选手段进行矿化蛋白的筛选,筛选的蛋白具有促进无机材料结晶的功能。
然而,蛋白定向进化技术在材料科学中的应用潜力还远没有被挖掘,其主要的挑战在于如何建立有效的基于材料性质的筛选平台和方法。相信随着各种高通量材料表征手段的发明,这一技术有望促进当前材料基因组计划的实施。
4 活体功能材料
借用合成生物学手段,科学家利用非标准氨基酸注入的方法,在目标蛋白合成的过程中引入了功能修饰[29]。如直接引入被重金属元素修饰的蛋氨酸从而促进蛋白质的结晶;在蛋白质翻译过程中引入含有叠氮基团的氨基酸用于点击化学反应,研究蛋白之间的相互作用;另外,在Mfp蛋白的合成过程中直接引入DOPA结构,使其直接发挥粘合功能,避免了转录后 (或纯化后) 修饰[30-31]。
最近几年,有科学家尝试将生物体 (包括细胞外基质等) 作为材料加以使用。大肠杆菌、枯草杆菌等在自然条件下多以群居状态生活,生物膜 (Biofilm) 结构保证了菌群的稳定存在。生物膜种类繁多,富含蛋白、脂多糖、核酸等基质,具有性质稳定、耐酸碱、可再生等特点,可以作为一种涂层材料使用。Joshi借助大肠杆菌生物膜CsgA体系,将一些功能蛋白 (如矿化蛋白、绑定蛋白和结合蛋白等) 与CsgA融合表达,同时借助于CsgB (大肠杆菌生物膜的另一种成分) 锚定CsgA的作用以及生物膜整体结构的稳定性,将功能蛋白展示在大肠杆菌表面,发挥相应的功能作用[32](图4)。
实验结果表明基于大肠杆菌生物膜的功能化展示平台完全可以实现预期的蛋白功能展示。而Chen等则基于CsgA体系提出了动态可调控的多功能生物活体材料[33-34](图5)。作者分别构建了CsgAhis、CsgA的aTc和AHL的正交诱导体系工程菌。在两种工程菌共培养的过程中,通过改变两种菌初始浓度的比例以及诱导物的浓度,得到了一种近似于嵌段共聚物的高分子结构。借助金纳米颗粒等的功能化作用,对嵌段共聚物进行功能化修饰,可以作为一种导电器件涂层。
Turing提出了“反应–扩散”模型来解释胚胎层级结构的形成[35]。2005年,Basu通过设计两个启动效率有差别的并联通路,观察到基于细胞水平程序化调控的图案形成[36]。这些研究为以后在细胞水平上设计动态可调控的层次化多功能材料提供了参考。
生物传感器,是借助于生物平台 (如酶、抗体、微生物等) 将外界输入信号转化为可方便观测、记录信号的装置。科学家借助合成生物学技术,给大肠杆菌装上了“眼睛”,带上了“手表”。Levskaya等设计了光控工程菌,通过红光照射限制蛋白的自磷酸化,调节下游基因的表达[37](图6)。

图4 基于基因模块编程设计的生物膜纳米纤维展示技术[32]

图5 外界诱导基因回路调节CsgA蛋白的分泌表达[33]

图6 基于蛋白设计合成的光敏感受器[38]
科学家利用该技术可以实现对工程菌群落表达情况的空间控制,使其按照人们的需求定点、定范围表达目标蛋白。
另外,Chen等将蓝藻的基因簇嫁接到大肠杆菌体内,在其下游串联表达绿色荧光蛋白,记录磷酸化和去磷酸化情况[38]。实验发现,蓝藻的基因簇在大肠杆菌体内依然可以周期性地发生磷酸化和去磷酸化作用,荧光信号强弱出现周期性变化。
可以预见,在不久的将来,这些在空间和时间上对蛋白表达的基因调控可以移植到材料科学领域,实现动态智能化生物材料和纳米 技术。
5 工程菌调节的人工光合系统功能材料
光合作用是指自然界的生物体 (主要是绿色植物,包括蓝藻) 收集利用太阳能,并将水和二氧化碳转化成碳水化合物的过程。科学家一直在探索利用人造光合系统来制备能源分子或合成具有高附加值的材料。例如,杨培东课题组创建了细菌/无机半导体混合人工光合系统[39](图7)。该体系代表了系统材料的概念,其核心分为两部分,沉积在菌体表面的硫化镉纳米颗粒作为光吸收元件,而工程的热醋穆尔氏菌则作为系统材料的另一部分。工程菌能够利用硫化镉吸收光能得到的电子引发并促进其代谢途径产生具有附加值的乙酸分子,该系统是一个令人印象深刻的生物和非生物结合体系,成功实现了太阳能到化学能的转化。同年,Liu等利用人工光合系统储存太阳能,还原二氧化碳[40]。
可以预见,随着合成生物学技术的不断推进,生物体内固有的各种代谢通路将会被不断优化;合成生物学技术对各种通路的调控,对细胞工厂的优化也将会进一步升级;同时,人们对各种生物体电子传输路径的认知以及对生物和非生物界面进行的整合也将不断提高。这些努力必将优化现有的,甚至推进更前沿的人工光合体系。不久的将来,实现太阳能快速、高效地转化成化学能将不再是实验梦想。
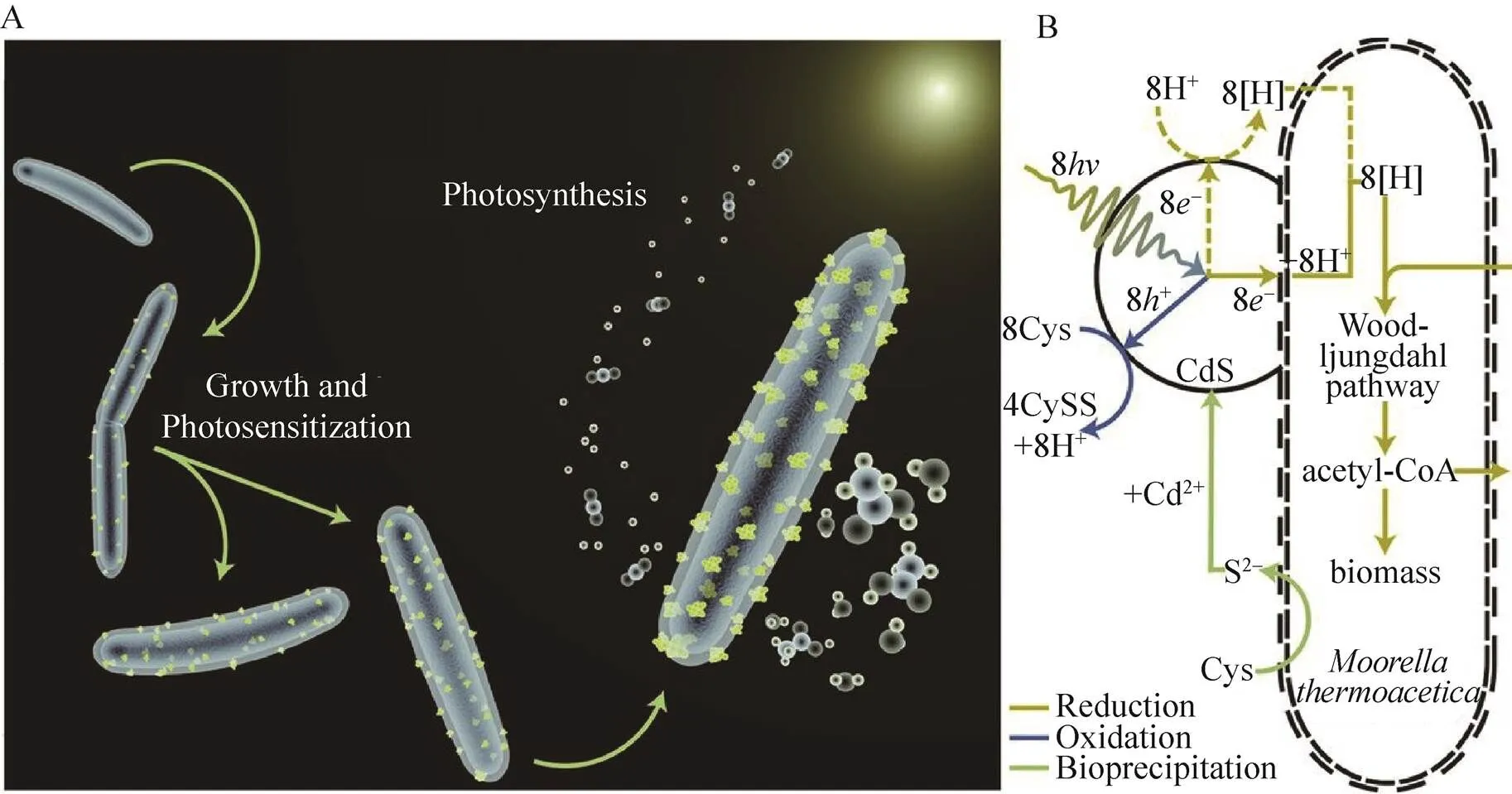
图7 基于M. thermoacetica菌和硫化镉无机纳米材料的人工光合系统材料体系(A为示意图;B为涉及到的电子传递和相关的反应通路[39])
6 基因回路在材料科学中的应用
基于遗传密码的通用性,科学家不仅可以直接过表达内源蛋白,如之前提到的Chen[33]和Joshi[32]分别在大肠杆菌体内过表达CsgA融合蛋白;而且可以在某一生物体内表达外源蛋白,如Giessen等在大肠杆菌中表达海栖热袍菌来源的EncTm[14]。基因回路设计作为整个合成生物学的基石,在编辑和调控细胞行为和功能方面大有所为。例如,对生物体在基因层面的编程,可以让生物体对外界环境的变化,如光、热等,作出快速指示。
2015年,Huber和Schreiber等利用大肠杆菌外源表达基于基因调控的两亲性蛋白,依靠蛋白自身的亲疏水性质在体内自组装成为人造“细胞器”[41](图8)。该细胞器不仅可以作为反应单元或药物存储载体,而且还可以作为一个构建单元 (Building block)。文章提到在蛋白形成的过程中引入功能化的氨基酸,可以赋予整个细胞器更多样的功能。同时值得一提的是,通过调节亲疏水区域的比例和排布,可以调节整个“细胞器”的形貌。
2016年,Din等设计了基于“群体感应”和“振荡模式”调控的药物释放模型[42](图9)。群体感应效应是指当细菌密度达到一定水平时,细菌自发产生一种信号分子 (如AHL等) 诱导其他细菌产生相应行为的现象。文章中构建的工程菌拥有两条平行的基因回路,AHL信号分子控制下游3种蛋白的表达 (报告蛋白、药物蛋白以及自杀蛋白)。随着细菌的生长繁殖,由于群体感应引发了下游3种蛋白的大量表达,其中报告蛋白 (sfGFP) 作为细菌存活数量的指示标准。自杀蛋白 (φX174E) 的大量表达,可以裂解杀死细胞,一方面避免了由于细菌过量增长对机体稳态带来的不利影响,另一方面释放出表达的药物蛋白 (hlyE) 发挥了治疗效果。随着细菌数量的减少,群体效应消失,自杀蛋白和治疗蛋白停止表达。之后细菌继续进行生长繁殖,重新引发群体效应,进入下一个治疗循环。

图8 大肠菌杆菌体内自主装成为细胞器的两亲性蛋白的设计和表达[41](A:在体内表达的两亲性蛋白质形成细胞区室;B:质粒pET28-mEGFP-E20F20编码两亲性蛋白;C:分别显示了指定蛋白质的组成缩写、符号和性质)

图9 同步细胞裂解基因通路的构建和功能化表征[42] (A:同步细胞裂解基因通路SLC示意图;B:每个周期的主要阶段,从生长到群体感应初始化到同步裂解,每个周期的3个主要阶段)
以上两个方面只是基本概念的证明或生物医药方面应用的灵光乍现,相信随着时间的推移,基因回路会更好地促进生物材料和活体功能材料的发展。
7 总结和展望
合成生物学技术与材料科学的交叉一方面可以满足人们对材料高精度、多功能的需求;另一方面也可以满足人们对生产过程智能可控的要求。前期的合成生物学技术让人们成功地提高了材料的质量和性质,实现了材料的可再生和功能化;同时在材料的生产过程中充分发挥出了生物体代谢可调控、反应条件温和等特点,初步实现了绿色生产的目标。当前阶段,合成生物学在材料科学中的应用已经得到了全面升级,包括从利用生物到改造生物,从单一组分到多组分的材料设计,从简单的工程材料到生物灵感或仿生多功能材料,从静态材料到动态智能型材料等各个方面。基于合成生物学具有绿色合成、基因可编程、分子层面精细调控以及高效并且可放大生产等特点,合成生物学势必在未来材料科学中继续发挥重要的作用。而如何更科学有效地将现有合成生物学技术和材料科学问题相结合,将是我们成功迈出下一步的关键环节。
[1] Fullenkamp DE, He LH, Barrett DG, et al. Mussel-inspired histidine-based transient network metal coordination hydrogels. Macromolecules, 2013, 46(3): 1167–1174.
[2] Kamino K. Molecular design of barnacle cement in comparison with those of mussel and tubeworm. J Adhes, 2010, 86(1): 96–110.
[3] Lee BP, Messersmith PB, Israelachvili JN, et al. Mussel-inspired adhesives and coatings. Annu Rev Mater Res, 2011, 41(1): 99–132.
[4] Stewart RJ, Ransom TC, Hlady V. Natural underwater adhesives. J Polymer Sci B: Polymer Phys, 2011, 49(11): 757–771.
[5] Lee H, Lee BP, Messersmith PB. A reversible wet/dry adhesive inspired by mussels and geckos. Nature, 2007, 448(7151): 338–341.
[6] Jenkins CL, Meredith HJ, Wilker JJ. Molecular weight effects upon the adhesive bonding of a mussel mimetic polymer. ACS Appl Mater Interfaces, 2013, 5(11): 5091–5096.
[7] Barrett DG, Bushnell GG, Messersmith PB. Mechanically robust, negative-swelling, mussel- inspired tissue adhesives. Adv Healthc Mater, 2013, 2(5): 745–755.
[8] Lee H, Dellatore SM, Miller WM, et al. Mussel- inspired surface chemistry for multifunctional coatings. Science, 2007, 318(5849): 426–430.
[9] Chung H, Yang JE, Ha JY, et al. Bio-based production of monomers and polymers by metabolically engineered microorganisms. Curr Opin Biotechnol, 2015, 36: 73–84.
[10] Liu Q, Luo G, Zhou XR, et al. Biosynthesis of poly (3-hydroxydecanoate) and 3-hydroxydodecanoate dominating polyhydroxyalkanoates by β-oxidation pathway inhibited. Metab Eng, 2011, 13(1): 11–17.
[11] Chung AL, Jin HL, Huang LJ, et al. Biosynthesis and characterization of poly (3-hydroxydodecanoate) by β-oxidation inhibited mutant ofL48. Biomacromolecules, 2011, 12(10): 3559–3566.
[12] Sun F, Zhang WB, Mahdavi A, et al. Synthesis of bioactive protein hydrogels by genetically encoded SpyTag-SpyCatcher chemistry. Proc Natl Acad Sci USA, 2014, 111(31): 11269–11274.
[13] Zhong C, Gurry T, Cheng AA, et al. Strong underwater adhesives made by self-assembling multi-protein nanofibres. Nat Nanotechnol, 2014, 9(10): 858–866.
[14] Giessen TW, Silver PA. Converting a natural protein compartment into a nanofactory for the size-constrained synthesis of antimicrobial silver nanoparticles. ACS Synth Biol, 2016, doi: 10.1021/acssynbio.6b00117. (in Press)
[15] Li F, Wang QB. Fabrication of nanoarchitectures templated by virus-based nanoparticles: strategies and applications. Small, 2014, 10(2): 230–245.
[16] Mao CB, Solis DJ, Reiss BD, et al. Virus-based toolkit for the directed synthesis of magnetic and semiconducting nanowires. Science, 2004, 303(5655): 213–217.
[17] Bazylinski DA, Frankel RB. Magnetosome formation in prokaryotes. Nat Rev Microbiol, 2004, 2(3): 217–230.
[18] Park TJ, Lee SY, Heo NS, et al.synthesis of diverse metal nanoparticles by recombinant. Angew Chem Int Ed, 2010, 49(39): 7019–7024.
[19] Stürzenbaum SR, Höckner M, Panneerselvam A, et al. Biosynthesis of luminescent quantum dots in an earthworm. Nat Nanotechnol, 2013, 8(1): 57–60.
[20] Kolinko I, Lohße A, Borg S, et al. Biosynthesis of magnetic nanostructures in a foreign organism by transfer of bacterial magnetosome gene clusters. Nat Nanotechnol, 2014, 9(3): 193–197.
[21] Sarikaya M, Tamerler C, Jen AKY, et al. Molecular biomimetics: nanotechnology through biology. Nat Mater, 2003, 2(9): 577–585.
[22] Lee YJ, Yi H, Kim WJ, et al. Fabricating genetically engineered high-power lithium-ion batteries using multiple virus genes. Science, 2009, 324(5930): 1051–1055.
[23] Nam KT, Kim DW, Yoo PJ, et al. Virus-enabled synthesis and assembly of nanowires for lithium ion battery electrodes. Science, 2006, 312(5775): 885–888.
[24] Chung WJ, Oh JW, Kwak K, et al. Biomimetic self-templating supramolecular structures. Nature, 2011, 478(7369): 364–368.
[25] Merzlyak A, Indrakanti S, Lee SW. Genetically engineered nanofiber-like viruses for tissue regenerating materials. Nano Lett, 2009, 9(2): 846–852.
[26] Lee BY, Zhang JX, Zueger C, et al. Virus-based piezoelectric energy generation. Nat Nanotechnol, 2012, 7(6): 351–356.
[27] Wilke P, Helfricht N, Mark A, et al. A direct biocombinatorial strategy toward next generation, mussel-glue inspired saltwater adhesives. J Am Chem Soc, 2014, 136(36): 12667–12674.
[28] Bawazer LA, Izumi M, Kolodin D, et al. Evolutionary selection of enzymatically synthesized semiconductors from biomimetic mineralization vesicles. Proc Natl Acad Sci USA, 2012, 109(26): E1705-E1714.
[29] Wang L, Xie JM, Schultz PG. Expanding the genetic code. Annu Rev Biophys Biomol Struct, 2006, 35: 225–249.
[30] Yang B, Ayyadurai N, Yun H, et al.residue-specific dopa-incorporated engineered mussel bioglue with enhanced adhesion and water resistance. Angew Chem Int Ed, 2014, 53(49): 13360–13364.
[31] Choi YS, Yang YJ, Yang B, et al.modification of tyrosine residues in recombinant mussel adhesive protein by tyrosinase co-expression in. Microb Cell Fact, 2012, 11(1): 139.
[32] Nguyen PQ, Botyanszki Z, Tay PKR, et al. Programmable biofilm-based materials from engineered curli nanofibres. Nat Commun, 2014, 5: 4945.
[33] Chen AY, Deng ZT, Billings AN, et al. Synthesis and patterning of tunable multiscale materials with engineered cells. Nat Mater, 2014, 13(5): 515–523.
[34] Chen AY, Zhong C, Lu TK. Engineering living functional materials. ACS Synth Biol, 2015, 4(1): 8–11.
[35] Turing AM. The chemical basis of morphogenesis. Bull Math Biol, 1990, 52(1/2):153–197.
[36] Basu S, Gerchman Y, Collins CH, et al. A synthetic multicellular system for programmed pattern formation. Nature, 2005, 434(7037): 1130–1134.
[37] Levskaya A, Chevalier AA, Tabor JJ, et al. Synthetic biology: engineeringto see light. Nature, 2005, 438(7067): 441–442.
[38] Chen AH, Lubkowicz D, Yeong V, et al. Transplantability of a circadian clock to a noncircadian organism. Sci Adv, 2015, 1(5): e1500358.
[39] Sakimoto KK, Wong AB, Yang PD. Self- photosensitization of nonphotosynthetic bacteria for solar-to-chemical production. Science, 2016, 351(6268): 74–77.
[40] Liu C, Colón BC, Ziesack M, et al. Water splitting–biosynthetic system with CO2reduction efficiencies exceeding photosynthesis. Science, 2016, 352(6290): 1210–1213.
[41] Huber MC, Schreiber A, Von Olshausen P, et al. Designer amphiphilic proteins as building blocks for the intracellular formation of organelle-like compartments. Nat Mater, 2015, 14(1): 125–132.
[42] Din MO, Danino T, Prindle A, et al. Synchronized cycles of bacterial lysis fordelivery. Nature, 2016, 536(7614): 81–85.
(本文责编 陈宏宇)
钟超 博士,本科毕业于天津大学,2009年在美国康奈尔大学获得博士学位,2009−2011年在华盛顿大学西雅图分校从事博士后研究,2012−2014年在麻省理工学院电子工程系、生物工程系以及麻省理工合成生物学中心担任研究科学家(Research associate)职位。2014年7月加入上海科技大学物质学院担任助理教授和课题组长。以第一作者在国际一流期刊上发表多篇学术论文,包括、和等。回国后获中组部青年千人、上海曙光学者、浦东百人等荣誉以及国家自然基金面上和联合基金等项目资金的支持。课题组主要研究方向是生物灵感材料、生物纳米技术以及合成生物学在以上领域的应用。

Applications of synthetic biology in materials science
Tianxin Zhao, and Chao Zhong
School of Physical Science and Technology (SPST), Shanghai Tech University, Shanghai 201210, China
Materials are the basis for human being survival and social development. To keep abreast with the increasing needs from all aspects of human society, there are huge needs in the development of advanced materials as well as high-efficiency but low-cost manufacturing strategies that are both sustainable and tunable. Synthetic biology, a new engineering principle taking gene regulation and engineering design as the core, greatly promotes the development of life sciences. This discipline has also contributed to the development of material sciences and will continuously bring new ideas to future new material design. In this paper, we review recent advances in applications of synthetic biology in material sciences, with the focus on how synthetic biology could enable synthesis of new polymeric biomaterials and inorganic materials, phage display and directed evolution of proteins relevant to materials development, living functional materials, engineered bacteria-regulated artificial photosynthesis system as well as applications of gene circuits for material sciences.
synthetic biology, material sciences, genetic circuits, biomaterials
October 26, 2016; Accepted: January 10, 2017
Chao Zhong. Tel: +86-21-20685261; E-mail: zhongchao@shanghaitech.edu.cn
Supported by: Joint Funds of the National Natural Science Foundation of China (No. U1532127), National Natural Science Foundation of China (No. 31570972), 1000Youth Talents Program, Start-up grant from Shanghai Tech University.
国家自然科学基金联合基金(No. U1532127),国家自然科学基金(No. 31570972),青年千人项目,上海科技大学启动资金资助。
2017-01-23
http://www.cnki.net/kcms/detail/11.1998.Q.20170123.1602.002.html
——材料科学与工程

