无细胞蛋白合成体系实现胰岛素原可溶性表达
胡元,张宇琛,徐焱成,刘天罡
无细胞蛋白合成体系实现胰岛素原可溶性表达
胡元1,张宇琛2,徐焱成1,刘天罡2
1 武汉大学中南医院内分泌科,湖北武汉 430071 2 武汉大学药学院组合生物合成与新药发现教育部重点实验室,湖北武汉 430071

胡元, 张宇琛, 徐焱成, 等. 无细胞蛋白合成体系实现胰岛素原可溶性表达. 生物工程学报, 2017, 33(3): 467–477.Hu Y, Zhang YC, Xu YC, et al. Synthesis of soluble proinsulin in a cell-free protein synthesis system. Chin J Biotech, 2017, 33(3): 467–477.
胰岛素原 (Proinsulin,Pins) 是胰岛素的合成前体。在大肠杆菌表达系统中,其一般以包涵体的形式存在,需要经过变性复性等后续加工过程才能得到有活性的胰岛素。而无细胞蛋白合成体系 (Cell-free protein synthesis,CFPS) 作为一种新型体外蛋白合成手段,突破了细胞的生理限制,已成功应用于多种重组蛋白药物的生产。为了探索胰岛素合成的新方法以满足其在新型给药途径研发中的需求,本研究运用CFPS体系进行胰岛素原的可溶性表达。通过将胰岛素原与荧光蛋白进行融合来增加其可溶性,成功在CFPS体系中表达了胰岛素原融合蛋白。最后使用Western blotting对融合红色荧光蛋白的胰岛素原 (Pins-mCherry) 进行鉴定,利用酶标仪对融合绿色荧光蛋白的胰岛素原 (Pins-eGFP) 在上清中的表达进行定量分析,结果表明Pins-eGFP部分可溶,其表达量为 (12.28±3.45) μg/mL。本研究首次实现了融合胰岛素原在CFPS系统中的可溶性表达,其融合荧光蛋白的策略显著提升了胰岛素原的可溶性,该结果为探究胰岛素合成新方法及开发基于CFPS系统的新型胰岛素给药途径奠定了基础。
无细胞蛋白合成体系,胰岛素原,融合荧光蛋白,可溶性,蛋白折叠
糖尿病是由胰岛素分泌缺乏或胰岛素抵抗引起的以血糖水平升高为特点的代谢性疾病。近一个世纪以来,胰岛素被广泛应用于治疗糖尿病,拯救了无数糖尿病患者的生命[1-2]。胰岛素分子量为5 808 Da,由A、B两条氨基酸链组成,A链有21个氨基酸,B链有30个氨基酸。其中A7与B7、A20与B19四个半胱氨酸中的巯基形成2个二硫键,此外A链中A6与A11之间也存在1个二硫键[3]。β细胞首先合成前体物质前胰岛素原,之后前胰岛素原在蛋白酶作用下切去信号肽,形成胰岛素原。然后胰岛素原进入高尔基体在蛋白酶作用下切去C肽形成有活性的胰岛素[4-5]。目前,人们主要通过DNA重组技术在大肠杆菌或酵母中合成胰岛素原,然后加工成有活性的胰岛素[6-7]。大肠杆菌系统是一个高效的表达系统,然而在表达胰岛素原过程中,转录翻译速率明显快于蛋白折叠速率,且缺乏折叠酶及翻译后修饰,易相互聚集,形成不溶性的包涵体,需要经过复杂的加工过程才能形成有活性的胰岛素[8-9]。酵母合成的胰岛素原容易积累在胞内,不能有效分泌至胞外[10-11]。因此,在工业生产中一般采取在大肠杆菌分别表达胰岛素的A、B链的策略或者酵母等真核表达系统中表达胰岛素。
无细胞蛋白合成体系(CFPS) 利用细胞抽提物中的酶和蛋白质因子,以外源DNA或mRNA为模板,通过补充翻译所需的底物和能量物质,从而实现目标蛋白的体外合成。与体内表达体系相比,CFPS不受胞内复杂环境的影响、可调控性强、对毒性蛋白的耐受力高和产物分离成本低的优点可以为解决生物制药领域发展的关键问题提供潜在的新解决方案[12]。近年来已经逐渐被应用于高通量药物筛选、大规模生产重组蛋白药物、多肽类药物和肿瘤疫苗等领域中[13-14]。Jewett等创建的简易细胞提取物制备方法生产成本低,高效、快速、简单[15]。最近Collins等通过将CFPS组分制成冻干提取物,制备成便携式微型药物合成工厂,成功生产出具有生物活性的抗菌肽,便携式白喉疫苗,设计的锚蛋白重复蛋白 (Designed ankyrin repeat proteins,DARPins) 以及纳米抗体,为疾病的预防、诊断以及按需随时取用的个体化精准治疗提供了新的可能[16]。除了上述应用之外,关于CFPS系统能否合成可溶性的胰岛素原,是否可以用于胰岛素的便携式生产及糖尿病的个体化治疗的探索还少有涉及。有研究利用CFPS系统表达胰岛素原,但所用的连续性CFPS制备较为复杂,效率低,并且产物大部分仍以包涵体形式存在[17]。荧光蛋白家族因其受激发会发出荧光的特性,被广泛作为标记物运用于生物学研究当中,也可用于构建融合蛋白作为标记物及增加目的蛋白的可溶性[18-19]。本研究中,为了使CFPS系统可以合成可溶的胰岛素原,将荧光蛋白融合至胰岛素原的C端,首次实现了融合胰岛素原蛋白在CFPS系统中的可溶性表达。在CFPS系统成功合成可溶性胰岛素原为探究胰岛素合成新方法、探索便携式胰岛素给药方式以及在无细胞体系中合成成熟的胰岛素提供了良好的工作基础和有用的信息。
1 材料与方法
1.1 材料
BL21 (DE3) 受体菌为本实验室保存,pET-28a(+)载体购于Novagen公司。总tRNA,ATP,GTP,CTP,UTP,磷酸烯醇式丙酮酸,20种氨基酸及其他试剂购于Sigma公司。
1.2 质粒构建
按照胰岛素原的基因序列 (GenBank Accession No. NP_000198.1),设计引物F1/R1,引物两端分别引入酶切位点Ⅰ和d Ⅲ,PCR扩增合成的胰岛素原基因,扩增后的片段插入到pET28对应酶切位点,获得的重组载体pYH1带有6×His标签。融合荧光蛋白的胰岛素原质粒pYH2、pYH3采用Simple Cloning的方法构建,以胰岛素原表达质粒pYH1为模板,F2/R2为引物进行PCR扩增,并分别以荧光蛋白基因片段m/为模板,F3/R3为引物进行PCR扩增,引物序列见表1,分别得到融合荧光蛋白的胰岛素原表达质粒pYH2和pYH3,荧光蛋白融合在胰岛素原的C端。

表1 引物序列
Note: the underlined sequences represent restriction site.
1.3 细胞提取物的制备
用1 L的2×YTPG培养基 (16 g蛋白胨, 10 g酵母提取物,5 g氯化钠,7 g K2HPO4,3 g KH2PO4,18 g葡萄糖,pH 7.2) 培养BL21 (DE3),37 ℃、220 r/min培养至600值为0.6–0.8,加入1 mmol/L IPTG诱导使菌体表达足量的T7 RNA聚合酶,培养至600=4时 5 000 r/min离心15 min收集菌体。用缓冲液A (10 mmol/L Trisbase,14 mmol/L醋酸镁, 60 mmol/L谷氨酸钾,2 mmol/L DTT,pH 8.2) 洗涤菌体3次,称细胞湿重,保存于–80 ℃冰箱。按照1 g菌体湿重/1 mL缓冲液A的比例重悬菌体,超声破碎,12 000 r/min、4 ℃离心10 min,取上清分装后液氮速冻,保存于–80 ℃冰箱中。
1.4 无细胞体系合成蛋白
CFPS合成反应在1.5 mL EP管中进行。反应体系含有以下成分:1.2 mmol/L ATP,0.86 mmol/L GTP、UTP、CTP;34.0 μg/mL亚叶酸,170.0 μg/mLtRNA混合物,175 mmol/L谷氨酸钾, 2.7 mmol/L草酸钾,10 mmol/L谷氨酸铵, 12 mmol/L谷氨酸镁,20种氨基酸各2 mmol/L,0.33 mmol/L NAD+,0.27 mmol/L CoA,1.5 mmol/L亚精胺,1 mmol/L腐胺,33.33 mmol/L磷酸烯醇式丙酮酸以及27% (/) 的细胞提取物。将反应液混合完毕之后加入终浓度为13.3 μg/mL重组质粒起始反应,37 ℃反应。
1.5 胰岛素原及融合红色荧光蛋白的胰岛素原的Western blotting分析
反应4 h后,5 000 r/min离心10 min。将反应产物分为上清液和沉淀两部分,采用4%–16.5% Tricine SDS-PAGE进行检测,一块胶考马斯亮蓝染色,另一块胶湿转至PVDF膜进行后续分析。转膜后将PVDF膜用封闭缓冲液孵育2 h,再使用PBST (0.01 mol/L PBS,0.05% Tween20,Ph 7.4) 洗膜10 min,重复3次;洗膜后按1∶20 000的稀释比例加入溶于封闭缓冲液的鼠抗His标签蛋白单克隆抗体,4 ℃孵育过夜;孵育完成后,再使用PBST洗膜3次,按1∶1 000的比例加入溶于封闭缓冲液中的HRP标记的山羊抗小鼠的IgG的二抗,室温孵育2 h,孵育完成后用PBST洗膜3次;采用化学发光法 (BIO-RAD molecular imager ChemiDoc XRS+ imaging system) 对目标蛋白进行检测。
1.6 融合绿色荧光蛋白胰岛素原的表达定量分析
将大肠杆菌来源纯化的Pins-eGFP融合蛋白稀释至不同浓度用酶标仪 (PerkinElmer) 检测荧光强度 (激发波长:485 nm,吸收波长:535 nm),绘制融合蛋白浓度关于荧光强度的标准曲线。将反应4 h后的CFPS反应液,5 000 r/min离心10 min,取上清进行检测,根据标准曲线计算融合蛋白的浓度。
2 结果与分析
2.1 胰岛素原核表达系统以及CFPS系统合成胰岛素设计原理
由于大肠杆菌表达过程中,表达产物会相互聚集形成包涵体,需要经过变性和复性的过程才能得到有活性的胰岛素。本研究目的在于构建含有编码蛋白酶识别位点基因的融合荧光蛋白的胰岛素原表达质粒,并以此为模板,利用CFPS体系无细胞膜的特点,通过添加蛋白酶对融合蛋白进行切割从而实现成熟胰岛素在CFPS体系中的合成。在需要时,为了便于储存和运输,可以将这些组分分别制成冻干粉,需要时通过加入水起始反应即可获得胰岛素。
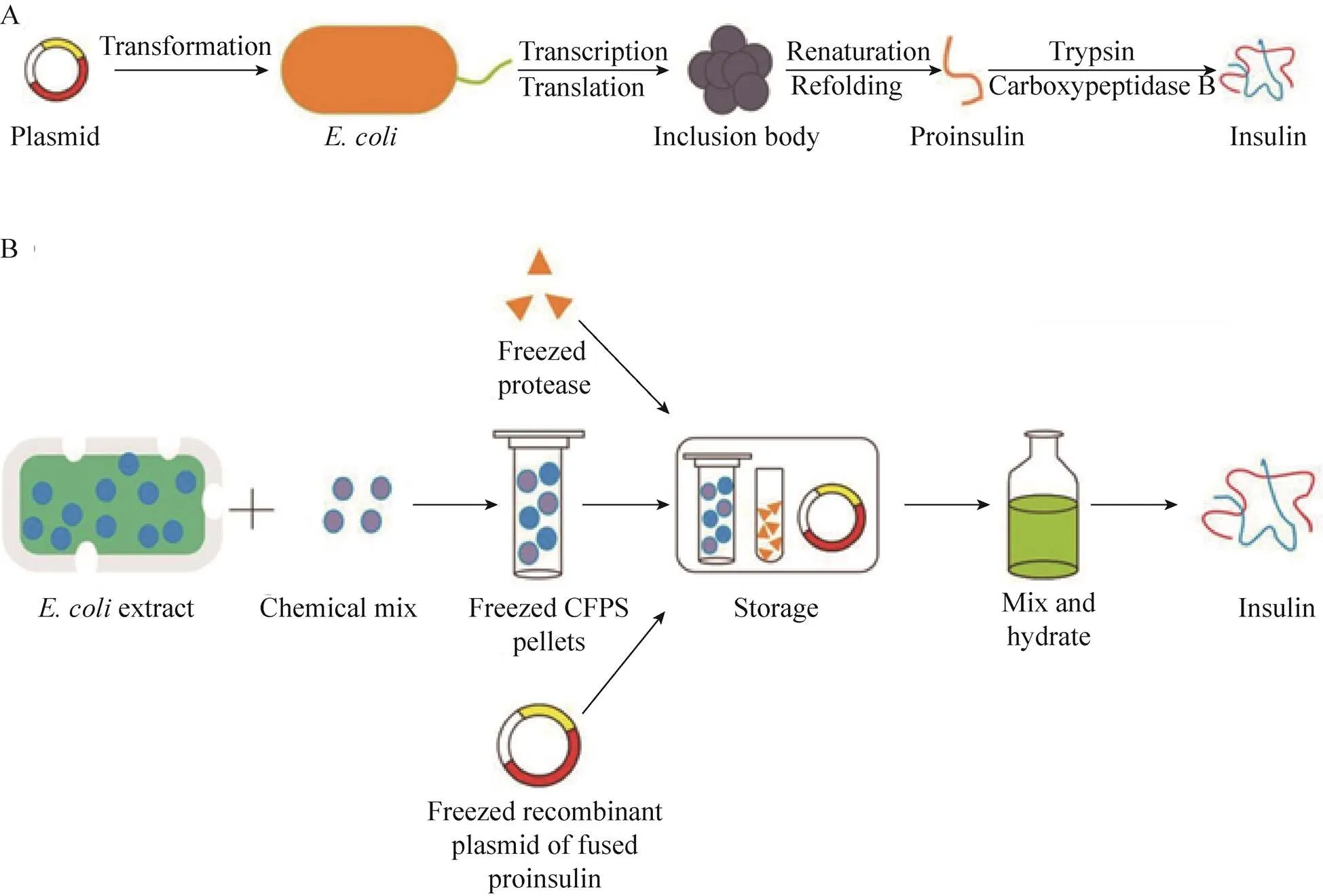
图1 E. coli生产胰岛素流程图及CFPS合成胰岛素的示意图(改编自文献[16])。(A) E. coli生产胰岛素流程图。(B)新型CFPS合成胰岛素实验设计。
2.2 质粒构建
表达胰岛素原的重组质粒及融合荧光蛋白的胰岛素原表达质粒的设计如图2所示。胰岛素原基因克隆至载体pET-28a(+)获得重组质粒pYH1,经Ⅰ和d Ⅲ双酶切验证,获得产物长度为268 bp,与理论长度一致 (图3)。为了实现胰岛素原的可溶性表达,构建了融合红色荧光蛋白 (mCherry) 的胰岛素原重组质粒pYH2,通过PCR分别扩增基因片段和重组质粒pYH1,获得产物长度为778 bp和5 535 bp,结果与预期大小相符。由于pYH2载体上有2个Ⅰ酶切位点,使用Ⅰ单酶切验证重组质粒,获得2个片段,长度分别为5 433 bp和780 bp,与理论长度相符,证明重组质粒pYH2构建成功 (图4)。构建编码融合绿色荧光蛋白 (eGFP) 与胰岛素原融合基因重组质粒pYH3,PCR分别扩增基因片段和重组质粒pYH1,获得产物长度为787 bp和5 535 bp,结果与预期长度相符。以Ⅰ和Ⅰ双酶切验证重组质粒,获得2个片段,长度分别为3 819 bp和2 403 bp (图5),证明重组质粒pYH3构建成功。同时在pYH2和pYH3质粒中胰岛素原与荧光蛋白之间均加入了氨基酸序列为PSCSSPSP的连接以降低融合对蛋白折叠的影响。
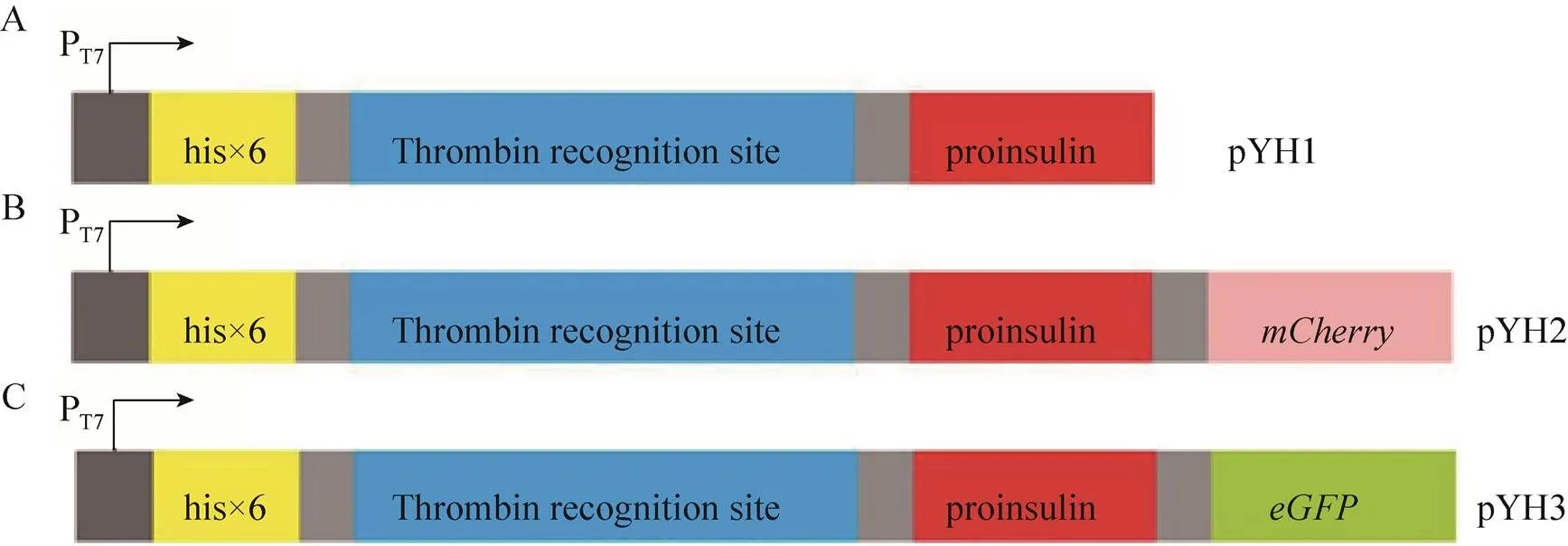
图2 本研究所构建的质粒示意图。(A)表达胰岛素原的重组质粒pYH1的构建。(B) 融合红色荧光蛋白的胰岛素原重组质粒pYH2的构建。(C)融合绿色荧光蛋白的胰岛素原重组质粒pYH3的构建。
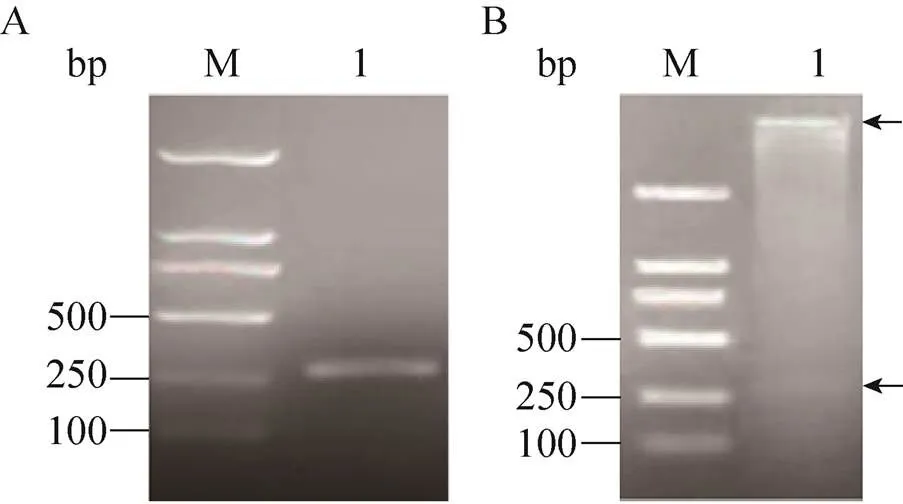
图3 pins基因的PCR扩增及质粒pYH1的酶切验证结果。(A)PCR扩增胰岛素原基因(pins)。(B)表达胰岛素原的重组质粒pYH1的双酶切验证。
2.3 CFPS表达eGFP的紫外透照仪检测
为确定本次构建的CFPS体系能合成蛋白质,在CFPS体系中加入编码基因的质粒,利用CFPS合成eGFP,采用紫外透照仪使用365 nm波长进行初步检测。结果如图6所示,证明构建的CFPS体系能成功表达eGFP蛋白,可用于后续蛋白质的体外合成。
2.4 CFPS表达胰岛素原的Western blotting分析
在证明CFPS系统可用于合成eGFP后,在CFPS系统中加入编码胰岛素原的质粒pYH1来利用CFPS体系表达胰岛素原。Western blotting实验结果显示,胰岛素原在CFPS中成功合成,大小为11.7 kDa,但是表达的胰岛素原主要以包涵体的形式存在于沉淀中,无可溶性表达 (图7)。
2.5 CFPS表达融合荧光蛋白的胰岛素原及其定量分析
通过在CFPS系统中加入重组质粒pYH2表达融合红色荧光蛋白的胰岛素原 (Pins- mCherry),通过Western blotting对其进行定性分析,结果显示Pins-mCherry成功在CFPS系统中表达,大小为39.1 kDa (图8)。在后续实验中,由于荧光蛋白受激发光的特性,采用酶标仪对融合蛋白的荧光强度进行检测来对融合蛋白进行定量分析。在大肠杆菌中表达pYH3质粒并纯化了Pins-eGFP蛋白,首先利用BCA试剂盒测定大肠杆菌来源的纯化的Pins-eGFP浓度,将稀释不同倍数的Pins-eGFP的浓度关于荧光强度的关系绘制成标准曲线。将重组质粒pYH3加入CFPS反应后进行离心,取上清检测荧光强度,其相对荧光强度为 (2 037.68±272.93)。Pins-eGFP浓度关于荧光强度的线性相关公式为:= 0.005 01+ 2.079,2= 0.995 37 (图9)。通过计算得到该体系表达可溶性Pins-eGFP融合蛋白的浓度为(12.28±3.45) μg/mL。
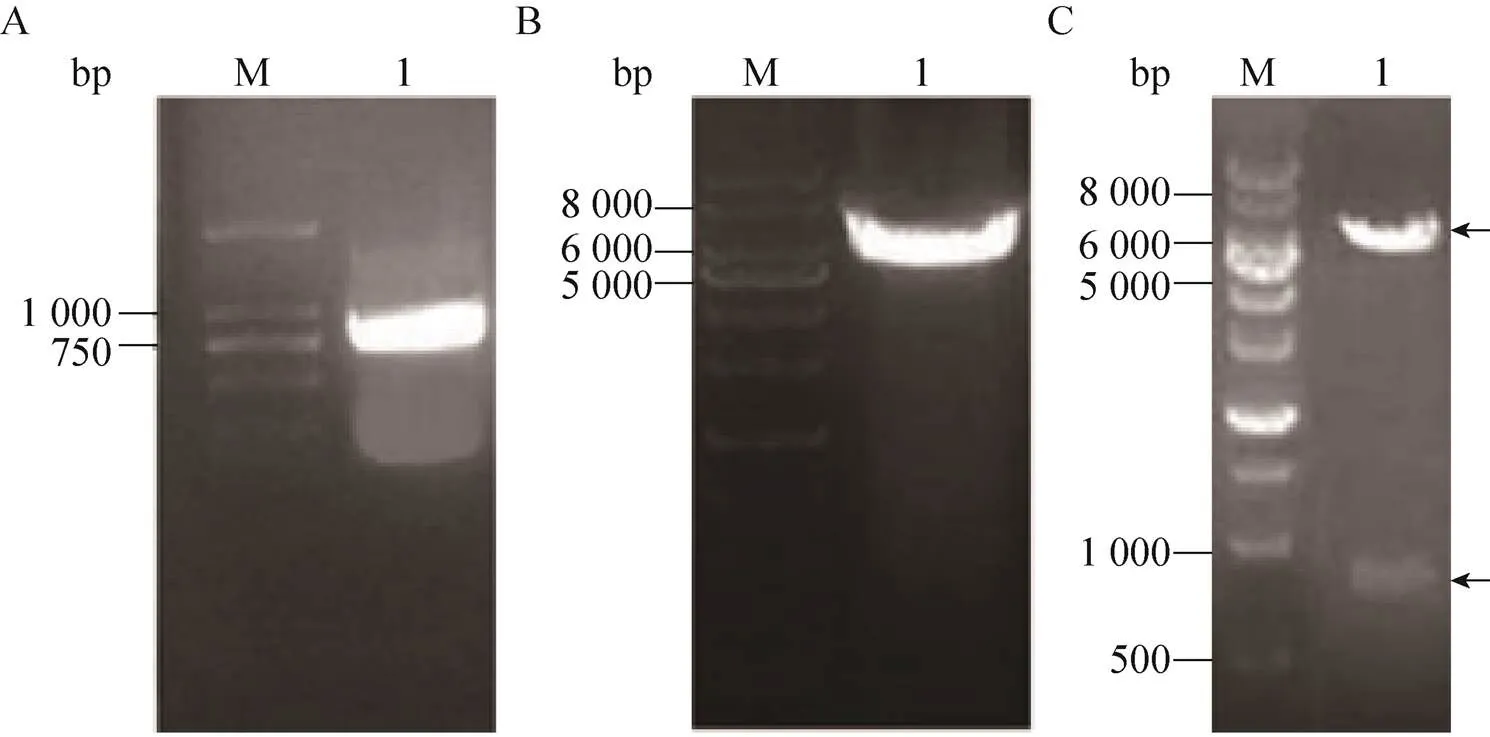
图4 PCR扩增和pYH2酶切验证结果。(A) PCR扩增红色荧光蛋白基因 (mCherry)。(B)PCR扩增表达胰岛素原的重组质粒pYH1。(C)融合红色荧光蛋白的胰岛素原重组质粒pYH2的酶切验证。
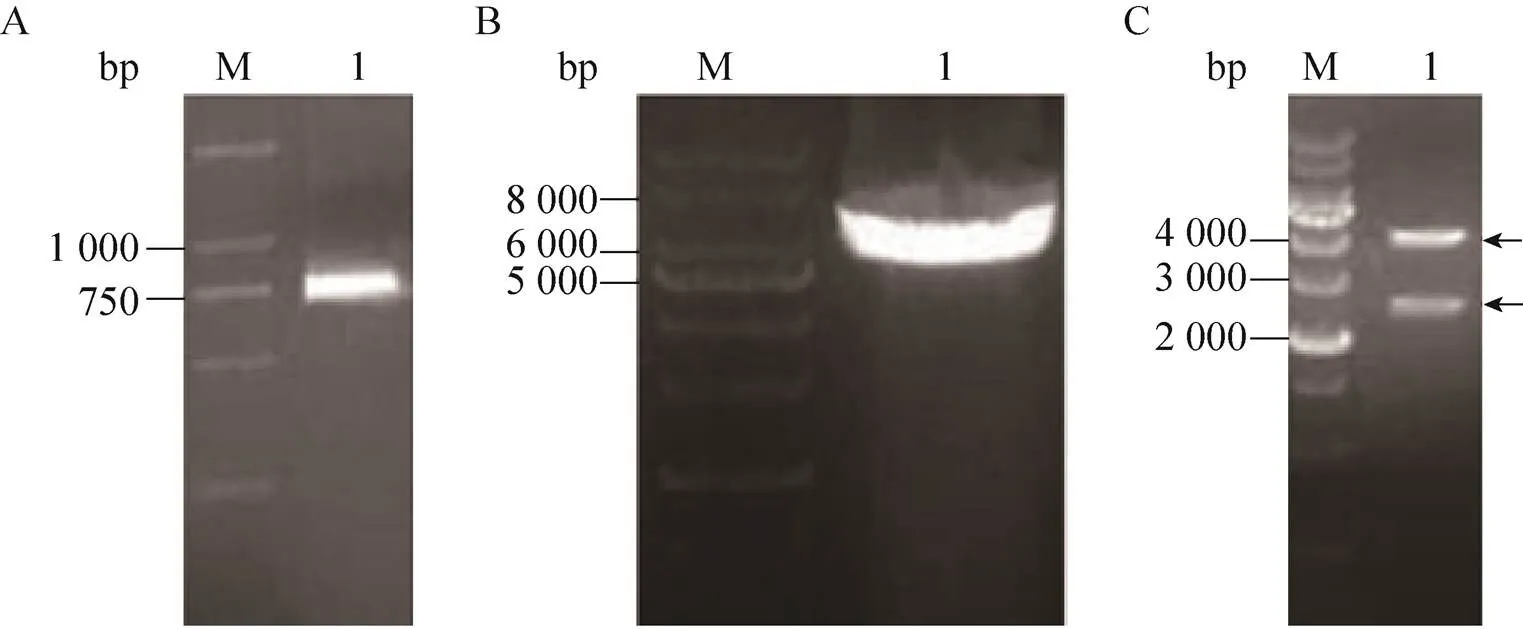
图5 PCR扩增和pYH3酶切验证结果。(A) PCR扩增绿色荧光蛋白基因 (eGFP)。(B) PCR扩增表达胰岛素原的重组质粒pYH1。(C) 融合绿色荧光蛋白的胰岛素原重组质粒pYH3的酶切验证。
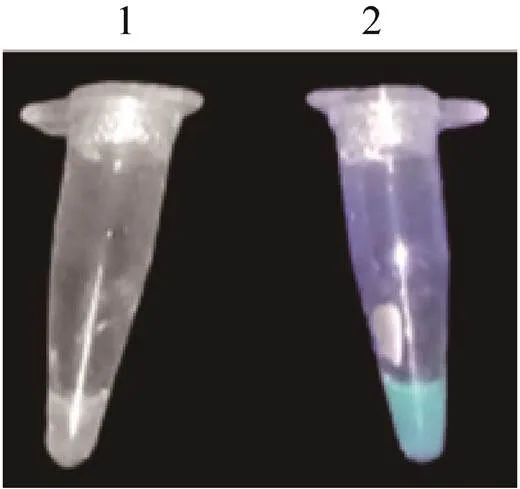
图6 CFPS表达eGFP的紫外透照仪检测(1:阴性对照组不含质粒;2:CFPS合成产物)
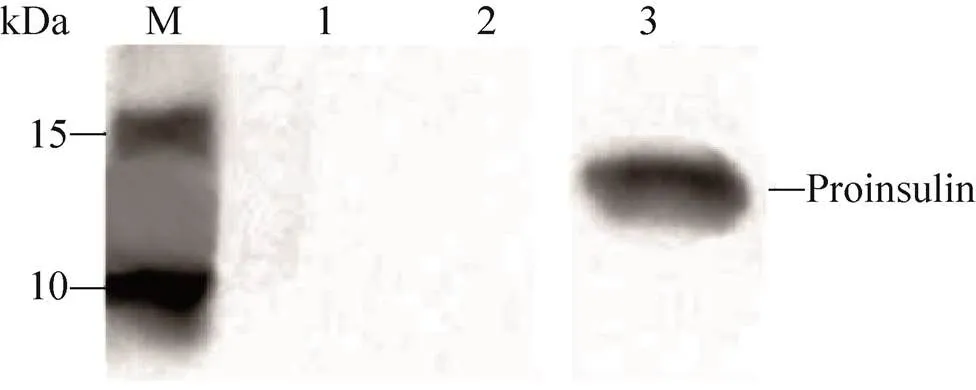
图7 CFPS表达胰岛素原的Western blotting分析(M:预染蛋白marker;1:阴性对照组不含质粒;2:CFPS反应后上清;3:CFPS反应后沉淀)
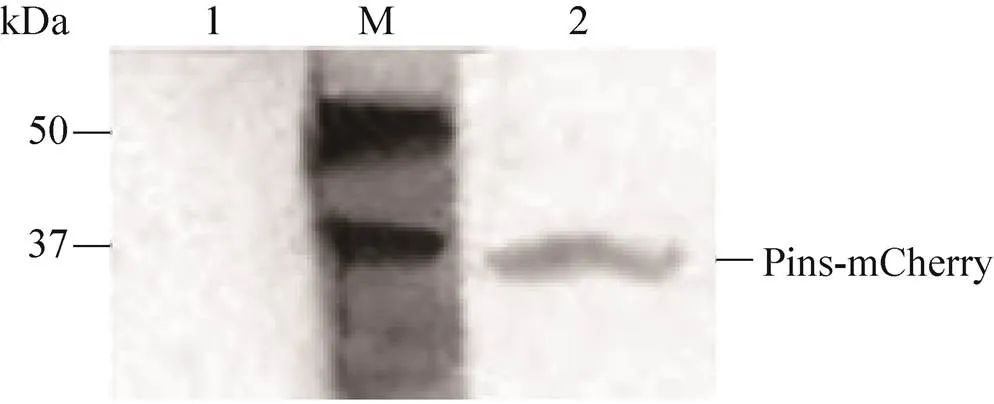
图8 CFPS表达Pins-mCherry蛋白的Western blotting分析(M:预染的蛋白marker;1:阴性对照组不含质粒;2:CFPS表达产物)
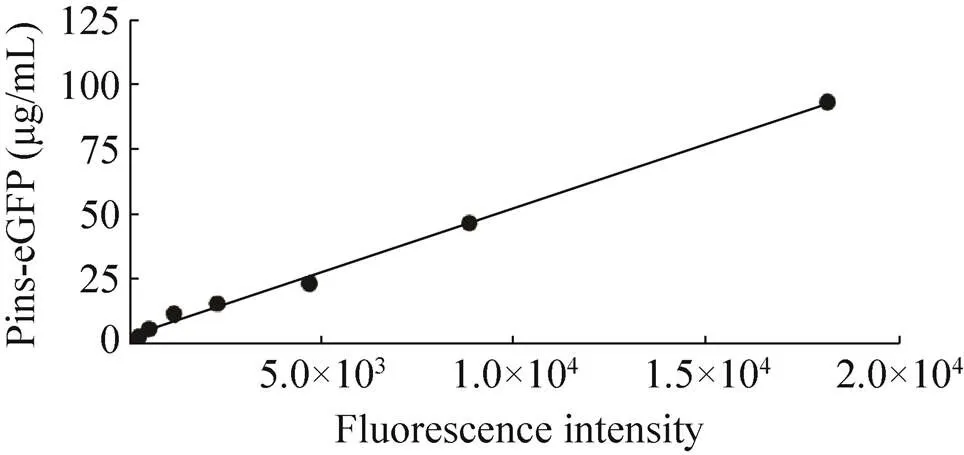
图9 Pins-eGFP浓度关于荧光强度的标准曲线
3 讨论
胰岛素是由胰岛β细胞产生的一种蛋白质类激素,是临床上治疗糖尿病的重要药物。目前,工业上通过DNA重组技术进行合成胰岛素方法已经相当成熟[20-21]。临床上最为常用的胰岛素给药途径为注射给药,随着糖尿病人群的日益增多,开发一种新的胰岛素给药方式一直是一项热点问题。在大肠杆菌表达系统中,胰岛素原易形成不溶性的包涵体,需要经过复杂的加工过程才能合成有活性的胰岛素;而酵母合成的胰岛素原容易积累在胞内,不能有效分泌至胞外[22-23]。无细胞蛋白合成体系是一个开放的体系,去除了细胞膜的限制,可以方便地对其组分进行控制,对毒性蛋白的耐受力高,使得许多很难在体内顺利合成的复杂蛋白在体外顺利表达。近年来已经逐渐被应用于高通量药物筛选、大规模生产重组蛋白药物[24]。但是在CFPS系统合成胰岛素原只有通过加入去垢剂的方式才能使其可溶性表达,否则大部分胰岛素原仍然以包涵体的形式存在。
为了解决这一问题,本研究成功构建了基于BL21(DE3)的CFPS表达体系,首次通过融合荧光蛋白的策略实现了胰岛素原在CFPS中的可溶性表达。通过Pins-eGFP对融合蛋白进行定量,其在CFPS系统中的产量为(12.28±3.45) μg/mL。并且融合蛋白的设计也为后续在CFPS系统中将胰岛素原进一步加工为成熟的胰岛素原提供便利,例如可以将蛋白酶切割位点构建到连接肽上方便切割。相较于采用连续流CFPS系统而言,本研究胰岛素原的产量水平还不够高,在后续的研究中可以通过采取连续反应的方式来进一步提升产量。除此之外,还可以通过添加氧化剂和二硫键异构酶DsbC等策略来促进二硫键的形成和蛋白折叠,从而增加胰岛素的可溶性表达[25-27]。
如前文所述,为了改善注射给药方式患者依从性差及副作用的缺点,诸如口服给药、吸入式给药、直肠给药和皮下芯片等方式被提出作为新的胰岛素给药方式[28-29]。但是这些方式也有一些问题亟待解决,例如吸入式给药途径容易引起肺功能的改变、增加患肺癌的风险、剂量不易控制价格昂贵、携带不方便等;口服给药需要面对如何防止消化道蛋白酶分解的问题[30]。在应用CFPS系统开发给药装置的探索中,Collins等通过将CFPS组分冻干,制备成便携式微型药物合成工厂。但是运用CFPS系统来生产胰岛素还有诸如表达可溶性胰岛素原,提高胰岛素原表达量,以及将胰岛素原加工为成熟胰岛素等关键问题需要解决。因此,本研究结果为胰岛素原在无细胞体系中的可溶性表达及后续加工提供了良好的工作基础,并为开发胰岛素新型给药途径提供了有用的信息。但是诸如CFPS系统中合成的可溶性的融合蛋白是否具有免疫活性以及如何利用CFPS合成有活性的胰岛素等仍有待进一步研究。
[1] Hu FB, Satija A, Manson JE. Curbing the diabetes pandemic: the need for global policy solutions. JAMA, 2015, 313(23): 2319–2320.
[2] Zaykov AN, Mayer JP, DiMarchi RD. Pursuit of a perfect insulin. Nat Rev Drug Discov, 2016, 15: 425–439.
[3] Nicol S, Smith M. Amino acid sequence of human insulin. Nature, 1960, 187: 483–485.
[4] Ahmad B. Pharmacology of insulin. Br J Diabetes Vasc Dis, 2004, 4: 10–14.
[5] KemmlerW, Peterson JD, Steiner DF. Studies on the conversion of proinsulin to insulin I. Conversionwith trypsin and carboxypeptidase B. Biol Chem, 1971, 246(22): 6786–6791.
[6] Walsh G. Therapeutic insulins and their large-scale manufacture. Appl Microbiol Biotechnol, 2005, 67(2): 151–159.
[7] Johnson IS. Human insulin from recombinant DNA technology. Science, 1983, 219(4585): 632–637.
[8] Overton TW. Recombinant protein production in bacterial hosts. Drug Discovery Today, 2014, 19(5): 590–601.
[9] Winter J, Lilie H, Rudolph R. Renaturation of human proinsulin-a study on refolding and conversion to insulin. Anal Biochem, 2002, 310(2): 148–155.
[10] Kjeldsen T, Brandt J, Andersen AS, et al. A removable spacer peptide in an α-factor-leader/ insulin precursor fusion protein improves processing and concomitant yield of the insulin precursor in. Gene, 1996, 170(1): 107–112.
[11] Kjeldsen T, Hach M, Balschmidt P, et al. Prepro-leaders lacking N-linked glycosylation for secretory expression in the yeast. Protein Expr Purif, 1998, 14(3): 309–316.
[12] Hodgman CE, Jewett MC. Cell-free synthetic biology: thinking outside the cell. Metab Eng, 2012, 14(3): 261–269.
[13] Spirin AS, Baranov VI, Ryabova LA, et al. A continuous cell-free translation system capable of producing polypeptides in high yield. Science, 1988, 242(4882): 1162–1164.
[14] Jia XG, Deng ZX, Liu TG. Progress of cell-free protein synthesis system and its applications in pharmaceutical engineering. Acta Microbiol Sin, 2016, 56(3): 530–542 (in Chinese). 贾晓歌, 邓子新, 刘天罡. 无细胞蛋白表达体系研究进展及在生物制药领域中的应用. 微生物学报, 2016, 56(3): 530–542.
[15] Kwon YC, Jewett MC. High-throughput preparation methods of crude extract for robust cell-free protein synthesis. Sci Rep, 2015, 5: 8663.
[16] Pardee K, Slomovic S, Nguyen PQ, et al. Portable, on-demand biomolecular manufacturing. Cell, 2016, 167(1): 248.e12–259.e12.
[17] Kommer AA, Dashkova IG, Esipov RS, et al. Synthesis of functionally active human proinsulin in a cell-free translation system. Dokl Biochem Biophys, 2005, 401(1/6): 154–158.
[18] Moreau MJJ, Morin I, Schaeffer PM. Quantitative determination of protein stability and ligand binding using a green fluorescent protein reporter system. Mol Biosyst, 2010, 6(7): 1285–1292.
[19] Waldo GS, Standish BM, Berendzen J, et al. Rapid protein-folding assay using green fluorescent protein. Nat Biotechnol, 1999, 17(7): 691–695.
[20] Baeshen NA, Baeshen MN, Sheikh A, et al. Cell factories for insulin production. Microb Cell Fact, 2014, 13(141): 1–9.
[21] Goeddel DV, Kleid DG, Bolivar F, et al. Expression inof chemically synthesized genes for human insulin. Proc Natl Acad Sci USA, 1979, 76(1): 106–110.
[22] Baneyx F, Mujacic M. Recombinant protein folding and misfolding inNat Biotechnol, 2004, 22(11): 1399–1408.
[23] Singh SM, Panda AK. Solubilization and refoldingof bacterial inclusion body proteins. Biosci Bioeng, 2005, 99(4): 303–310.
[24] Carlson ED, Gan R, Hodgman CE, et al. Cell-free protein synthesis: applications come of age. Biotechnol Adv, 2012, 30(5): 1185–1194.
[25] Yin G, Swartz JR. Enhancing multiple disulfide bonded protein folding in a cell-free system. Biotechnol Bioeng, 2004, 86(2): 188–195.
[26] Kim DM, Swartz JR. Efficient production of a bioactive, multiple disulfide-bonded protein using modified extracts of. Biotechnol Bioeng, 2004, 85(2): 122–129.
[27] Min CK, Son YJ, Kim CK, et al. Increased expression, folding and enzyme reaction rate of recombinant human insulin by selecting appropriate leader peptide. Biotechnol, 2011, 151(4): 350–356.
[28] Duan XP, Mao SR. New strategies to improve the intranasal absorption of insulin. Drug Discovery Today, 2010, 15(11/12): 416–427.
[29] Owens DR, Zinman B, Bolli G. Alternative routes of insulin delivery. Diabet Med, 2003, 20(11): 886–898.
[30] Khafagy ES, Morishita M, Onuki Y, et al. Current challenges in non-invasive insulin delivery systems: a comparative review. Adv Drug Deliv Rev, 2007, 59(15): 1521–1546.
(本文责编 郝丽芳)
徐焱成 教授,一级主任医师,博士生导师,博士后流动站指导教师。武汉大学中南医院内分泌科学科带头人,内分泌和综合医疗科首席专家。原任中华医学会全国糖尿病学会副秘书长,中国医师协会内分泌代谢病分会常务委员。中华医学会湖北省糖尿病学分会主任委员。现任中华老年医学学会全国内分泌代谢分会副主任委员,中国非公医协会全国内分泌糖尿病分会副主任委员,中华医学会湖北省内分泌学分会主任委员。担任多个专业杂志编委、主编及副主编。专著18部,发表论文180余篇。享受政府津贴。承担国家自然基金和省科技攻关课题多项,获湖北省政府科技进步奖 (第一负责人) 多项。

刘天罡 2010年至今任武汉大学药学院教授,2012年依托武汉生物技术研究院成立合成微生物技术湖北省工程实验室,先后获得国家自然科学基金优秀青年基金以及万人计划青年拔尖人才项目和973项目资助。刘天罡教授及其课题组集中在代谢工程和合成生物学方向,致力于天然产物合成机制的解析以及在此基础上的微生物药物和化学品营养品的创新和高效制造,其建立的定向合成代谢策略在脂肪酸合成途径、甲羟戊酸合成途径以及聚酮合成途径的高效构建取得了一系列成果,多篇论文发表在、、、、、、、等期刊,并多次受邀在国内外会议上作相关报告。还与工业界进行密切合作,为多家企业解决了诸多实际问题。
Synthesis of soluble proinsulin in a cell-free protein synthesis system
Yuan Hu1, Yuchen Zhang2, Yancheng Xu1, and Tiangang Liu2
1,,,430071,,Key Laboratory of Combinatorial Biosynthesis and Drug DiscoveryMinistry of EducationSchool of Pharmaceutical SciencesWuhan UniversityWuhanHubeiChina
Proinsulin (Pins) is the precursor of insulin. The expression of proinsulin informs inclusion body, so that the recombinant protein should be processed with multiple steps to form active insulin. With the development in biotechnology, cell-free protein synthesis (CFPS) system is becoming a valuable tool in protein expression by decoupling the cell growth with protein production, which allows it to express proteins that would interfere with cell physiology. In this study, we synthesized soluble proinsulin in CFPS system in order to establish a new approach for both insulin expression and delivery. The soluble proinsulin was successfully expressed in CFPS system by fusing proinsulin with two types of fluorescent protein. The expression of Pins-mCherry was confirmed by Western blotting analysis, and the Pins-eGFP titer was (12.28±3.45) μg/mL in CFPS system. These results implicated that the proinsulin was expressed partially in soluble form. Here, for the first time, we successfully expressed soluble proinsulin in CFPS system by fluorescent protein fusion. These results provide useful information in developing new insulin expression and delivery method.
cell-free protein synthesis, proinsulin, fusion of fluorescentprotein, solubility, protein folding
November 17, 2016; Accepted: January 24, 2017
Yancheng Xu. Tel: +86-27-67813526; E-mail: xjl100901@whu.edu.cn;
Tiangang Liu. Tel: +86-27-68755086; E-mail: liutg@whu.edu.cn
Supported by: National Natural Science Foundation of China (No. 81370872), the Young Talents Program of National High-level Personnel of Special Support Program (The “Ten Thousand Talent Program”).
国家自然科学基金 (No. 81370872),“万人计划”青年拔尖人才资助。

