狭叶柴胡愈伤组织原生质体的制备及纯化
程玉鹏, 李天聪,林进华,李玥玥,宁愿,马爱萍,李弘琨,王洪月
(1.黑龙江中医药大学 药学院,黑龙江 哈尔滨 150040; 2.哈尔滨师范大学 生命科学与技术学院,黑龙江 哈尔滨 150024)
狭叶柴胡愈伤组织原生质体的制备及纯化
程玉鹏1,2, 李天聪1,林进华1,李玥玥1,宁愿1,马爱萍1,李弘琨1,王洪月1
(1.黑龙江中医药大学 药学院,黑龙江 哈尔滨 150040; 2.哈尔滨师范大学 生命科学与技术学院,黑龙江 哈尔滨 150024)
[目的]以狭叶柴胡愈伤组织为材料,旨在筛选出适合愈伤组织原生质体制备及纯化的最优条件。[方法]研究了酶的种类及浓度、稳渗剂种类、酶解时间及蔗糖分离液浓度等因素对狭叶柴胡愈伤组织原生质体制备和纯化的影响。[结果]最佳适宜条件为:2%纤维素酶+1%离析酶,0.6 mol·L-1甘露醇为稳渗剂,27 ℃避光预裂解2 h后酶解4 h。在最优条件下,原生质体产量可达1.26×106个·g-1。在上述条件不变情况下,用21%蔗糖溶液进行提纯,得到的原生质体纯化结果较好,纯化后原生质体产量可达0.75×106个·g-1。[结论]该研究结果为进一步利用原生质体进行狭叶柴胡基因工程工作奠定了技术基础。
狭叶柴胡; 愈伤组织; 原生质体制备; 纯化
柴胡是我国传统中药材,具有疏肝解郁,躯散退热之功效。我国药典规定柴胡或狭叶为正品供药用,即习称“北柴胡”与“南柴胡”[1]。近代药理研究表明,柴胡具有镇痛、镇静、抗炎、免疫调节及抗肿瘤等功效[2,3],柴胡资源的需求不断扩大。
植物原生质体是细胞去除坚韧细胞壁后裸露的植物细胞,是对渗透压极为敏感的球质体[4]。它保持着细胞的生理生化和遗传学的特性和功能,在植物快速繁殖、远缘遗传重组及选育优良突变体等方面具有广阔的应用前景[5]。
植物愈伤组织是薄壁松散的细胞团,其细胞壁易被水解且愈伤组织内有大量细胞间隙,是制备原生质体的理想材料[6]。本试验利用狭叶柴胡愈伤组织制备原生质体并对其进行纯化。从酶液配比、酶解时间及稳渗剂种类等方面进行考察[7~9],建立狭叶柴胡愈伤组织原生质体的制备及纯化方法,为今后利用狭叶柴胡原生质体进行遗传改良、基因工程研究和细胞内信号转导的研究奠定基础。
1 材料与方法
1.1 材料
将狭叶柴胡种子(采自黑龙江中医药大学药用植物园)培育的无菌苗,切成1 cm的小段接种到含6-BA 3 mg·L-1,2,4-D 0.1 mg·L-1,KT 0.6 mg·L-1的MS固体培养基上,在光照条件下诱导形成愈伤组织[10]。选择长势较好的愈伤组织每18 d 继代培养一次,培养基和培养条件同上。
1.2 仪器
电子天平、磁力搅拌器、超纯水仪、移液器、自动高压灭菌器、光照培养箱、恒温培养箱、荧光倒置显微镜、旋涡混匀仪、水浴锅等。
1.3 试剂的配制
1.3.1 原生质体清洗液(Cell Protoplast Washing, CPW)的配制
按照配方(KH2PO427.2 mg·L-1, KNO3101 mg·L-1, CaCl2·2H2O 1.48 g·L-1, MgSO4·7H2O 246 mg·L-1, KI 0.16 mg·L-1, CuSO4·5H2O 0.025 mg·L-1) 称取各成分于烧杯中,加入双蒸水搅拌至充分溶解,定容,过0.22 μm滤膜除菌至锥形瓶内,4 ℃冷藏备用。
1.3.2 甘露醇、氯化钾、硫酸镁稳渗剂及蔗糖分离液的配制
按照所需浓度分别称取适量甘露醇、氯化钾、硫酸镁和蔗糖,用CPW溶解后,过0.22 μm滤膜除菌至50 mL离心管内,4 ℃保存。
1.3.3 酶液的配制
称取适量固体酶溶解于0.6 mol·L-1甘露醇稳渗剂中,充分溶解后55 ℃水浴加热10 min,0.22 μm滤膜过滤除菌,备用。
1.4 原生质体的制备及纯化
1.4.1 原生质体分离酶浓度筛选
挑选疏松良好的愈伤组织0.1 g,将其切碎后置于5 mL过滤除菌的混合酶液中,27 ℃黑暗孵育预裂解2 h。酶液浓度分别为1.5%(1%纤维素酶+0.5%离析酶)、3%(2%纤维素酶+1%离析酶)、4.5%(3%纤维素酶+1.5%离析酶)。用移液枪轻轻吹打混匀,再次加入5 mL新鲜配制的酶液。27 ℃避光酶解。
1.4.2 原生质体分离稳渗剂的筛选
在由2%纤维素酶 + 1%离析酶组成的混合酶液中,选用0.6 mol·L-1甘露醇、氯化钾、硫酸镁分别作为稳渗剂进行渗透压调节,测定不同稳渗剂下原生质体的分离情况。
1.4.3 原生质体分离酶解时间筛选
在上述条件不变情况下,再次加入酶液后,分别进行2、4、6 h黑暗酶解,测定不同酶解时间下原生质体的分离情况。
1.4.4 原生质体纯化蔗糖分离液的筛选
将酶解后的原生质体溶液过200目筛网至离心管中,1 100 r·min-1离心5 min,去上清,将原生质体重悬后,沿管壁慢慢加入蔗糖含量分别为16%、21%、26%、31%的蔗糖分离液上层,1 100 r·min-1离心5 min,此时最下层为细胞碎片,而蔗糖分离液和酶液中间层为原生质体。用0.6 mol·L-1甘露醇稳渗剂轻轻洗涤2次。镜检计数。
2 结果与分析
2.1 不同酶浓度组合对原生质体产量的影响
以狭叶柴胡愈伤组织为原料,用不同酶液组合,在酶解时间为4 h,稳渗剂为0.6 mol·L-1甘露醇的条件下,进行原生质体的制备。在前期预实验中,单独使用纤维素酶或离析酶效果均不佳。本试验采用纤维素酶和离析酶混酶,实验表明酶液浓度与原生质体的产量有很大的关系,但并非呈正相关。如图1所示,结果表明2%纤维素酶 + 1%离析酶组成的混合酶液提取得到的原生质体产量最高,可达1.26×106个·g-1。

图1 不同酶浓度对原生质体产量的影响Fig.1 Effect of different enzyme concentration on yield of protoplasts
2.2 不同种类稳渗剂对原生质体产量的影响
原生质体是仅有质膜包被渗透压敏感的球质体,在低渗溶液中容易吸水胀裂,在高渗溶液中容易失水皱缩,因此需要选择适宜的稳渗剂以维持渗透压,从而保证原生质体的生存条件。此外,渗透压稳定剂对酶的活性也有一定的促进作用,是影响原生质体制备的重要因素。在狭叶柴胡愈伤组织原生质体的制备中,选用0.6 mol·L-1甘露醇、氯化钾及硫酸镁等作为稳渗剂进行筛选,结果如图2所示,用0.6 mol·L-1甘露醇做稳渗剂,原生质体产量相对较高,为1.01×106个·g-1。
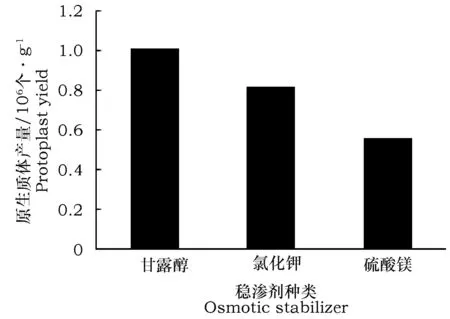
图2 不同种类稳渗剂对原生质体产量的影响Fig.2 Effect of different osmotic stabilizer on yield of protoplasts

图3 酶解时间对原生质体产量的影响Fig.3 Effect of enzymatic hydrolysis on yield of protoplasts
2.3 酶解时间对原生质体产量的影响
在确定最佳酶浓度,稳渗剂的条件下,对酶解时间进行了研究。结果如图3所示,酶解时间为2 h时,原生质体产量较低,可能是由于细酶解时间过短,导致胞壁溶解不充分,原生质体不能充分释放。当酶解时间延长至4 h时,原生质体的产量达到最佳,约为0.8×106个·g-1,而当延长时间至6 h,原生质体的产量反而有所下降,可能是由于酶解时间过长,损害细胞质膜,对原生质体产生毒害作用,导致其产量下降。
2.4 不同浓度蔗糖分离液对原生质体纯化的影响
在上述最佳条件下酶解完成后,分别研究了不同浓度的蔗糖分离液对原生质体纯化的影响。如图4所示,在一定范围内,随着蔗糖浓度的增加,纯化后的原生质体产量逐渐增加,当蔗糖浓度为26%时,原生质体收获量最大,若蔗糖浓度超过26%,原生质体产量反而有所下降,可能是与狭叶柴胡愈伤组织原生质体的细胞大小和密度有关。然而,当蔗糖溶液浓度为21%和26%时,所收获的原生质体产量差距甚微,分别为0.75×106个·g-1和0.81×106个·g-1。对这两个浓度下的提纯结果进行进一步观察,如图5所示,21%蔗糖分离液(A)的提纯效果要优于26%蔗糖分离液(B),可以看出,蔗糖浓度过高不利于除去原生质体粗提液中的细胞壁碎片或细胞碎片,从而降低原生质体纯化的效果。因此,确定浓度21%的蔗糖分离液是最优纯化条件。

图4 蔗糖浓度对原生质体纯化产量的影响Fig.4 Effect of different sucrose concentration on yield of protoplasts

(A)21% (B)26%图5 21%和26%蔗糖分离液提纯结果图Fig.5 Purification effects of 21% and 26% sucrose solution
3 结论与讨论
本试验通过优化确定原生质体制备及提纯的最佳条件为:2%纤维素酶+1%离析酶在27 ℃下黑暗预裂解2 h,再次加入酶液后酶解时间4 h,0.6 mol·L-1甘露醇为稳渗剂,21%蔗糖分离液为提纯液。在上述条件下,可以制备得到最多的纯化原生质体。纯化前后原生质体产量分别达1.26×106个·g-1和0.75×106个·g-1。
原生质体制备时,材料本身的性质和生理状态对其分离制备有很重要的影响,原生质体的制备和纯化对环境的要求十分严格[11]。愈伤组织是一团薄壁的松散的细胞团,其细胞壁易被酶解,是制备原生质体的最佳材料,因此我们选用狭叶柴胡愈伤组织为原材料,进行原生质体的制备。此外,不同酶种类对原生质体分离效果不同,如单独使用纤维素酶或离析酶虽可制得原生质体,但其效果不佳。其次,不同植物种类原生质体的分离所需要的酶液的浓度也有所差异,这可能是与不同细胞的细胞壁组成成分有关。原生质体是植物细胞去除细胞壁后,仅有质膜包被的球质体,对渗透压及其敏感,如果酶液中的渗透压和细胞内的渗透压不平衡,会造成原生质体胀破或皱缩。因此,选择合适的稳渗剂有着关键的作用。酶解时间对原生质体的产量有着一定的影响,不同植物和材料对酶解时间的要求会有所不同。时间太短,酶解不充分,原生质体难以释放,而时间过长,酶解过度会对原生质体产生毒害作用,导致原生质体皱缩或破裂,造成原生质体产量下降。酶解时间可能与所用材料,酶液的种类和浓度以及酶解温度有关,要根据实验进行相应的情况探索。此外,在原生质体提纯过程中,选用21%和26%蔗糖溶液所得到的原生质体产量虽有差异,但差异不显著,对比镜检图发现,26%的蔗糖分离液会造成细胞碎片过多,这可能是因为细胞大小和密度等的原因,使其在纯化过程中所受离心力有所不适。因此选用21%的蔗糖溶液作为提纯液,效果最佳。
原生质体是基因工程的理想受体,是去除细胞壁的敏感球质体,它保持着细胞的生理生化和遗传特性。利用基因工程技术可对原生质体进行遗传改良获得优良性状,如细胞融合,转基因及紫外诱变等[12]。此外,去除细胞壁的植物细胞在很大程度上能增加信号转导实验的可行性,如去除细胞壁之前,细胞壁中存在的非特异性酯酶会影响钙离子探针Flou-3/AM的装载,而制备原生质体后则可以使探针顺利进入胞内准确检测Ca2+[13]。狭叶柴胡原生质体的制备为进一步开展狭叶柴胡基因工程工作和检测细胞内信号转导途径奠定技术基础,同时也对狭叶柴胡次级代谢高产细胞株的选育研究提供了一定的参考。
[1]Ashour ML,Wink M.GenusBupleurum:a review of its phytochemistry, pharmacology and modes of action[J].J Pharm Pharmacol,2011,63(3):305-321.
[2]WANG Q,Zheng X L,YANG L,et al.Reactive oxygen species-mediated apoptosis contributes to chemosensitization effect of saikosaponins on cisplatin-induced cytotoxicity in cancer cells[J].Journal of Experimental & Clinical Cancer Research,2010,29(1):159-167.
[3]ZU N,LI P,LI N,et al.Mechanism of saikosaponin-d in the regulation of rat mesangial cell proliferation and synthesis of extracellular matrix protein[J].Biochemistry & cell biology,2007,85(2):169-174.
[4]董汪洋,王郑隆,杨云乔,等.杏鲍菇的菌株筛选与原生质体制备条件优化[J].浙江农业学报,2015,27(5):782-786.
[5]Kanokwan R,Kevin AS.Protoplast isolation for species in theChamelauciumgroup and the effect of antioxidant enzymes on protoplast viability[J].In Vitro Cell Dev Biol,2013,49(5):593-598.
[6]朱楠,刘俊,张馨宇,等.丹参悬浮培养细胞原生质体的制备和活力检测[J].生物工程学报,2014,30(10):1612-1621.
[7]宋少宇,张俊琦,王君.三倍体‘银中杨’叶肉原生质体制备的优化[J].西北植物学报,2015,55(9):1899-1905.
[8]孙鹤,郎志宏,朱莉,等.玉米、小麦、水稻原生质体制备条件优化[J].生物工程学报,2013,29(2):224-234.
[9]赵红娟,张博,陈爱萍,等.酶解对苜蓿子叶原生质体分离效果的影响[J].草地学报,2008,16(1):50-53.
[10]程玉鹏,林进华,李天聪,等.狭叶柴胡愈伤组织诱导的研究[J].中医药学报,2015,43(6):46-48.
[11]Tan BY,Xu M,Chen Y,et al.Transient expression for functional gene analysis usingPopulusprotoplasts[J].Plant cell,Tissue and Organ Culture,2013,114(1):11-18.
[12]Grosser JW,Gmitter FG.Protoplast fusion for production of tetraploids and triploids: applications for scion and rootstock breeding in citrus[J].Plant cell,Tissue and Organ Culture,2011,104(3):343-357.
[13]Swanson SJ,Choi WG,Chanoca A,et al.In vivo imaging of Ca2+,pH,and reactive oxygen species using fluorescent probes in plants[J].Annu Rev Plant Biol,2011,62(6):273-297.
(编辑:马荣博)
Preparation and purification of protoplasts of callus inBupleurumscorzonerifoliumWilld.
Cheng Yupeng1,2, Li Tiancong1,Lin Jinhua1, Li Yueyue1,Ning Yuan1, Ma Aiping1, Li Hongkun1, Wang Hongyue1
(1.CollegeofPharmacy,HeilongjiangUniversityofChineseMedicine,Harbin150040,China; 2.CollegeofLifeScienceandTechnology,HarbinNormalUniversity,Harbin150024,China)
[Objective]Screening the optimal condition on callus protoplast preparation and purification ofBupleurumscorzonerifoliumWilld.[Methods]The effects of some factors on the preparation and purification of protoplasts of callus were investigated, including concentration of enzyme mixture, osmotic stabilizer, incubation time and sucrose concentration.[Results]The optimal condition of protoplast isolation was: 2% Cellulase and 1% Macerozyme, mannitol of 0.6 mol·L-1as osmotic stabilizer, enzymatic hydrolysis 4 h after pre-enzymatic hydrolysis 2 h at 27℃ in dark, the protoplast yield could reach up to 1.26×106per gram of callus. Under this condition, different concentration of sucrose solution was used for protoplast purification. The yield was up to 0.75×106per gram of callus when purified with sucrose at the concentration of 21%.[Conclusion]In conclusion, these results lay a technological foundation of genetic engineering inB.scorzonerifoliumWilld. by using protoplast.
BupleurumscorzonerifoliumWilld., Callus, Protoplast preparation, Purification
2016-10-13
2016-11-29
程玉鹏(1966-),男(汉),黑龙江哈尔滨人,副教授,博士,研究方向:中药生物技术
国家自然科学基金(81573539);黑龙江省自然科学基金(H2015042)
Q242
A
1671-8151(2017)04-0254-04

