共沉默Birc5和Hspa5的双干扰siRNA质粒载体构建及鉴定*
王强,潘丽红,吕丹,朱慧芬
1武汉科技大学医学院病原生物与免疫学系,武汉 4300652杭州医学院病原生物与免疫学教研室,杭州 3100003华中科技大学同济医学院基础医学院免疫学系,武汉 430030
共沉默Birc5和Hspa5的双干扰siRNA质粒载体构建及鉴定*
王 强1, 潘丽红2△, 吕 丹1,朱慧芬3
1武汉科技大学医学院病原生物与免疫学系,武汉 4300652杭州医学院病原生物与免疫学教研室,杭州 3100003华中科技大学同济医学院基础医学院免疫学系,武汉 430030
目的 构建共沉默Birc5和Hspa5的双干扰siRNA质粒,为进一步以Birc5和Hspa5作为肿瘤生物治疗靶点研究提供基础。方法 使用Ambion Target Finder设计Birc5和Hspa5 mRNA的干扰序列;挑取酶切鉴定正确的质粒转化菌液Birc5-siRNA和Hspa5-siRNA测序鉴定;采用分子克隆技术构建特异性沉默Birc5和Hspa5的双干扰siRNA质粒,命名为pgsiRNA-Birc5+Hspa5,酶切鉴定;将pgsiRNA-Birc5+Hspa5转染HepG2细胞48 h后采用Real-time PCR检测Birc5和Hspa5的mRNA表达水平。结果 经酶切鉴定正确的质粒转化菌液Birc5-siRNA和Hspa5-siRNA测序结果显示均为插入正确的克隆质粒;经酶切鉴定分析显示pgsiRNA-Birc5+Hspa5符合酶切鉴定结果;转染pgsiRNA-Birc5+Hspa5 48 h后HepG2细胞Birc5和Hspa5 mRNA表达均显著下降,未转染组Birc5和Hspa5 mRNA的相对表达量均为1.0,pgsiRNA-Birc5+Hspa5组Birc5为0.15(P<0.05),Hspa5为0.37(P<0.05),表明双干扰载体构建成功。结论 成功构建了Birc5和Hspa5双干扰siRNA质粒,为进一步同时靶向沉默肿瘤Birc5和Hspa5基因研究提供了工具和基础。
Birc5; Hspa5; siRNA
肿瘤的发生发展是一个非常复杂的过程,涉及多因素的参与,其病因及发生机制尚不完全清楚。研究证明Birc5选择性高表达于多种肿瘤,与肿瘤的级别增高、高复发率和患者的低存活率相关联,而在正常组织低表达[1-2]。沉默其表达可作为诱导肿瘤细胞凋亡的策略,然而通过单一沉默Birc5的表达诱导肿瘤细胞凋亡并未取得满意的效果。肿瘤微环境存在不利因素时,肿瘤细胞高表达Hspa5以对抗凋亡,并促进肿瘤的耐药、复发及转移[3-4]。本课题组前期研究发现Birc5和Hspa5在肝细胞癌患者的组织标本和肿瘤细胞系中高表达,推测其与肿瘤发生发展有关。在此基础上构建共沉默Birc5和Hspa5的双干扰siRNA质粒,为探讨沉默肿瘤细胞Birc5和Hspa5基因协同诱导肿瘤细胞凋亡的效应及机制提供基础。
1 材料与方法
1.1 材料和试剂
大肠埃希菌DH5α株由武汉科技大学医学院病原生物与免疫学系保存;线性化质粒PEGFP6-1、PEGFP6-3载体和pGenesil-8购自Genesil公司;DNA纯化、质粒提取、纯化试剂盒购自QIAGEN公司;酶BamHⅠ、HindⅢ、T4 DNA Ligase、EcoRⅠ、SalⅠ、MluⅠ、XbaⅠ、PstⅠ购自TaKaRa公司;脂质体LipofectamineTM2000购自Invitrogen公司;SYBR Green Real-time PCR Master Mix购自TOYOBO公司。HepG2(肝癌细胞株)由华中科技大学同济医学院免疫学系惠赠。
1.2 siRNA序列的设计与合成
利用Ambion Target Finder设计Birc5和Hspa5特异性的小干扰RNA序列。利用BLAST搜索针对人类Birc5 mRNA(Genbank accession no.NM_001168.1)外显子1(5′-GGACCACCGCATCTCTACATT-3′)和外显子3(5′-AGCATTCGTCCGGTTGCGCTT-3′)的21核苷酸系列,构建针对Birc5的干扰质粒,分别命名为pgsiRNA-Bir1和pgsiRNA-Bir2。同时设计针对Hspa5的siRNA序列,选择针对人类Hspa5 mRNA(Genbank accession no.NM_005347)的1872-1890(5′-GGAGCGCATTGATACTAGA-3′)的19核苷酸系列,构建针对Hspa5的干扰质粒,命名为pgsiRNA-Hsp。通过预实验发现pgsiRNA-Bir2比pgsiRNA-Bir1更有效沉默肿瘤细胞Birc5表达,故选择Birc5-siRNA2和Hspa5-siRNA重组构建同时沉默Birc5和Hspa5的双干扰质粒,命名为pgsiRNA-Birc5+Hspa5。
引物结构:BamHⅠ+Sense+Loop+Antisense+终止信号+EcoRⅠ/SalⅠ+HindⅢ
1.3 载体的构建
流程图见图1。
1.3.1 Birc5-siRNA、Hspa5-siRNA分别与线性化质粒PEGFP6-1、PEGFP6-3连接 各取5 μL过夜连接产物转化感受态大肠埃希菌DH5α,分别涂布于Kanar抗性(30 μg/mL)的LB平板上选择培养。用试剂盒小提质粒后酶切鉴定,EcoRⅠ酶切鉴定Birc5-siRNA,SalⅠ酶切鉴定Hspa5-siRNA。取酶切鉴定正确的质粒转化菌液测序。

图1 Birc5、Hspa5双干扰载体构建流程图Fig.1 Flow chart of construction of the double interference vector of Birc5 and Hspa5
1.3.2MluⅠ和XbaⅠ双酶切质粒pGenesil-8、Birc5-siRNA、Hspa5-siRNA 利用1%Agarose凝胶电泳分离回收质粒pGenesil-8大片段和Birc52-siRNA、Hspa5-siRNA小片段,分别连接Birc5-siRNA、Hspa5-siRNA小片段与pGenesil-8大片段;取5 μL连接产物转化DH5α,涂在Kanar抗性LB平板培养。小量提取质粒后用SalⅠ酶切鉴定。
1.3.3SalⅠ+PstⅠ双酶切质粒Birc5-siRNA2、Hspa5-siRNA 分别回收大片段和小片段,连接Birc5-siRNA大片段与Hspa5-siRNA小片段。取5 μL过夜连接产物转化DH5α,涂于Kanar抗性LB平板培养。小提质粒后用BamHⅠ酶切鉴定。
1.3.4MluⅠ和XbaⅠ双酶切质粒pGenesil-8、Birc5-siRNA+Hspa5-siRNA 回收pGenesil-8大片段、Birc5-siRNA+Hspa5-siRNA小片段,连接Birc5-siRNA+Hspa5-ShRNA小片段与pGenesil-8大片段,取5 μL连接产物转化DH5α,涂于Kanar抗性LB平板培养。小提质粒后用MluⅠ+XbaⅠ酶切鉴定。
1.4 Real-time PCR检测Birc5和Hspa5的mRNA表达水平
用LipofectamineTM2000将pgsiRNA-Birc5+Hspa5转染肝癌细胞株HepG2,转染后48 h收集细胞;提取细胞总RNA,逆转录cDNA,利用实时荧光定量PCR检测Birc5和Hspa5的mRNA表达水平。重复实验3次。
1.5 统计学方法
2 结果
2.1EcoRⅠ酶切PEGFP6-1-Birc5鉴定
质粒PEGFP6-1的多克隆位点(MCS)如下:-MluⅠ-HindⅢ-shRNA-BamHⅠ-U6 Promoter-EcoRⅠ-SalⅠ-XbaⅠ-PstⅠ-。PEGFP6-1和Birc5的siRNA序列各含一个EcoRⅠ酶切位点,质粒Birc5-1和Birc5-3均被EcoRⅠ酶切出一条约400 bp的DNA条带,说明目的基因片段Birc5已插入PEGFP6-1(图2)。

1:DL2000 Marker;2:Birc5-siRNA2-1 EcoRⅠ;3:Birc5-siRNA2-2 EcoRⅠ;4:Birc5-siRNA2-3 EcoRⅠ图2 EcoRⅠ酶切PEGFP6-1-Birc5电泳图谱Fig.2 1%Agarose gel electrophoretogram of PEGFP6-1-Birc5 after EcoRⅠ digestion
2.2SalⅠ酶切PEGFP6-3-Hspa5鉴定
质粒PEGFP6-3的MCS如下:-MluⅠ-HindⅢ-shRNA-BamHⅠ-U6 Promoter-XbaⅠ-PstⅠ-。PEGFP6-3无SalⅠ酶切位点,而Hspa5-siRNA被设计了一个SalⅠ酶切位点,故质粒Hspa5-siRNA能被SalⅠ酶切,说明目的基因片段Hspa5-siRNA已插入PEGFP6-3(图3)。
挑取酶切鉴定正确的质粒转化菌液Birc5-siRNA和Hspa5-siRNA送公司测序。测序结果显示:均为插入正确的克隆质粒。
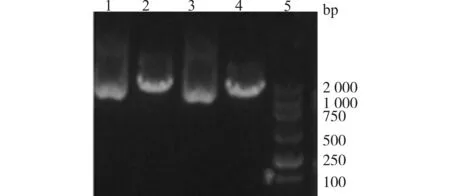
1,3:Hspa5-siRNA;2,4:Hspa5-siRNA SalⅠ;5:DL2000 Marker图3 SalⅠ酶切PEGFP6-3-Hspa5电泳图谱Fig.3 Electrophoretogram of PEGFP6-3-Hspa5 after SalⅠ digestion
2.3 pgsiRNA-Birc5载体鉴定
上述过渡载体PEGFP6-1-Birc5和pGenesil-8经MluⅠ和XbaⅠ双酶切,连接并转化感受态DH5α,Kanar抗性培养筛选,小提质粒后用EcoRⅠ酶切鉴定。pGenesil-8载体的MCS如下:-CMV Promoter-NheⅠ-BglⅡ-XhoⅠ-EcoRⅠ-PstⅠ-IRES-EGFP-SV40polyA;-MluⅠ-shRNA-U6 Promoter-XbaⅠ-。Bir2片段插入pGenesil-8的MluⅠ和XbaⅠ之间,如插入正确,可被EcoRⅠ酶切出一条约1 600 bp的DNA条带,pgsiRNA-Bir2符合酶切鉴定结果(图4)。

1:DL2000 Marker;2:pgsiRNA-Bir2;3:pgsiRNA-Bir2 EcoRⅠ图4 EcoRⅠ酶切pgsiRNA-Bir电泳图谱Fig.4 Electrophoretogram of pgsiRNA-Bir after EcoRⅠ digestion
2.4 pgsiRNA-Hspa5载体鉴定
上述过渡载体PEGFP6-3-Hsp和质粒pGenesil-8分别经MluⅠ和XbaⅠ双酶切,连接抗性培养筛选,小提质粒用SalⅠ做酶切鉴定分析,质粒pGenesil-8的多克隆位点(MCS)如下:-CMV Promoter-NheⅠ-BglⅡ-XhoⅠ-EcoRⅠ-PstⅠ-IRES-EGFP-SV40 polyA;-MluⅠ-Hspa5-shRNA-U6 Promoter-XbaⅠ-。Hspa5-siRNA片段插入质粒pGenesil-8的MluⅠ和XbaⅠ之间,如插入正确,就能被SalⅠ所酶切。经酶切鉴定分析:Hspa5-siRNA插入正确(图5)。

1:DL2000 Marker;2,4,6:pgsiRNA-Hspa5;3,5,7:pgsiRNA-Hspa5 SalⅠ图5 SalⅠ酶切质粒pgsiRNA-Hspa5后1%琼脂糖凝胶电泳图谱Fig.5 1%Agarose gel electrophoretogram of pgsiRNA-Hspa5 after SalⅠ digestion
2.5 pgsiRNA-Birc5+Hspa5载体鉴定
2.5.1 双干扰过渡载体PEGFP6-1-Birc5-siRNA+Hspa5-siRNA的构建与鉴定 目的基因片段Birc5-siRNA与Hspa5-siRNA连接成功后的MCS应为:-MluⅠ-HindⅢ-Birc52-BamHⅠ-U6 Promotor-Hspa5-shRNA-BamHⅠ-U6 Promotor-XbaⅠ-PstⅠ-,BamHⅠ酶切可见400 bp左右DNA条带,符合设计要求,故均为插入正确的质粒(图6)。

1:DL2000 Marker;2,3,5,6,8:Birc5-siRNA+Hspa5-siRNA;4,7:Birc5-siRNA+Hspa5-siRNA BamHⅠ图6 BamHⅠ酶切PEGFP6-1-Birc5-siRNA+Hspa5-siRNA电泳图谱Fig.6 Electrophoretogram of PEGFP6-1-Birc5-siRNA+Hspa5-siRNA after BamHⅠ digestion
2.5.2 Birc5-siRNA+Hspa5-siRNA插入质粒pGenesil-8 上述过渡载体PEGFP6-1-Birc5-siRNA+Hspa5-siRNA和质粒pGenesil-8经MluⅠ和XbaⅠ双酶切,连接后转化DH5α,抗性筛选后小提质粒,用MluⅠ+XbaⅠ做酶切鉴定。pGenesil-8的MCS如下:-CMV Promoter-NheⅠ-BglⅡ-XhoⅠ-EcoRⅠ-PstⅠ-IRES-EGFP-SV40polyA;-MluⅠ-shRNA-U6 Promoter-XbaⅠ-。Birc5-siRNA+Hspa5-siRNA片段插入质粒pGenesil-8的MluⅠ和XbaⅠ之间,如插入正确,MluⅠ+XbaⅠ酶切可见800 bp的DNA条带;酶切鉴定分析:Birc5-siRNA+Hspa5-siRNA插入正确(图7)。

1:DL2000 Marker;2,4,6:pGenesil-8-Birc5-siRNA+Hspa5-siRNA;3,5,7:pGenesil-8-Birc5-siRNA+Hspa5-siRNA MluⅠ+XbaⅠ图7 MluⅠ、XbaⅠ酶切质粒PEGFP6-1-Birc5-siRNA+Hspa5-siRNA后电泳图谱Fig.7 Electrophoretogram of PEGFP6-1-Birc5-siRNA+Hspa5-siRNA after MluⅠ and XbaⅠ digestion
2.6 pgsiRNA-Birc5+Hspa5转染HepG2细胞48 h后Birc5和Hspa5的mRNA表达水平
未转染组Birc5 mRNA的相对表达量为1.0,pgsiRNA-Birc5+Hspa5组为(0.152±0.018),经统计学分析,P<0.05。结果表明pgsiRNA-Birc5+Hspa5对Birc5的干扰效应显著。未转染组Hspa5的相对表达量为1.0,pgsiRNA-Birc5+Hspa5组为(0.373±0.025),经统计学分析,P<0.05。结果表明pgsiRNA-Birc5+Hspa5对Hspa5的干扰效应显著。
3 讨论
凋亡抑制蛋白是近年来发现的凋亡调控蛋白家族成员,在多物种中广泛存在,包括病毒、真核生物、哺乳动物等。Birc5是由142个氨基酸组成的胞质蛋白,分子量为16.5 kD,是IAP家族中分子量最小的一个成员,具有抑制细胞凋亡和调节细胞分裂的重要功能。Hspa5在内质网中可促进蛋白质的正确折叠,维持内质网正常功能;在核内,可与DNA结合上调抗凋亡分子的表达;在胞质可与Caspase 7、12结合,阻止Caspase 12释放入胞质后所启动的内质网应激及其诱导的凋亡级联反应。Hspa5是内质网应激时的一种标志蛋白,在低氧、低糖、低Ca2+、酸中毒等应激状态下大量表达以维持内质网的稳定,保护细胞。研究表明,Hspa5蛋白在一些肿瘤组织中高表达,如乳腺癌、宫颈癌、胸腺肿瘤、结肠癌、肺癌和头颈部癌,与肿瘤细胞对化疗的抵抗性、肿瘤复发以及肿瘤患者的存活率密切相关,Hspa5所介导的应激是肿瘤细胞的一种自我保护机制[5-6]。联合抑制Hspa5表达代表了一种新颖的诱导肿瘤细胞凋亡、根除残存肿瘤的方法。
本课题组前期研究工作证明,以Birc5作为抗肿瘤的靶点,采用反义寡聚核苷酸、核酶、Birc5突变体、干扰RNA等策略具有沉默其表达与诱导肿瘤细胞凋亡效应,但其效应有待增强。本课题即采用RNA干扰技术,利用针对Birc5编码基因的不同序列siRNA重组质粒,即pgsiRNA-Bir1、pgsiRNA-Bir2,导入肝癌细胞株HepG2中,结果显示siRNA能抑制肿瘤细胞Birc5的表达,诱导肿瘤细胞的凋亡,且在以上两组质粒中pgsiRNA-Bir2沉默Birc5及诱导细胞凋亡的效果最为显著,pgsiRNA-Bir1次之,表明选择最有效siRNA序列对于其发挥基因沉默作用有着重要意义。此外,我们发现Birc5在临床肝细胞癌组织、肝癌细胞系HepG2中均高表达,这提示Birc5是肝癌细胞存活、抵抗凋亡的重要因子;Hspa5在临床肝细胞癌组织(与癌旁组织相比)细胞质中高表达,在肝癌细胞系HepG2胞质中有表达[7],其意义值得深入研究。
基于此,我们设计并构建了共沉默Birc5和Hspa5的双干扰siRNA质粒,为进一步探讨同时干扰肿瘤细胞Birc5和Hspa5基因诱导肿瘤细胞凋亡的效应及其机制打下了基础。Birc5和Hspa5的双干扰siRNA质粒可望作为一种安全、高效的肿瘤细胞凋亡诱导剂,在治疗相关肿瘤中广泛应用。
[1] Nigam J,Chandra A,Kazmi H R,et al.Expression of serum survivin protein in diagnosis and prognosis of gallbladder cancer:a comparative study[J].Med Oncol,2014,31(9):167.
[2] Ghanbari P,Mohseni M,Tabasinezhad M,et al.Inhibition of survivin restores the sensitivity of breast cancer cells to docetaxel and vinblastine[J].Appl Biochem Biotechnol,2014,174(2):667-681.
[3] Visioli F,Wang Y,Alam G N,et al.Glucose-regulated protein 78(Grp78)confers chemoresistance to tumor endothelial cells under acidic stress[J].PLoS One,2014,9(6):e101053.
[4] Chiu C C,Lee L Y,Li Y C,et al.Grp78 as a therapeutic target for refractory head-neck cancer with CD24(-)CD44(+)stemness phenotype[J].Cancer Gene Ther,2013,20(11):606-615.
[5] Raiter A,Vilkin A,Gingold R,et al.The presence of anti-GRP78 antibodies in the serum of patients with colorectal carcinoma:a potential biomarker for early cancer detection[J].Int J Biol Markers,2014,29(4):e431-e435.
[6] Tanimoto R,Sakaguchi M,Abarzua F,et al.Down-regulation of BiP/ GRP78 sensitizes resistant prostate cancer cells to gene-therapeutic overexpression of REIC/Dkk3[J].Int J Cancer,2010,126(7):1562-1569.
[7] Wang Q,Shu R,He H,et al.Co-silencing of Birc5(survivin)and Hspa5(Grp78)induces apoptosis in hepatoma cells more efficiently than single gene interference[J].Int J Oncology,2012,41(2):652-660.
(2016-09-21 收稿)
Construction and Identification of siRNA ExpressionVectors Silencing Both Birc5 and Hspa5
Wang Qiang1,Pan Lihong2△,Lv Dan1etal
1DepartmentofPathogenicBiologyandImmunology,MedicalCollegeofWuhanUniversityofScienceandTechnology,Wuhan430065,China2DepartmentofPathogenicBiologyandImmunology,HangzhouMedicalCollege,Hangzhou310000,China
Objective To construct specific siRNA vectors co-silencing the Birc5 and Hspa5 genes,thus providing a basis for researches on tumor biological targeted therapy.Methods Specific siRNA sequences targeting Birc5 and Hspa5 were designed by using Ambion Target Finder.Positive clones were identified by sequencing of Birc5-siRNA and Hspa5-siRNA and named pgsiRNA-Birc5+Hspa5.The expression levels of Birc5 and Hspa5 in HepG2 cells were detected by real-time PCR 48 h after transfection of cells with pgsiRNA-Birc5+Hspa5.Results Birc5- and Hspa5-knockdown siRNA was constructed.The results of restriction enzyme digestion and sequencing were completely correct.The expression levels of Birc5 and Hspa5 mRNA were significantly decreased in HepG2 cells after transfection with pgsiRNA-Birc5+Hspa5.The relative mRNA expression levels of Birc5 and Hspa5 were both 1.0 in the non-transfection group,0.15 and 0.37 in the transfection group(P<0.05).The results indicated that the double interference vector was constructed successfully.Conclusion The Birc5- and Hspa5-knockdown siRNA was constructed successfully,which provides a tool and basis for further study of tumor targeted therapy aimed to Birc5 and Hspa5.
Birc5; Hspa5; siRNA
*浙江医学高等专科学校人才引进项目(No.2015 B08);湖北省教育厅科学研究计划重点项目(No.D20131103)
Q782
10.3870/j.issn.1672-0741.2017.02.011
王 强,男,1976年生,副教授,博士研究生,E-mail:wangqiang@wust.edu.cn;
△通讯作者,Corresponding author,E-mail:panlh1114@126.com

