Nrf2信号因子在镉所致HEK细胞氧化损伤中的作用*
陈嘉兴, 陈智健, 吴礼康, 田亚锋, 鲜 敏, 邹志辉, 余日安△
1广东药科大学公共卫生学院,广州 5103102深圳市宝安区疾病预防控制中心,深圳 518101
Nrf2信号因子在镉所致HEK细胞氧化损伤中的作用*
陈嘉兴1, 陈智健1, 吴礼康2, 田亚锋2, 鲜 敏2, 邹志辉1, 余日安1△
1广东药科大学公共卫生学院,广州 5103102深圳市宝安区疾病预防控制中心,深圳 518101
目的 研究Nrf2信号因子在镉所致人胚肾上皮(HEK)细胞氧化应激中的作用。方法 取对数生长期HEK细胞,分别以终浓度为0、2.5、5、10、20 μmol/L的氯化镉染毒24、48和72 h后,收获细胞,采用荧光定量聚合酶链式反应法检测HEK细胞核因子NF-E2相关因子2(nuclear factor E2-related factor 2,Nrf2)mRNA相对表达水平,采用免疫印迹法检测HEK细胞Nrf2核蛋白相对翻译水平。结果 HEK细胞在染镉浓度为20 μmol/L下作用48 h,SOD活性和GSH-Px活性显著降低(均P<0.05),而作用至72 h,GSH-Px活性则有所升高;10 μmol/L和20 μmol/L镉作用72 h,MDA含量均显著高于同时间点对照组和同组24 h时间点(均P<0.05)。在10 μmol/L和20 μmol/L镉作用48和72 h,Nrf2 mRNA相对表达水平均有显著变化(均P<0.05);在20 μmol/L作用48和72 h,Nrf2核蛋白相对翻译水平显著升高(均P<0.05)。在镉染毒浓度为20 μmol/L下作用于HEK细胞72 h时,HEK细胞内GSH-Px活性、MDA含量均与Nrf2核蛋白相对翻译水平呈正相关关系(均P<0.05)。结论 镉在引起HEK细胞发生氧化应激反应的同时,还能通过诱导Nrf2信号因子的活化来抑制氧化应激损伤,其机制可能是通过促进抗氧化酶表达实现的。
氯化镉; 人胚肾上皮细胞; 氧化应激; Nrf2
镉作为环境污染物和生产性毒物,主要引起慢性肾损伤,而氧化应激是镉所致慢性肾损害的重要机制[1-2]。有研究认为,转录因子NF-E2相关因子2(nuclear factor E2-related factor 2,Nrf2)是细胞抗氧化应激的中枢调节者,在细胞介导的抗氧化应激防御反应中具有重要的作用[3]。虽然近年来不少报道表明,Nrf2信号通路的活化可通过拮抗氧化应激反应来改善镉致肾损伤[4-5],但目前Nrf2信号通路在镉引起肾细胞氧化应激反应中的作用机制仍不明确。因此,本研究选用人胚肾上皮(human embryonic kidney epithelial,HEK)细胞,应用荧光定量聚合酶链式反应法(real-time polymease chain reaction,Real-time PCR)和免疫印迹法(Western blot),研究Nrf2信号因子在镉致HEK细胞氧化损伤中的作用,为进一步研究镉的分子毒理学作用机制以及镉中毒的防治提供实验依据。
1 材料和方法
1.1 细胞、仪器和试剂
HEK细胞(南方医科大学周雪琼博士惠赠);Galaxys型二氧化碳培养箱(英国RS Biotech公司);TS100-F倒置显微镜(日本Nikon);UV-3010型可见光分光光度计(日本日立公司);Y600C电泳仪(北京君意东方电泳设备有限公司);DYCZ-24D垂直电泳槽(北京六一仪器厂);VE-186转移电泳槽(上海天能科技有限公司);BIO-RAD Gel Doc XR+凝胶成像系统(美国Bio-rad公司);Gel-Pro Analyzer-4软件(美国Media Cybernetics公司);7900 HT型Real-time PCR仪(美国Applied Biosystems公司);氯化镉(分析纯,成都市科龙化工试剂厂);磷酸盐缓冲液(Phosphate buffer solution,PBS,美国Gibco公司);达尔伯克氏改良伊格尔培养基(Dulbecco’s modified Eagle’s medium,DMEM)、胎牛血清(美国Hyclone公司);胰酶(美国Amresco公司);超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成生物工程研究所);NucBusterTMProtein Extraction Kit(德国Novagen公司);二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(北京爱德莱生物公司);化学发光辣根过氧化物酶底物(ECL)(美国Bio-rad公司);蛋白Marker(美国Thermo Scientific公司);Nrf2兔源多克隆抗体(一抗,美国Santa Cruz公司);β-actin兔源多克隆抗体(一抗,北京博奥森生物技术有限公司);辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(immunoglobulin,IgG)(二抗,美国Molecular Probes公司)PrimeScript©RT-PCR Kit(日本TaKaRa公司);PowerUpTMSYBR©Green Master Mix(美国Applied Biosystems公司)。
1.2 实验方法
1.2.1 HEK细胞培养与实验分组 将HEK细胞置于含10%胎牛血清的高糖DMEM(基础培养液)中,在37 ℃、体积分数为5%二氧化碳条件下培养,根据细胞生长状况,每2~3天传代1次。待细胞处于对数生长期时,用质量分数为0.25%的胰酶消化后接种,于细胞贴壁24 h后吸掉原培养液,加入氯化镉终浓度为2.5、5、10和20 μmol/L的基础培养液,设为2.5、5、10和20 μmol/L组,另以仅加入等体积基础培养液者作对照组(即0 μmol/L组),继续培养24、48和72 h后收获细胞,用于后续实验。
1.2.2 HEK细胞内氧化应激水平测定 将培养至终点的各组细胞培养液吸去,经常规消化与终止后制成细胞悬液,收集细胞悬液于1.5 mL的EP管中,以离心半径10 cm、2 500 r/min离心20 min(下同)后,去上清。用反复冻融法破碎细胞,以充分破坏细胞并使其释放出细胞内成分,离心后,仔细收集上清液。按照南京建成试剂盒说明书步骤操作,采用羟胺法、酶促反应法和硫代巴比妥酸比色法,以UV-3010型可见光分光光度计分别在550、412、532 nm波长下检测吸光度(A)值,分别计算SOD、GSH-Px活力和MDA含量。每个组均设5个样品,对每个样品进行1次测定。
1.2.3 HEK细胞Nrf2 mRNA相对表达水平检测采用Trizol法提取HEK细胞内RNA后,测RNA的浓度与纯度,按PrimeScript©RT-PCR Kit操作说明逆转录合成cDNA,再以cDNA为模板,采用SYBR Green染料法RT-PCR检测样品中Nrf2 mRNA相对表达水平。利用Prime 5软件进行引物设计,并由上海Invitrogen公司合成。各基因上、下游引物序列为:Nrf2(174 bp)上游引物序列:5′-TCAGCGACGGAAAGAGTATGA-3′,下游:5′-CCACTGGTTTCTGACTGGATGT-3′;GAPDH(101 bp)上游引物序列:5′-CTGGGCTACACTGAGCACC-3′,下游:5′-AAGTGGTCGTTGAGG-GCAATG-3′。反应条件为:95℃预变性5 min;95℃变性;60℃退火(延伸);溶解曲线评价PCR扩增特异性,反应条件为:95℃,60℃,95℃。以GAPDH为内参基因,应用2-ΔΔCt法对Nrf2 mRNA进行相对定量,其中,ΔΔCt =(Ct目的基因-实验组-Ct内参基因-实验组)-(Ct目的基因-对照组-Ct内参基因-对照组)。以2-ΔΔCt表示实验组目的基因相对于对照组表达的变化倍数,作为HEK细胞Nrf2 mRNA的相对表达水平。每个组均设3个样品,对每个样品进行1次测定。
1.2.4 HEK细胞Nrf2核蛋白相对翻译水平检测 细胞悬液的制备同1.2.2项,收集细胞悬液于1.5 mL的EP管中,以离心半径10 cm、500 g离心3 min,去上清,用预冷的PBS洗涤2遍,按照核蛋白提取试剂盒说明书有关步骤提取HEK细胞内核蛋白,用BCA蛋白定量试剂盒测定样品中核蛋白的浓度。
参考杨树升等[6]建立的免疫印迹法,以1:4比例将5×SDS与每组蛋白样品混匀,于沸水中变性9 min,上样。经常规电泳、转膜与封闭后,加入兔抗人Nrf2多克隆抗体(1:800)和兔抗人β-actin多克隆抗体(1:1 000),4 ℃孵育过夜;洗膜3次后,加入辣根过氧化物酶标记的山羊抗兔IgG二抗(1:3 000),洗膜3次,用化学发光液(ECL)检测底物的表达,凝胶成像分析系统进行拍照,用Gel-Pro Analyzer-4软件计算各条带的灰度值,最终结果用其与内参比值表示HEK细胞Nrf2核蛋白的相对翻译水平。每个组均设3个样品,对每个样品进行1次测定。
1.3 统计学分析

2 结果
2.1 镉对HEK细胞内氧化应激的影响
2.1.1 SOD活性 各染毒剂量组作用于HEK细胞24和72 h以及2.5和20 μmol/L剂量组作用48 h,细胞内SOD活性显著低于同时间点对照组(均P<0.05);与同组24 h时间点比较,SOD活性在0和2.5 μmol/L分别作用48 h和72 h以及10和20 μmol/L作用72 h,差异均有统计学意义(均P<0.05)。其中,20 μmol/L作用72 h,SOD活性变化最为显著。结果见表1。
2.1.2 GSH-Px活性 各剂量组作用24、48和72 h,GSH-Px活性显著低于同时间点对照组(均P<0.05);0、2.5和5 μmol/L作用48和72 h,GSH-Px活性显著低于同组24 h时间点(均P<0.05)。结果见表2。
2.1.3 MDA含量 10和20 μmol/L剂量组作用24 h与72 h以及各染毒剂量组作用48 h,MDA含量明显高于同时间点对照组(均P<0.05);10和20 μmol/L作用48 h和72 h,MDA含量显著高于同组24 h时间点(均P<0.05)。结果见表3。

表1 氯化镉对HEK细胞内SOD活性的影响
与同时间点0 μmol/L组比较,aP<0.05;与同时间点2.5 μmol/L组比较,bP<0.05;与同时间点5 μmol/L组比较,cP<0.05;与同时间点10 μmol/L组比较,dP<0.05;与同组24 h时间点比较,eP<0.05;与同组48 h时间点比较,fP<0.05

表2 氯化镉对HEK细胞内GSH-Px活性的影响
与同时间点0 μmol/L组比较,aP<0.05;与同时间点2.5 μmol/L组比较,bP<0.05;与同时间点5 μmol/L组比较,cP<0.05;与同时间点10 μmol/L组比较,dP<0.05;与同组24 h时间点比较,eP<0.05

表3 氯化镉对HEK细胞内MDA含量的影响
与同时间点0 μmol/L组比较,aP<0.05;与同时间点2.5 μmol/L组比较,bP<0.05;与同时间点5 μmol/L组比较,cP<0.05;与同时间点10 μmol/L组比较,dP<0.05;与同组24 h时间点比较,eP<0.05
2.2 镉对HEK细胞Nrf2 mRNA相对表达水平的影响
与同时间点对照组比较,在10和20 μmol/L剂量3个时间点上,Nrf2 mRNA相对表达水平显著升高(均P<0.05);与同组24 h时间点比较,在5~20 μmol/L剂量48 h和72 h上,Nrf2 mRNA相对表达水平均有显著差异(均P<0.05)。结果见表4。
2.3 镉对HEK细胞Nrf2核蛋白相对翻译水平的影响
在20 μmol/L剂量3个时间点上,HEK细胞Nrf2核蛋白相对翻译水平显著高于同时间点对照组(均P<0.05);在0~20 μmol/L剂量48 h和72 h上,Nrf2核蛋白相对翻译水平显著高于同时间点对照组(均P<0.05)。结果见表5和图1。

表4 氯化镉对HEK细胞Nrf2 mRNA相对表达水平的影响
与同时间点0 μmol/L组比较,aP<0.05;与同时间点2.5 μmol/L组比较,bP<0.05;与同时间点5 μmol/L组比较,cP<0.05;与同时间点10 μmol/L组比较,dP<0.05;与同组24 h时间点比较,eP<0.05
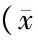
表5 氯化镉对HEK细胞Nrf2核蛋白相对翻译水平的影响±s)
与同时间点0 μmol/L组比较,aP<0.05;与同时间点2.5 μmol/L组比较,bP<0.05;与同组24 h时间点比较,eP<0.05
2.4 HEK细胞Nrf2核蛋白相对翻译水平与氧化应激的相关性分析
2.4.1 Nrf2核蛋白相对翻译水平与SOD活性的相关性 在氯化镉浓度为2.5 μmol/L下作用于HEK细胞24 h时、在氯化镉浓度为5 μmol/L下作用于HEK细胞48 h时以及在氯化镉浓度为2.5和5 μmol/L下分别作用于HEK细胞72 h时,Nrf2核蛋白相对翻译水平与SOD活性均呈正相关关系,差异均有统计学意义(相关系数r分别为0.999、0.998、0.998、0.997,P值分别为0.028、0.040、0.018、0.045)。
2.4.2 Nrf2核蛋白相对翻译水平与GSH-Px活性的相关性 在氯化镉浓度为20 μmol/L下作用于HEK细胞72 h时,Nrf2核蛋白相对翻译水平与GSH-Px活性呈正相关关系,差异有统计学意义(相关系数r为0.999,P=0.024)。
2.4.3 Nrf2核蛋白相对翻译水平与MDA含量的相关性 在氯化镉浓度为20 μmol/L下作用于HEK细胞72 h时,Nrf2核蛋白相对表达水平与MDA含量呈正相关关系,差异有统计学意义(相关系数r为0.998,P=0.029)。

图1 Western blot检测氯化镉对HEK细胞Nrf2核蛋白相对翻译水平的影响Fig.1 Effects of cadmium chloride on the relative translation levels of Nrf2 nuclear protein in HEK cells
3 讨论
长期职业性接触镉主要引起以肾脏损害为主要临床表现的慢性镉中毒[7-8],而镉所致肾脏的毒性与其引起的活性氧生成有关[9]。然而迄今为止,镉所致氧化损伤的毒性及其作用机制依然不明确,慢性镉中毒的临床治疗尚缺乏有效的方法[10]。因此,明确镉毒性机制及寻找行之有效的治疗方法显得非常必要而且迫切。在本实验进行的镉致HEK细胞氧化应激作用中,发现在20 μmol/L下作用48 h,SOD活性和GSH-Px活性显著降低(均P<0.05),而作用至72 h,GSH-Px活性则有所升高;10和20 μmol/L作用72 h,MDA含量均显著高于同时间点对照组和同组24 h时间点(均P<0.05)。我们也观察了镉对Nrf2表达的影响,提示在20 μmol/L作用48 h和72 h,Nrf2 mRNA和核蛋白相对表达水平均有显著变化(均P<0.05)。此外,本研究还对HEK细胞Nrf2核蛋白相对翻译水平与氧化应激之间进行了相关分析,结果显示在浓度为20 μmol/L下作用于HEK细胞72 h时,细胞内GSH-Px活性、MDA含量均与Nrf2核蛋白相对翻译水平呈正相关关系(均P<0.05)。
机体内产生过多的活性氧能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,形成脂质过氧化物,如丙二醛(MDA),因此检测MDA的含量可间接地反映细胞氧化损伤的程度。同时,机体还存在抗氧化酶,如SOD与GSH-Px,它们可以有效清除超氧化阴离子,从而抵抗氧化应激。据报道,镉不但可通过与酶类巯基结合或替代,置换出肾细胞内酶类中的金属元素,降低机体抗氧化酶的活性,还能通过脂质过氧化物分解产物,引起细胞氧化损伤[11-12]。本研究结果也显示在20 μmol/L作用48 h,镉可同时显著抑制HEK细胞内抗氧化酶SOD活性与GSH-Px活性,至染毒72 h,GSH-Px活性则有所上升,MDA含量明显升高。
在镉所致细胞氧化应激的过程中,活性氧可启动细胞内源性抗氧化系统来改善氧化损伤,使细胞处于氧化/抗氧化的动态平衡[13]。其中,Nrf2是细胞内调节抗氧化应激反应的重要转录因子[14]。在动物及体外实验中,发现Nrf2的上调是细胞内拮抗镉毒性的适应性反应[13,15]。反映染镉后Nrf2相对表达水平的Real-time PCR和Western blot结果提示,在一定染毒条件下,氯化镉可同时导致HEK细胞Nrf2基因与蛋白表达的上调,Nrf2蛋白相对翻译水平的上调很可能是由于基因表达的升高。
Nrf2信号因子可通过调节抗氧化转录元件(Antioxidant response element,ARE)驱动多种抗氧化酶的表达,目前被认为是调控多种抗氧化酶转录表达的关键内源性通路[16]。多项研究表明,与氧化应激关系密切的Nrf2可被镉激活,促进多种抗氧化酶的表达,清除ROS,从而实现抗氧化的保护作用[17-18]。结合本研究结果,推测在染毒中期(48 h),20 μmol/L剂量镉可同时抑制抗氧化酶SOD活性与GSH-Px活性,使MDA含量升高;染毒至晚期(72 h),GSH-Px活性则有所上升,这可能与晚期Nrf2被激活使该酶活性上调有关,但MDA含量继续升高,此时氧化应激还是起主导作用。
综上所述,镉不仅抑制了抗氧化酶SOD与GSH-Px活性,还诱导了脂质过氧化物MDA含量升高,两者的共同结果均可导致HEK细胞氧化损伤的增强,但与此同时可能通过触发HEK细胞内Nrf2信号因子的适应性反应,促进抗氧化酶转录表达,从而缓解氧化损伤。本研究初步揭示了Nrf2信号因子在镉引起HEK细胞氧化应激时的作用,进一步的研究拟采用Nrf2信号因子的激动剂和抑制剂,从正反两方面深入揭示Nrf2信号因子在镉致氧化损伤中的调控作用及其机制。
[1] Matovic V,Buha A,Dukic-Cosic D,et al.Insight into the oxidative stress induced by lead and/or cadmium in blood,liver and kidneys[J].Food Chem Toxicol,2015,78:130-140.
[2] Nair A R,Lee W K,Smeets K,et al.Glutathione and mitochondria determine acute defense responses and adaptive processes in cadmium-induced oxidative stress and toxicity of the kidney[J].Arch Toxicol,2015,89(12):2273-2289.
[3] 钟苑芳,贺凌飞,余日安.转录因子NF-E2相关因子2抗氧化转录元件信号通路组成与激活机制[J].中国职业医学,2010,37(5):416-419.
[4] Nazima B,Manoharan V,Miltonprabu S.Cadmium induced cardiac oxidative stress in rats and its attenuation by GSP through the activation of Nrf2 signaling pathway[J].Chem Biol Interact,2015,242:179-193.
[5] Wilmes A,Crean D,Aydin S,et al.Identification and dissection of the Nrf2 mediated oxidative stress pathway in human renal proximal tubule toxicity[J].Toxicol in Vitro,2011,25(3):613-622.
[6] 杨树升,林丽,邱明义,等.大承气汤对脑出血模型大鼠mNSS评分及Nrf2信号通路的影响[J].华中科技大学学报:医学版,2016,45(2):164-169.
[7] 金泰廙,王生,邬堂春,等.现代职业卫生与职业医学[M].北京:人民卫生出版社,2011:515-518.
[8] 夏丽华,程樱,刘莉莉,等.职业性慢性镉中毒临床诊断治疗研究进展[J].中国职业医学,2016,43(1):97-100.
[9] 李静慧,徐兆发.镉致肾细胞凋亡机制的研究进展及防治[J].毒理学杂志,2014,28(4):319-322.
[10] Luevano J,Damodaran C.A review of molecular events of cadmium-induced carcinogenesis[J].J Environ Pathol Toxicol Oncol,2014,33(3):183-194.
[11] Rani A,Kumar A,LaI A,et al.Cellular mechanisms of cadmium-induced toxicity:a review[J].Int J Environ Health Res,2014,24(4):378-399.
[12] Souid G,Souayed N,Yaktiti F,et al.Effect of acute cadmium exposure on metal accumulation and oxidative stress biomarkers of Sparus aurata[J].Ecotoxicol Environ Saf,2013,89:1-7.
[13] Montes S,Juarez-Rebollar D,Nava-Ruiz C,et al.Immunohistochemical study of Nrf2-antioxidant response element as indicator of oxidative stress induced by cadmium in developing rats[J].Oxid Med Cell Longev,2015:570650.
[14] Shinkai Y,Kimura T,Itagaki A,et al.Partial contribution of the Keap1-Nrf2 system to cadmium-mediated metallothionein expression in vascular endothelial cells[J].Toxicol Appl Pharmacol,2016,295:37-46.
[15] Chen J,Shaikh Z A.Activation of Nrf2 by cadmium and its role in protection against cadmium-induced apoptosis in rat kidney cells[J].Toxicol Appl Pharmacol,2009,241(1):81-89.
[16] Wu K C,Liu J J,Klaassen C D.Nrf2 activation prevents cadmium-induced acute liver injury[J].Toxicol Appl Pharmacol,2012,263(1):14-20.
[17] Ogasawara Y,Takeda Y,Takayama H,et al.Signicance of the rapid increase in GSH levels in the protective response to cadmium exposure through phosphorylated Nrf2 signaling in Jurkat T-cells[J].Free Radic Biol Med,2014,69(3):58-66.
[18] Son Y O,PratheeshKumar P,Roy R V,et al.Nrf2/p62 signaling in apoptosis resistance and its role in cadmium-induced carcinogenesis[J].J Biol Chem,2014,289(41):28660-28675.
(2016-08-30 收稿)
Role of the Nrf2 Signaling in the Oxidative Damage Inducedby Cadmium in HEK Cells
Chen Jiaxing1,Chen Zhijian1,Wu Likang2etal
1SchoolofPublicHealth,GuangdongPharmaceuticalUniversity,Guangzhou510310,China2Bao’anCenterforDiseaseControlandPreventionofShenzhen,Shenzhen518101,China
Objective To explore the effects of nuclear factor E2-related factor 2(Nrf2)on the oxidative stress induced by cadmium chloride(CdCl2)in human embryonic kidney epithelial(HEK)cells.Methods HEK cells in the exponential phase were incubated with a final concentration of 0,2.5,5,10,or 20 μmol/L CdCl2for 24,48 or 72 hoursinvitro.After cells were harvested,the relative expression level of Nrf2 mRNA was detected by real-time polymerase chain reaction(real-time PCR),and Western blotting was applied to measure the relative translation level of Nrf2 nuclear protein.Results The SOD activity and GSH-Px activity were significantly decreased in HEK cells after 48 h exposure to 20 μmol/L CdCl2(P<0.05),and the GSH-Px activity tended to increase at 72 h.The MDA content was significantly higher after 72 h exposure to 10 or 20 μmol/L CdCl2than in the control group at same time point and in 24 h CdCl2treatment group(P<0.05).There was a significant change in the relative expression level of Nrf2 mRNA at 10 or 20 μmol/L CdCl2for 48 or 72 h(P<0.05).The relative translocation level of Nrf2 nuclear protein was significantly increased in HEK cells treated with 20 μmol/L CdCl2for 48 or 72 h(P<0.05).After 72 h exposure to 20 μmol/L CdCl2,a positive correlation was found between the GSH-Px activity or MDA content and the relative translation level of Nrf2 nuclear protein in HEK cells(P<0.05).Conclusion Cadmium can inhibit the oxidative stress damage by inducing the activation of Nrf2 signaling factor while causing oxidative stress in HEK cells.The mechanism may involve the promotion of the expression of antioxidant enzymes.
cadmium chloride; human embryonic kidney epithelial cells; oxidative stress; Nrf2
*深圳市科技创新项目(No.JCYJ20140414154847275)
R146
10.3870/j.issn.1672-0741.2017.02.006
陈嘉兴,男,1989年生,硕士研究生,E-mail:353787695@qq.com
△通讯作者,Corresponding author,E-mail:yuriantj@163.com

