新型化合物1通过PI3K/AKT/mTOR信号通路抑制三阴性乳腺癌MDA-MB-231细胞的存活*
邹雪玲, 汪鋆植, 邹 坤, 贺海波, 黄文峰△
1三峡大学医学院,天然产物研究与利用湖北省重点实验室,宜昌 4430022三峡大学生物与制药学院,天然产物研究与利用湖北省重点实验室,宜昌 443002
新型化合物1通过PI3K/AKT/mTOR信号通路抑制三阴性乳腺癌MDA-MB-231细胞的存活*
邹雪玲1, 汪鋆植2, 邹 坤2, 贺海波2, 黄文峰1△
1三峡大学医学院,天然产物研究与利用湖北省重点实验室,宜昌 4430022三峡大学生物与制药学院,天然产物研究与利用湖北省重点实验室,宜昌 443002
目的 探讨从草酸青霉菌的次级代谢产物分离出来的化合物1抑制三阴性乳腺癌细胞MDA-MB-231存活的相关机制。方法 MTT法检测化合物1对MDA-MB-231细胞和正常大鼠心肌细胞H9C2存活率的影响。通过流式细胞术和Western blot检测细胞周期分布,通过Western blot方法进一步研究化合物1对PI3K/AKT/mTOR信号通路的影响。结果 化合物1呈时间和浓度依赖的方式抑制MDA-MB-231细胞的存活率。化合物1可使MDA-MB-231细胞p53、CyclinB1、CyclinD1蛋白表达减少,p21蛋白增加,并阻滞乳腺癌细胞在G2/M期。进一步发现化合物1不仅能够抑制MDA-MB-231细胞中被血清激活的PI3K/AKT/mTOR信号通路,还能作用于PTEN缺失的小鼠胚胎成纤维细胞(MEF),抑制其过度活化的mTOR通路。结论 化合物1选择性抑制MDA-MB-231细胞存活的机制可能与它能够抑制异常活化的PI3K/AKT/mTOR信号通路有关。化合物1可望成为一种潜在的治疗AKT/mTOR信号通路异常活化肿瘤的天然化合物。
PI3K/Akt/mTOR信号通路; 过度活化的mTOR通路; 细胞周期阻滞
乳腺癌是影响人类生活和生存的一种常见的恶性肿瘤。乳腺癌根据是否表达雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)而分为不同的亚群。以上三种受体均不表达的亚型称为三阴性乳腺癌(TNBC)。三阴性乳腺癌在所有的乳腺癌病例中所占比例约为30%,具有高转移潜能[1],特别易侵袭重要器官如脑、肺。
AKT/mTOR通路在癌症治疗的临床实验中是一个十分吸引人的治疗靶点[2]。在正常细胞中,PI3K/AKT/mTOR信号通路的激活参与细胞的增殖、存活和迁移[3]。最近的研究表明,许多原癌基因参与的信号通路中,mTOR是一个承上启下的关键节点,它可整合上游的生长因子、营养和细胞能量状态的信号,从而调控细胞蛋白合成能力。该信号通路的异常激活能够促进细胞的持续增长,和癌症进展密切相关,在许多实体肿瘤中发现mTOR信号通路的过度激活[4]。与其他亚型的乳腺癌相比,在三阴性乳腺癌中频繁发现mTOR信号通路的过度激活,该通路的异常与其预后不良密切相关[5-7]。前期研究发现mTOR抑制剂具有显著的抗癌活性[8]。PI3K/AKT/mTOR信号通路的抑制剂雷帕霉素与紫杉醇联合治疗三阴性乳腺癌被证明具有更好的疗效[9]。
本实验室从草酸青霉菌的次级代谢产物中分离并人工合成了一个结构新颖的噻唑化合物,即本研究的对象——化合物1为4-[2-(4-羟基苯甲基)-噻唑-4基]苯酚[10]。五元杂环类的噻唑结构广泛存在于许多天然产物中,它的生物活性也包括细胞毒作用[11]。MDA-MB-231细胞是具有高侵袭性的三阴乳腺癌细胞,本研究旨在发现化合物1是否能够选择性抑制MDA-MB-231细胞的存活,并进一步解析化合物1对MDA-MB-231细胞细胞周期以及肿瘤相关信号通路PI3K/AKT/mTOR的影响。
1 材料与方法
1.1 实验试剂及材料
DMEM、L-15、1640粉末培养基购自美国Gibco公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、二甲基亚砜(DMSO)、三羟甲基氨基甲烷(Tris)、十二烷基磺酸钠(SDS)、甘氨酸购自美国Sigma公司;无水甲醇、无水乙醇购自国药集团;青霉素、链霉素购自华北制药股份有限公司;新生胎牛血清和进口新生胎牛血清购自杭州四季青生物工程材料有限公司;BCA法蛋白定量试剂盒、SDS-PAGE凝胶配制试剂盒购自碧云天公司;RIPA全蛋白裂解缓冲液、磷酸酶抑制剂、蛋白酶抑制剂、ECL化学发光检测试剂盒购自北京普利莱(APPLYGEN)基因技术有限公司;PVDF膜购自谷歌生物公司;细胞DNA含量检测(细胞周期)试剂盒购自凯基生物技术有限公司;兔抗p-AKT(ser473)、p-mTOR(S2448)、p-P70S6 Kinase(T389)、CyclinB1、CyclinD1、p21、beta-actin以及鼠抗p53购自美国Cell Signaling公司;辣根过氧化氢酶标记的山羊抗兔IgG、辣根过氧化氢酶标记山羊抗小鼠IgG购自爱必信生物科技有限公司。
1.2 细胞培养
乳腺癌细胞MDA-MB-231、大鼠心肌细胞H9C2,购自中科院上海细胞库;小鼠胚胎成纤维细胞MEF,包括PTEN-/-MEF和野生型MEF,由中国医学科学院张宏冰教授惠赠,可稳定传代。乳腺癌MDA-MB-231细胞在添加了10%的胎牛血清和100 U的青/链霉素的L-15培养液中培养。MEF细胞在添加了2 g碳酸氢钠和10%胎牛血清以及100 U青/链霉素的DMEM培养液中培养。大鼠心肌细胞H9C2在添加了10%进口胎牛血清的1640培养液中培养。细胞均在为5% CO2、相对湿度为100%的37℃的培养箱中培养。
1.3 细胞生存实验(MTT法)
MDA-MB-231细胞以4×104个/孔种于96孔板中,待其贴壁后加不同浓度的化合物1后继续培养24、48、72 h。H9C2细胞以4×105个/孔种于96孔板,待其贴壁后加入不同浓度的化合物1继续培养48 h。每孔加入20 μL的MTT,继续放置细胞培养箱培养4 h。检测前,贴壁小心吸弃孔中的液体,并加入150 μL二甲基亚砜。将96孔板放在水平振荡摇床上低速摇晃直至壁上的结晶完全溶解。用酶标仪检测上清在490 nm波长的吸光度值,并设置溶剂对照(培养液,MTT,二甲基亚砜),将溶剂对照组的吸光度值作为100%。每组设置4~5个复孔,用Excel绘制细胞增殖曲线图。
1.4 流式细胞术分析细胞周期
将加药后的细胞用0.25%胰酶(无EDTA)消化成单个细胞悬液,离心收集细胞。弃上清,用预冷PBS洗细胞2次,调整细胞浓度在1×106个/mL,取1 mL转移至1.5 mL EP管离心后,吸弃PBS并加入1 mL预冷(-20℃)70%乙醇到细胞沉淀中,于4℃固定过夜。次日离心去除固定液,用PBS洗细胞2次,加入100 μL RNAase(100 μg/mL),置于37℃水浴锅中加热30 min。直接加入400 μL含50 μg/mL溴化乙啶(PI)的PBS,室温条件下避光孵育30 min。上机前用200目筛网过滤掉粘连的细胞团块,上流式细胞仪检测细胞周期分布。
1.5 免疫印迹法(Western blot)
细胞以每孔4×106个种于6孔板中,细胞生长密度达到70%时,换无血清培养液培养20 h,加药作用前用30 %胎牛血清刺激细胞20 min,预冷的PBS洗2次并将细胞收集到1.5 mL的EP管,在孔内加入含有蛋白酶抑制剂和磷酸酶抑制剂的裂解液。冰上裂解细胞,收集上清进行蛋白定量后,加蛋白上样缓冲液煮沸5 min,-80℃保存。在100 V条件下电泳2.5 h;200 mA恒流条件下PVDF膜转膜1 h;5%脱脂牛奶封闭2 h,孵一抗,4℃过夜;用含0.05% Tween 20的TBST缓冲液摇床上洗5 min ×3次,再与辣根过氧化物酶标记的二抗稀释液室温下孵育1 h,用TBST洗5次×5 min,暗室内显影。扫描图像,测得各条带的灰度值,以β-actin为内参照标准化后,比较目的蛋白表达量的变化。
1.6 统计学方法
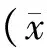
2 结果
2.1 化合物1对细胞存活率的影响
图1所示是本研究中化合物1的结构。MTT法检测化合物1作用24、48、72 h后对乳腺癌细胞MDA-MB-231存活率的影响。为了评价化合物1对正常细胞是否具有细胞毒性,本研究检测了化合物1对正常大鼠心肌细胞H9C2存活率的影响。如图2所示,当化合物浓度为1、2、4、6、8 μg/mL时,仅在作用48 h对该细胞有弱毒性。而如图3所示,化合物1呈时间和剂量依赖性减少MDA-MB-231细胞的存活率。24 h的IC50值为4.90 μg/mL,48 h的IC50值为3.33 μg/mL,72 h的IC50值为1.97 μg/mL。在本实验中同时检测了对乳腺癌具有治疗作用的盐酸阿霉素对MDA-MB-231细胞48 h的存活率影响,其IC50值为2.06 μg/mL,提示化合物1对MDA-MB-231细胞的作用接近盐酸阿霉素。但是由于盐酸阿霉素对心肌组织的毒性大因而使其抗肿瘤活性的应用受到一定的限制[12],而化合物1对正常的大鼠心肌细胞毒性弱,因此化合物1在抗肿瘤治疗上具有潜在的优势。

图1 化合物1的化学结构Fig.1 Chemical structure of Compound 1
2.2 化合物1对细胞周期的影响
用6、8 μg/mL浓度的化合物1作用MDA-MB-231细胞24 h,流式细胞术分析细胞周期各时期的细胞比例。结果示加药后G2/M期的细胞比例逐渐增多(图4),提示化合物1能够将细胞周期阻滞在G2/M期。p53在正常细胞中是抑癌基因,但是在很多肿瘤中发现有p53基因的突变。之前有研究报道MDA-MB-231细胞中p53是突变型[13],Western blot结果显示8、10 μg/mL化合物1作用24 h后MDA-MB-231细胞中p53蛋白水平明显下降;Cyclin B1是细胞周期的G2/M期的关键蛋白之一[14],在化合物1作用MDA-MB-231细胞24 h后Cyclin B1的蛋白表达水平显著下调;被公认为是由原癌基因编码的产物Cyclin D1的蛋白表达也被下调,而细胞周期素依赖性激酶抑制蛋白p21表达被化合物1上调(图5)。
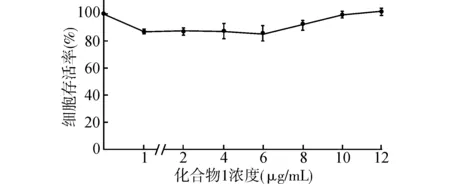
图2 化合物1作用48 h对正常大鼠心肌细胞H9C2细胞存活率影响Fig.2 Effect of Compound 1 on the viability of normal rat myocardial cells H9C2 at 48 hour

图3 化合物1对MDA-MB-231细胞存活率的影响Fig.3 Effect of Compound 1 on the viability of MDA-MB-231 cells
2.3 化合物1对MDA-MB-231细胞中PI3K/AKT/mTOR信号通路的影响
为了找到化合物1对蛋白激酶磷酸化最佳作用时间,将在含有10%的血清培养液中培养的细胞替换为无血清的培养液继续培养20 h,再用含或不含30 %的胎牛血清(fetal calf serum,FBS)作用细胞20 min,因为血清中的一些生长因子能够激活PI3K/AKT信号通路。再以10 μg/mL的化合物1作用不同时间(5、10、20、30 min),发现在药物作用5 min后,与用血清刺激后不加化合物组相比,AKT和mTORC1下游激酶P70S6K的磷酸化水平明显被抑制(图6)。细胞用无血清培养液饥饿后再加30%胎牛血清刺激20 min,与不用血清刺激的对照组相比,AKT及P70S6K的磷酸化水平显著升高,说明在血清刺激20 min后该通路仍然是激活的状态。以10 μg/mL和20 μg/mL化合物1分别作用MDA-MB-231细胞5 min,Western blot方法分析AKT、mTOR以及P70S6K的磷酸化水平的改变。发现AKT、mTOR的磷酸化水平在10 μg/mL浓度的化合物1作用下就已开始下调,在20 μg/mL的浓度作用下,AKT,mTOR以及P70S6K三者的磷酸化水平显著下降(图7)。上述研究表明,化合物1能够抑制MDA-MB-231细胞中被血清激活的AKT/mTOR/P70S6K信号通路。

图4 流式细胞仪分析化合物1对MDA-MB-231细胞周期分布的影响Fig.4 Flow cytometer analyses of the influence of compound 1 on the distribution of cycle phases in MDA-MB-231 cells

图5 化合物1对MDA-MB-231细胞中周期相关蛋白表达的影响Fig.5 Effect of Compound 1 on the expression of the cell cycle-related proteins in MDA-MB-231 cells
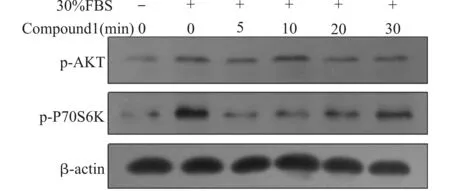
图6 化合物1作用MDA-MB-231细胞不同时间对AKT,P70S6K磷酸化水平的抑制Fig.6 Inhibitory effects of Compound 1 on the phosphorylation levels of AKT and P70S6K in MDA-MB-231 cells at different time

图7 化合物1对MDA-MB-231细胞中PI3K/AKT/mTOR信号通路的影响Fig.7 Effect of Compound 1 on the PI3K/AKT/mTOR signal pathway in MDA-MB-231 cells
2.4 化合物1对MEF细胞中异常激活的PI3K/AKT/mTOR信号通路的影响
为了弄清化合物1影响PI3K/AKT/mTOR信号通路的分子分布范围,本研究以PTEN野生型(WT)和缺失型的细胞为研究对象,化合物1作用PTEN-/-MEF和PTEN野生型MEF后,检测2种细胞中PI3K/AKT/mTOR信号通路的关键蛋白。图8显示,在PTEN-/-MEF细胞中化合物1对AKT的活性有轻微的下调,并能显著降低mTOR和它的下游靶蛋白P70S6K磷酸化的水平;但是在PTEN野生型MEF细胞中化合物1只能下调P70S6K蛋白磷酸化水平,对上游的AKT、mTOR的活性几乎没有影响。上述结果表明,化合物1作用的靶点可能在抑癌基因PTEN下游,或者作用机制是抑癌基因PTEN非依赖性;而且化合物1作用于PTEN基因缺失型肿瘤可能意义更大。

**P<0.01图8 PTEN野生型MEF细胞和PTEN-/- MEF细胞中PI3K/AKT/mTOR通路的影响Fig.8 Effect of Compound 1 on the expression of the PI3K/AKT/mTOR pathway in PTEN wild type MEF cells and PTEN-/-MEF cells
3 讨论
PI3K/AKT/mTOR通路能够调节多种细胞功能,如细胞增殖、细胞代谢、血管生成、细胞周期、细胞凋亡和自噬等[15-16]。该通路中激活的AKT能够通过磷酸化GSK3β抑制它的活性,使Cyclin D1,Cyclin E不能被GSK3β降解[17],从而调控细胞周期进程。AKT还可通过磷酸化下游叉头蛋白FOXO来降低作为周期素依赖性蛋白激酶抑制因子(CDKI)的p21和p27的转录水平以控制细胞周期的进程[18]。另外mTORC1下游活化的P70S6K蛋白可以促进与细胞周期相关的蛋白合成和转录。本研究结果显示化合物1能够下调MDA-MB-231细胞p53表达,而早期研究表明此细胞中的p53为突变型[13],这可能对化合物1抑制MDA-MB-231细胞存活机制的探讨具有重要意义。化合物1不仅能够下调Cyclin D1蛋白还能够下调与G2/M期的限制点调控相关的细胞周期蛋白Cyclin B1[14]。另外流式细胞术分析也显示随着药物剂量的增加,分布在G2/M期的细胞群数量逐渐增多,表明化合物1可以阻滞MDA-MB-231细胞在细胞周期G2/M期。
PI3K/AKT/mTOR信号途径的失衡可以诱导多种疾病,促进肿瘤的发展和影响肿瘤的预后[19]。该信号途径的异常激活,主要归因于上游酪氨酸受体和某些负调控因子如PTEN、TSC、p53功能丧失或表达下降,此外还可由致癌基因相关的PI3K、AKT基因的突变所致[20]。抑癌基因PTEN是该信号通路的另一个重要的负调控因子,主要通过抑制AKT活性来抑制下游的mTOR。PTEN缺失或突变可以导致在许多肿瘤中mTOR异常激活[21]。而过度活化的mTOR可以通过激活下游P70S6K来合成促进肿瘤生长和血管生成的相关蛋白[22],从而促进肿瘤的发生和转移。前期的研究证明在TSC2-/-MEF细胞和PTEN-/-MEF细胞mTOR磷酸化水平异常升高[23],因为作为该通路上游的抑癌基因TSC2或PTEN的缺失使得这2种细胞有一定的恶性表型。在本次研究中,为了探讨PI3K/AKT/mTOR信号通路是否参与化合物1对肿瘤细胞存活率的影响,将细胞在无血清培养液中培养20 h,给药前用30%浓度的血清刺激激活PI3K/AKT/mTOR通路,发现MDA-MB-231细胞中被血清激活的PI3K/AKT/mTOR信号可以在化合物1作用数分钟后被下调,即AKT、mTOR和P70S6K的蛋白磷酸化水平均明显下降。由此说明化合物1可以通过抑制PI3K/AKT/mTOR信号通路抑制细胞周期的进程。另外化合物1可以抑制PTEN-/-MEF细胞中AKT、mTOR和P70S6K蛋白的磷酸化水平,而在PTEN野生型MEF细胞中化合物1只能下调P70S6K磷酸化水平却对上游的AKT、mTOR的活性没有影响。PI3K/AKT/mTOR通路和Ras/MEK/ERK通路都能促进细胞增殖,有早期研究介绍了P70S6K活化可以通过PI3K依赖或非依赖式的途径[24],我们猜想化合物1可能是抑制了PTEN野生型MEF细胞中MEK/ERK通路从而抑制了P70S6K的活性。综上所述,化合物1可以通过下调MDA-MB-231细胞中异常激活的PI3K/AKT/mTOR信号通路使细胞周期阻滞在G2/M期。由这种新型的化合物可能对mTOR信号通路过度活化的肿瘤如PTEN缺失型的恶性肿瘤细胞有更好的抗肿瘤效应。
[1] Abramson V G,Mayer I A.Molecular heterogeneity of triple negative breast cancer[J].Curr Breast Cancer Rep,2014,6(3):154-158.
[2] Bartholomeusz C,Gonzalez-Angulo A M.Targeting the PI3K signaling pathway in cancer therapy[J].Expert Opin Ther Targets,2012,16(1):121-130.
[3] Brazil D P,Park J,Hemmings B A.PKB binding proteins.Getting in on the Akt[J].Cell,2002,111(3):293-303.
[4] Dann S G,Selvaraj A,Thomas G.mTOR Complex1-S6K1 signaling:at the crossroads of obesity,diabetes and cancer[J].Trends Mol Med,2007,13(6):252-259.
[5] Ueng S H,Chen S C,Chang Y S,et al.Phosphorylated mTOR expression correlates with poor outcome in early-stage triple negative breast carcinomas[J].Int J Clin Exp Pathol,2012,5(8):806-813.
[6] Walsh S,Flanagan L,Quinn C,et al.mTOR in breast cancer:differential expression in triple-negative and non-triple-negative tumors[J].Breast,2012,21(2):178-182.
[7] Pelicano H,Zhang W,Liu J,et al.Mitochondrial dysfunction in some triple-negative breast cancer cell lines:role of mTOR pathway and therapeutic potential[J].Breast Cancer Res,2014,16(5):434.
[8] Yunokawa M,Koizumi F,Kitamura Y,et al.Efficacy of eve-rolimus,a novel mTOR inhibitor,against basal-like triple-negative breast cancer cells[J].Cancer Sci,2012,103(9):1665-1671.
[9] Tomao F,Papa A,Zaccarelli E,et al.Triple-negative breast c-ancer:new perspectives for targeted therapies[J].Onco Targets Ther,2015,8:177-193.
[10] Yang Z,Huang N,Xu B,et al.Cytotoxic 1,3-thiazole and 1,2,4-thiadiazole alkaloids from penicillium oxalicum:structural elucidation and total synthesis[J].Molecules,2016,21(3):232.
[11] Colon A,Hoffman T J,Gebauer J,et al.Catalysis-based enantioselective total synthesis of myxothiazole Z,(14S)-melithiazole G and(14S)-cystothiazole F[J].Chem Commun(Camb),2012,48(85):10508-10510.
[12] Singal P K,Iliskovic N.Doxorubicin-induced cardiomyopathy[J].N Engl J Med,1998,339(13):900-905.
[13] Shrivastava S,Kulkarni P,Thummuri D,et al.Piperlongumine,an alkaloid causes inhibition of PI3K/Akt/mTOR signaling axis to induce caspase-dependent apoptosis in human triple-negative breast cancer cells[J].Apoptosis,2014,19(7):1148-1164.
[14] Gao S Y,Li J,Qu X Y,et al.Downregulation of Cdk1 and cyclinB1 expression contributes to oridonin-induced cell cycle arrest at G2/M phase and growth inhibition in SGC-7901 gastric cancer cells[J].Asian Pac J Cancer Prev,2014,15(15):6437-6441.
[15] Zoncu R,Efeyan A,Sabatini D M.mTOR:from growth signal integration to cancer,diabetes and ageing[J].Nat Rev Mol Cell Biol,2011,12(1):21-35.
[16] Hara K,Maruki Y,Long X,et al,Raptor,a binding partner of target of rapamycin(TOR),mediates TOR action[J].Cell,2002,110(2):177-189.
[17] Sherr C J,Roberts J M.Living with or without cyclins and cyclin-dependent kinases[J].Genes Dev,2004,18(22):2699-2711.
[18] Roy S K,Srivastava R K,Shankar S.Inhibition of PI3K/AKT and MAPK/ERK pathways causes activation of FOXO transcription factor,leading to cell cycle arrest and apoptosis in pancreatic cancer[J].J Mol Signal,2010,5:10.
[19] Gulhati P.Targeted inhibition of mammalian target of rapamycin signaling inhibits tumorigenesis of colorectal cancer[J].Clin Cancer Res,2009,15(23):7207-7216.
[20] Shaw R J,Cantley L C.Ras,PI(3)K and mTOR signalling controls tumour cell growth[J].Nature,2006,441(7092):424-430.
[21] Kalaitzidis D,Sykes S M,Wang Z,et al.mTOR complex 1 plays critical roles in hematopoiesis and Pten-loss-evoked leukemogenesis[J].Cell Stem Cell,2012,11(3):429-439.
[22] Fenton T R,Gout I T.Functions and regulation of the 70 kDa ribosomal S6 kinases[J].Int J Biochem Cell Biol,2011,43(1):47-59.
[23] Sun Q,Chen X,Ma J,et al.Mammalian target of rapamycin up-regulation of pyruvate kinase isoenzyme type M2 is critical for aerobic glycolysis and tumor growth[J].Proc Natl Acad Sci U S A,2011,108(10):4129-4134.
[24] Chung J,Grammer T C,Lemon K P,et al.PDGF-and insulin-dependent pP70S6K activation mediated by phosphatidylinositol-3-OH kinase[J].Nature,1994,370(6484):71-75.
(2017-01-07 收稿)
Novel Compound 1 Inhibits the Viability of Triple Negative BreastMDA-MB-231 Cells via the PI3K/AKT/mTOR Pathway
Zou Xueling1,Wang Junzhi2,Zou Kun2etal
1MedicalCollege,2CollegeofBiologyandPharmaceutics,HubeiKeyLaboratoryofNaturalProductsResearchandDevelopment,ChinaThreeGorgesUniversity,Yichang443002,China
Objective Compound 1 is a compound with novel structure,which is isolated form secondary metabolites of penicillium oxalicum.This study aimed to examine the mechanisms of Compound 1 inhibiting the viability of three negative breast cancer MDA-MB-231 cells with the PI3K/Akt/mTOR signaling pathway focused on.Methods The cytotoxic effect of Compound 1 on breast cancer cells MDA-MB-231 and normal rat myocardial cells H9C2 were evaluated by MTT assay.The distribution of cell cycle was assessed by flow cytometry and Western blotting.Western blotting was performed to detect the effect of Compound 1 on the PI3K/AKT/mTOR signaling pathway.Results Compound 1 could inhibit the viability of MDA-MB-231 cells in a time-and concentration-dependent fashion.Moreover,Compound 1 was found to lead to a decrease in protein p53,cyclinB1,cyclinD1 and an increase in p21,and it could induce cell arrest in G2/M phase.The further studies revealed that Compound 1 could down-regulate not only the PI3K/AKT/mTOR signaling pathway in MDA-MB-231 cells but also the hyper-activated mTOR pathway in PTEN-/-mouse embryonic fibroblast(MEF)cells.Conclusion The mechanism of Compound 1 selectively inhibiting the viability of MDA-MB-231 cells may involve the down-regulation of PI3K/Akt/mTOR.Compound 1 is expected to become an effective natural compound for the treatment of cancers with the mTOR pathway abnormally activated.
PI3K/Akt/mTOR signaling pathway; hyper-activated mTOR pathway; cell cycle arrest
*国家自然科学基金资助项目(No.31370373,No.21272136);湖北省自然科学基金项目(No.2016CFB444)
R285.5
10.3870/j.issn.1672-0741.2017.02.003
邹雪玲,女,1989年生,硕士研究生,E-mail:582763034@qq.com
△通讯作者,Corresponding author,E-mail:xyyxy1999@aliyun.com

