骨髓间充质干细胞双向诱导分化构建血管化组织工程骨的实验研究
张 蓉,高 瞻,高 伟
(新疆军区总医院颌面外科 新疆 乌鲁木齐 830000)
•论 著•
骨髓间充质干细胞双向诱导分化构建血管化组织工程骨的实验研究
张 蓉,高 瞻,高 伟
(新疆军区总医院颌面外科 新疆 乌鲁木齐 830000)
目的:探讨利用骨髓间充质干细胞(marrow stromal cells,MSCs)的成骨和成血管化特性双向诱导分化,构建血管化组织工程骨的新策略。方法:将体外培养扩增的MSCs,用含成骨诱导剂的培养液连续培养2周, 形成成骨性细胞膜片。同时将另一部分MSCs向成血管化分化,获得血管内皮前体细胞(endothelial progenitor cells,EPCs),并将EPCs悬液接种于膜片,形成膜片-EPCs复合体。然后将膜片-EPCs复合体植入裸鼠体内,同时单纯植入MSCs膜片作为对照组。术后4周和8周取材,通过Micro-CT、组织学和扫描电镜检查,分析其成骨性能。结果:体外构建的细胞膜片为细胞-细胞外基质聚合体,细胞外基质中沉积有钙化结节。培养获得的EPCs能够形成管腔状结构,CD31染色表达阳性;膜片-EPCs复合体植入裸鼠体内4周和8周后,形成密布血管网的组织工程骨,成骨面积和血管密度均明显高于对照组。结论:掺入血管内皮前体细胞不仅有利于产生丰富血管网,而且能够促进新骨形成。
骨组织工程;细胞膜片技术;血管化;间充质干细胞;血管内皮前体细胞
近年来,随着再生医学的快速发展,组织工程技术有望为骨缺损修复提供理想的方法。但由于体外构建的组织工程骨缺乏毛细血管网,造成细胞供养障碍而限制了其临床应用[1]。目前认为,组织工程骨的血管化贯穿于整个移植修复过程,对骨再生和融合的方式及效果具有决定性作用。加速组织工程骨的血管化进程,提高组织工程骨在充分血管化之前的存活能力,是决定使用组织工程骨修复大段骨缺损成败的关键。
尽管使用VEGF、bFGF等生长因子、复合内皮细胞、应用显微外科技术构建微观血管网、使用VEGF、BMP-2等基因修饰均能有效促进组织工程骨血管化,但这些策略或多或少都存在一些问题[1-2]。另一方面,传统的“细胞-支架材料”策略也存在细胞利用率低、附着效率差;细胞在支架材料上分布不均;使用蛋白酶消化收集细胞影响细胞活性,破坏细胞外基质及形成的细胞间连接蛋白;支架材料可能引起炎症反应、存在潜在的免疫原性、不足的生物活性和不完全降解形成纤维组织等等问题[3-4]。因此探索新的组织工程骨构建策略是推动组织工程骨应用于临床需要解决的难题。
骨髓间充质干细胞由于来源丰富、增殖能力强并具备多向分化潜能,已成为骨组织工程研究中重要的种子细胞。它在成骨诱导条件下能够形成成骨性细胞膜片,并可构建出组织工程骨[5-6]。更重要的是,据文献报道骨髓间充质干细胞能够分化为高增殖的血管内皮前体细胞[7-8],促进缺血组织再血管化。因而,我们利用骨髓间充质干细胞的多向分化潜能,采用成骨性细胞膜片和成血管性内皮前体细胞复合物,通过新的策略构建出血管化骨。
1 材料和方法
1.1 实验动物:裸鼠20只,雌雄不限,5~6周龄,体重19~22g,由第四军医大学口腔医院实验动物中心提供,实验动物许可证号SYXK(军)2010-046。
1.2 骨髓间充质干细胞(MSCs)的分离培养和鉴定
1.2.1 MSCs的分离培养:按文献报道的方法分离培养MSCs[9],新西兰兔(2.7~3.0kg)麻醉后切取髂骨,去除附着的软组织后移入无菌平皿,用针管抽吸PBS将骨髓冲出,200目滤纱过滤,1 000r/min离心3min。将沉淀的细胞重悬于10ml含体积分数10%胎牛血清的DMEM-F12培养液中,接种于10cm培养皿;置37℃、体积分数为5%的CO2饱和湿度培养箱中进行培养;72h后换液,去除未贴壁的血细胞,以后每3d换液1次,细胞长满培养皿底部后,用0.25%胰酶传代。
1.2.2 MSCs的鉴定:将培养获得的细胞行成骨、成脂、成软骨多向诱导分化,成骨诱导后行矿化结节茜素红染色;成脂诱导后行脂肪滴的油红O染色;成软骨诱导行软骨细胞的特异性甲苯胺蓝染色鉴定。
1.3 构建细胞膜片和性能检测
1.3.1 构建细胞膜片:MSCs按密度1×106个/cm2接种到直径10cm的培养皿,使用含成骨诱导剂的DMEM/F12培养液(含10%胎牛血清、地塞米松10nM、β-甘油磷酸钠10mM、抗坏血酸 50mg/l),置于37℃、5%CO2培养箱孵育,隔日换培养液1次;连续培养2周,皿底可见半透明乳白色薄膜样物,膜片内有多个大小不等的白色结节,以细胞刮刀小心自培养皿底壁刮擦,使膜状物与皿底分离;将获得的细胞膜片进行组织学、扫描电镜及透射电镜检测,验证其成骨性。
1.3.2 细胞膜片的成骨性能检测:以4%多聚甲醛固定膜片,梯度酒精脱水,石蜡包埋,切成5µm切片,分别行H&E、茜素红和Von Kossa组织学染色;另取部分膜片冷丙酮固定2h,行改良钙钻法碱性磷酸酶染色;同时选取部分膜片,以3%戊二醛固定,系列丙酮脱水,环氧树脂浸透包埋,制备成超薄切片,电子染色后JEM-2000EX透射电镜观察超微图像;另一部分膜片固定后,系列梯度乙醇脱水、乙腈干燥、喷金、扫描电子显微镜观察标本的微细形貌。
1.4 骨髓来源内皮前体细胞(EPCs)的分离培养和鉴定
1.4.1 EPCs的分离培养:MSCs重悬于血管内皮培养基(EGM-2培养基、10%胎牛血清),接种于涂布1%明胶的10cm培养皿,置37℃、体积分数为5%的CO2饱和湿度恒温培养箱培养;4d后以PBS冲洗弃去未贴壁细胞,每3d换液1次。第2~3代细胞用于以下实验。
1.4.2 EPCs的鉴定
1.4.2.1 内皮细胞特异性的CD31染色:4%多聚甲醛固定15min,PBS摇床振洗3次,每次5min,3%H2O2室温孵育30min消除内源性过氧化物酶活性,PBS摇床振洗,山羊血清封闭液封闭30min,然后加入小鼠抗兔CD31抗体(1:20稀释),4℃孵育过夜;37℃孵育1h,PBS缓冲液摇床振洗,再滴加FITC标记的二抗山羊抗小鼠IgG,室温1h,PBS缓冲液洗后在荧光显微镜下观察细胞是否显示绿色荧光;DAPI(25mg/L)复染细胞核5min,清洗,50%缓冲甘油封片,共聚焦显微镜下观察结果并照相。
1.4.2.2 荆豆凝集素染色:以4%多聚甲醛固定,PBS冲洗,3%H2O2室温孵育30min消除内源性过氧化物酶活性,PBS振洗,山羊血清封闭液封闭30min,滴加辣根过氧化物酶标记的荆豆凝集素(HRP-UEA-I)4℃孵育过夜;37℃复温孵育1h,PBS漂洗,直接滴加DAB显色液5~10min;蒸馏水洗,常规系列乙醇脱水,二甲苯透明,树脂封片。
1.4.2.3 透射电镜观察:离心法制备细胞样本,以3%戊二醛固定,系列丙酮脱水,丙酮-EPON812浸透、包埋、修块,制备50nm超薄切片,电子染色后透射电镜观察细胞超微结构。
1.5 构建MSCs膜片-EPCs复合体和体内移植实验
1.5.1 构建MSCs膜片-EPCs复合体:裸鼠随机分为两组,每组10只。实验组:将500µl的EPCs悬液 (1×106)分散接种至直径为10cm的培养皿内成骨诱导的MSCs膜片表面,添加DMEM/F12成骨诱导及EGM-2血管内皮培养液(1︰1),静置孵育24h使EPCs贴合于膜片。弃培养液后PBS冲洗,用细胞刮刀沿培养皿底壁刮擦,使膜状物与皿底分离,获得MSCs膜片-EPCs复合体,用镊子将其先折叠成长方形状,再由一端滚动卷起,最终制备成扁柱状的复合细胞多聚体。对照组:将直径为10cm培养皿内成骨诱导的单纯MSCs膜片,以同样方法制备。
1.5.2 体内移植实验:裸鼠乙醚吸入麻醉,切开背部皮肤,皮下潜行分离植入构建物;术后4周、8周两组分别随机处死动物5只,行大体观察、Micro-CT、扫描电镜及组织形态学分析。
1.6 检测指标和方法
1.6.1 大体观察及Micro-CT扫描:取材后大体观察移植物的颜色、形状及质地。然后行Micro-CT扫描,层厚10.44µm,电压80kV,电流500µA。以Inveon Research Workplace软件三维成像,随机选取兴趣区(2mm×2mm×2mm)分析:骨体积分数Bone volume/Total volume (BV/TV), 骨小梁厚度Trabecular Thickness (Tb.Th),骨小梁数量 Trabecular Number (Tb.N)和骨小梁间隙 Trabecular Spacing (Tb.Sp)。
1.6.2 扫描电子显微镜分析:标本经3%戊二醛固定24h,随机切取小块样本,梯度酒精脱水、干燥、喷金,观察标本剖面结构。
1.6.3 组织学分析:样本经4%多聚甲醛固定24h,10%EDTA脱钙、脱水、石蜡包埋、切片、H&E及改良丽春红三色染色,普通光学显微镜行组织形态学定性分析。每组每例样本选取3张H&E及3张改良丽春红三色染色切片。每张切片低倍镜下随机选择3个视野,由三人分别独立采用Leicas Qwin Pro-image 图像分析系统(Wetzlar,德国),定量分析新生骨面积和血管面积百分比。
1.7 统计学分析:使用SPSS17.0软件行统计学分析,数据以均数±标准差表示,P<0.05认为差异有统计学意义。
2 结果
2.1 培养细胞的特性检测结果:原代培养的MSCs均质增殖,呈现纺锤形,3d后可在镜下观察到典型集落形态 (图1A);MSCs具备多向分化潜能,能够向成骨、成脂和成软骨分化(图1B~D)。
EPCs能够形成典型的内皮细胞集落,中央为圆形细胞(图2A);2周后细胞呈现鹅卵石形(图2B),并逐渐发芽形成管腔状结构(图2E);内皮细胞特异性的凝集素染色、CD31染色表达阳性(图2C~D);此外透射电镜观察可见内皮细胞特有的杆状细胞器W-P小体(图2F)。
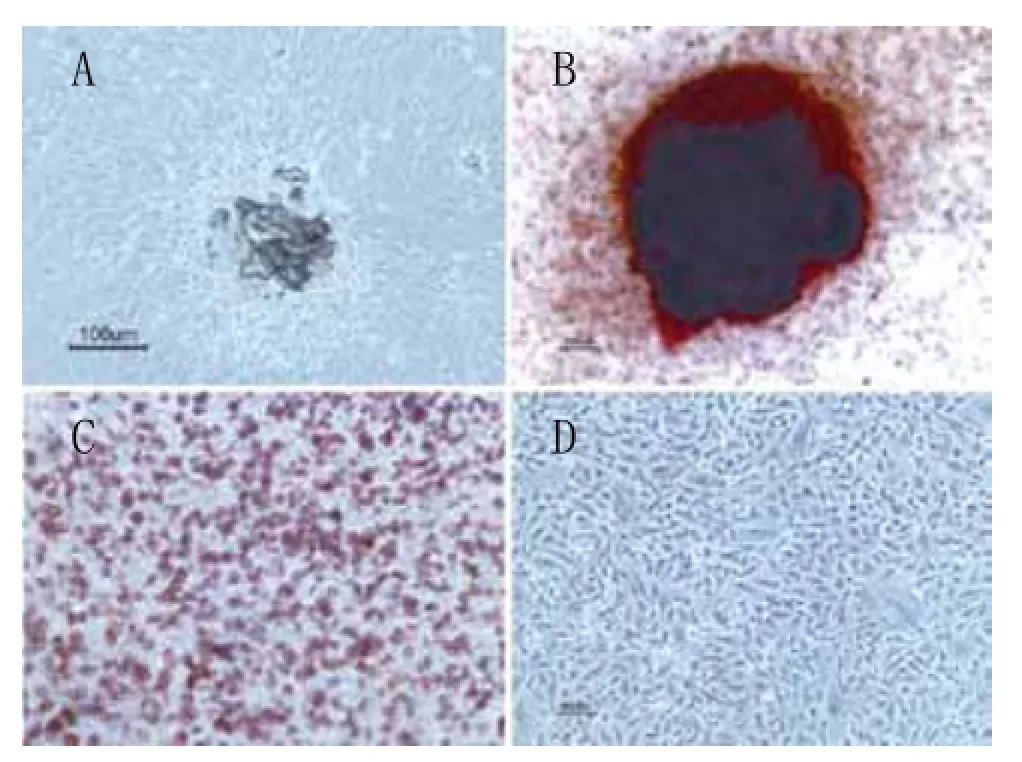
图1 MSCs特性

图2 EPCs特性
2.2 细胞膜片的成骨性能检测结果:2周后成骨性细胞膜片形成,呈现半透明状(图3A);用两把镊子可将整张膜片组织轻轻提起,无需使用酶消化,可进行折叠,操作性能好(图3A~C);依据组织学染色可见,膜片由多层细胞和细胞外基质构成,厚度约150~220µm(图4A);碱性磷酸酶染色阳性证实膜片具备成骨性能(图4B),Von Kossa染色及茜素红染色表明膜片中有矿化结节沉积(图4C~D);扫描电镜(图5A~B)和透射电镜(图5C~D)观察显示,MSCs完全包埋于细胞外基质中,成骨性膜片表面可见丰富胶原纤维分泌和矿化组织沉积。

图3 细胞膜片的大体观察
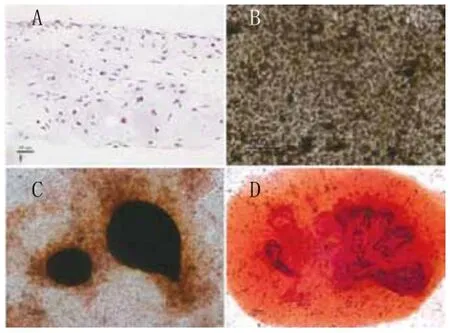
图4 细胞膜片特性
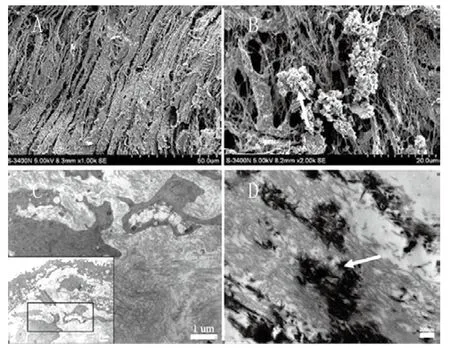
图5 细胞膜片成骨性能检测结果
2.3 体内血管化骨形成检测结果
2.3.1 大体观察及Micro-CT扫描结果:植入4周和8周时,两组均在裸鼠皮下异位形成骨样组织块,骨块完整,但均未能保持原有圆柱状形态。大体观察,实验组标本外周密布一层血管网,颜色更红,质地更硬(图6A~C)。而对照组样本呈现白色、表面光滑、质地坚韧的组织块(图6D~F)。两组标本的横截面均呈板层骨,未见液化坏死组织(图6C、F)。
Micro-CT三维重建显示,两组4周和8周的标本均有新骨形成,表现为高密度的矿化影,但实验组(图7A、C)的松质骨结构较对照组密度更高(图7B、D)。定量分析显示,实验组4周和8周时骨密度分别为110HU和256HU,而对照组则分别为59HU和181HU。同时实验组移植体内4周和8周后新生骨体积分别达到28.3%和58.6%,显著大于对照组(P<0.05),见表1。
表1 移植组织块影像学和组织学定量分析 (n=5,)

表1 移植组织块影像学和组织学定量分析 (n=5,)
注:*表示两组在同一时间点的差异性(P<0.05);**表示同组在不同时间点的差异性(P<0.05)
组别 时间 骨密度(HU) 骨体积分数(%) 血管密度(cm-2) 成骨百分比(%)对照组 4周 59±8 18.6±1.4 13.3±2.6 17.3±1.1 8周 181±13 30.5±2.9** 20.5±4.2** 31.1±1.8**实验组 4周 110±15 28.3±1.3* 17.7±3.1* 29.8±2.1*8周 256±27 58.6±3.1*,** 36.6±2.3*,** 58.9±3.2*,**
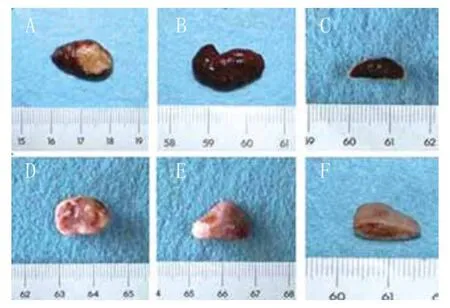
图6 标本大体观察

图7 Micro-CT扫描三维重建显像
2.3.2 扫描电子显微镜观察结果:扫描电镜观察可见,实验组构建的组织工程骨横断面呈类似松质骨样结构,其内排列大量片状骨小梁,并交织成网格样结构(图8A);骨小梁剖面的超微结构表现为典型的矿化结节聚合体(图8B);骨髓腔内含有不同类型的骨髓细胞成分(图8C)。对照组仅见少量骨样组织形成,呈不规则形排列(图8D)。
2.3.3 组织学定性分析结果:两组均未发生炎症反应,均有新生骨和血管形成,但存在显著差异。植入4周后,两组均可观察到新生骨组织形成和血管渗入(图9)。实验组组织工程骨的外周和内部,有大量骨小梁和编织骨结构(图9A~C),图9B可见成骨细胞成行密集排列在新生的矿化骨表面(白色箭头),骨细胞包埋于骨基质内(红色箭头),同时骨髓腔内充满原始骨髓细胞(星形符号)。而对照组形成的骨样组织和血管成分均较少,呈散在分布(图9D~F),组织内部还观察到肥大软骨细胞和软骨样结构(图9E)。

图8 扫描电镜观察结果
8周时,随着血管网渗入组织块内部,新生骨密度逐渐增加,并相互融合(图10)。实验组由于建立了丰富的血供,组织工程骨发生的速度较对照组快且数量多(图10A~C),观察可见成骨细胞包埋于骨陷窝内,外周伴随有丰富的血管网,显示典型的膜内成骨方式;此外组织内部充满丰富的交织成网状的骨小梁和血管结构,小梁间隙内骨髓细胞进一步成熟(图10B)。而对照组(图10D~F)的成骨及血管化程度均逊于实验组,可观察到新生骨和软骨样组织呈松散的不规则分布,骨的发生表现为典型的软骨内成骨方式。

图9 移植术4周后组织学分析结果
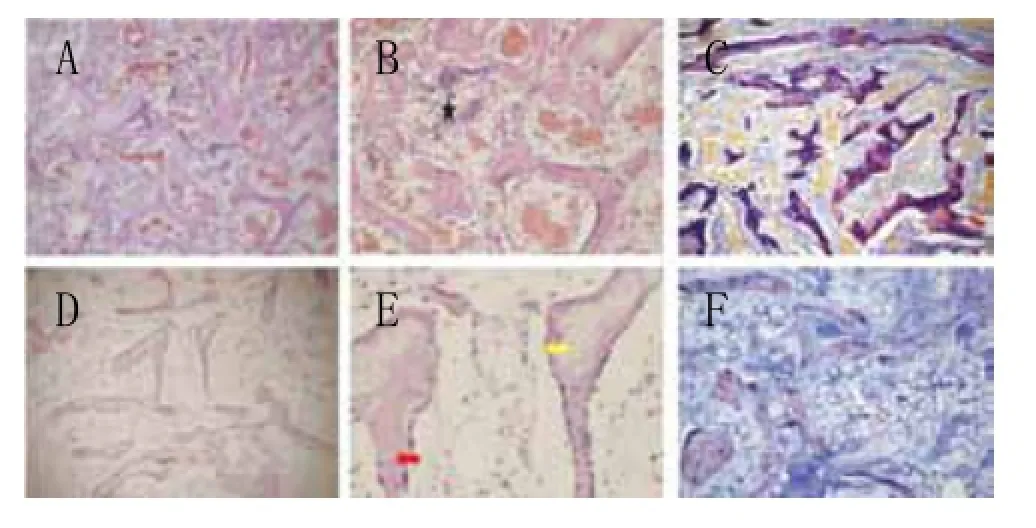
图10 移植术8周后组织学分析结果
2.3.3 组织学定量分析结果:组织学定量分析与形态学分析结果相一致,实验组的新骨和血管形成面积随着时间推移明显增多,与Micro-CT扫描结果一致,在每个时间点实验组的新骨形成均优于对照组;4周和8周时,实验组新生组织中血管密度分别为17.7/cm2和36.6/cm2,也显著高于对照组(P<0.05)。见表1。
3 讨论
血管在运送氧气、营养物质和代谢产物方面起重要作用,因而组织工程构建物仅仅在存在血供时才形成骨组织,研究表明[2],单纯组织工程学方法构建的工程骨厚度不能大于0.7mm,否则骨块中心区域的细胞将因营养缺乏而死亡。有研究报道[10],由于缺乏血供在组织工程骨的内部常发生坏死,致使组织工程构建物仅仅在表面形成薄层骨质。可见充足的营养对组织工程骨的存活至关重要。
Sekine[11]等报道,将不同密度的血管内皮细胞与小鼠心肌细胞膜片复合培养,观察到由内皮细胞分泌的血管生长因子明显增加。将含有内皮细胞的膜片组织贴附至缺血受损的心脏后,发现随着复合膜片中所含内皮细胞密度的增加,心脏功能显著改善。组织学分析也显示,由植入的内皮细胞发芽形成的血管网与宿主心脏的毛细血管网相连接。Tsigkou[10]等报道了用人骨髓间充质干细胞和脐静脉内皮细胞,采用两步法构建血管化组织工程骨,移植后4~7d即可形成管状和网状结构。但是,这些研究使用的内皮细胞来源于血管,在体外分离培养较为困难,不利于临床广泛应用。
Murohara[12]等自脐带血分离出MSCs,进而诱导分化为血管内皮前体细胞,并证实血管内皮前体细胞较内皮细胞增殖能力强,可充分形成血管化微环境。Annabi[13]等也证实,骨髓来源MSCs能够在体外诱导分化为血管内皮前体细胞。而且研究表明,成骨细胞和内皮细胞共培养,与单一培养相比较,所释放的血管内皮生长因子VEGF更高。同时,血管内皮前体细胞也可分泌骨形成蛋白促进细胞成骨分化,上调ALP活性。由于骨髓来源MSCs已在组织工程研究中广泛应用,采用这一细胞来源获取血管内皮前体细胞,构建血管化骨将更为理想。
本研究表明,选用同一来源的骨髓间充质干细胞向成骨、成血管双向诱导分化,可构建出血管化骨,并证实搀入血管内皮前体细胞,不仅能够产生血管网、而且能够促进新骨形成。我们还展现了一种无需外源性支架材料的新型骨构建策略。本实验最大的优点是,构建出具有良好血管化,又完全来源于自体细胞的组织工程骨。
本实验证实MSCs除了能够向成骨、成脂和成软骨分化外(图1),还可向成血管分化。诱导的内皮前体细胞表达内皮细胞表达标志CD31和荆豆凝集素,可形成W-P小体和管状结构(图3)。然后运用异位骨形成动物模型评价细胞膜片-内皮前体细胞复合体的成骨和血管化能力。Micro-CT扫描观察见细胞膜片-内皮前体细胞复合体中新骨的形成显著增加(图7)。组织学分析显示,植入8周后细胞膜片-内皮前体细胞复合体内新骨和血管的形成,分别是单纯细胞膜片组的1.9倍和1.8倍。实验证实,搀入内皮前体细胞可显著促进新骨形成。更重要的是,内皮前体细胞和细胞膜片均来源于骨髓间充质干细胞,实验说明仅仅通过抽吸少量骨髓即可构建出血管化骨。
细胞膜片技术能够保持细胞间紧密连接,保留了体外培养过程中沉积的构建软骨和骨组织的细胞外基质,避免使用酶消化。Okano’s[14]实验组应用细胞膜片技术成功构建出心肌和角膜等组织,但需借助特制的温敏性培养皿获取细胞膜片。实验中使用普通培养皿和细胞刮刀可收获完整的细胞膜片,此法更加便利和实用。经过在成骨诱导培养液中连续培养,MSCs形成了由多层活性细胞和自身所分泌的细胞外基质构成的高密度细胞膜片,基质中矿化结节逐渐沉积,ALP活性升高(图4和5),结果表明MSCs膜片具备体外成骨分化潜能。搀入内皮前体细胞后获得复合膜片,可用组织镊收获,并能够便利地折叠赋形后用于体内移植实验(图3)。
单纯使用细胞膜片组移植4周和8周后,可观察到钙化软骨和肥大软骨细胞(图9和10),新骨形成以软骨内成骨方式为主,这一结果与以往有关骨组织工程研究结果相一致。有趣的是,使用细胞膜片-EPCs复合体移植4周后,钙化软骨和肥大软骨细胞均未见(图9A~C),而形成的血管密度增加了1.8倍。结果表明,实验组在4周前即已完成软骨内成骨。充分的血管化和充足的营养供应可加快软骨内成骨速度,而早期成骨化更有利于临床骨缺损修复,尤其对于负重部位骨缺损[15]。此外,如果将膜片与高机械强度的支架结合应用,构建的组织工程骨也有望用于修复大段和负重部位的骨缺损。
[1]刘欢,周炜,赵銥民.内皮祖细胞于骨髓间充质干细胞构建血管化组织工程骨的研究进展[J].医学综述,2015,21(23):4228-4230.
[2]Han Y,Hsieh FH.Osteogenic differentiation of late-outgrowth CD45-negative endothelial progenitor cells[J].J Vasc Res,2014,51(5):369-375.
[3]Zheng R,Duan H,Xue J,et al.The influence of Gelatin/PCL ratio and 3-D construct shape of electrospun membranes on cartilage regeneration [J].Biomaterials,2014,35(1):152-164.
[4]Matsuura K,Utoh R,Nagase K,et al.Cell sheet approach for tissue engineering and regenerative medicine [J].J Control Release,2014,190(9):228-441.
[5]闫旭,明磊国,罗鹏,等.骨髓间充质干细胞膜片结合冻存自体骨瓣修复兔颅骨极限缺损[J].中华神经医学杂志,2014,13(5):438-702.
[6]汪经纬,张爱君,陶常波,等.人脂肪干细胞膜片修复裸鼠颅骨缺损研究[J].徐州医学院学,2015,35(11):769-772.
[7]冯文磊,张猛,印双红,等.改良贴壁法分离培养鉴定小鼠骨髓间充质干细胞和内皮前体细胞[J].解剖学报,2015,46(2):282-288.
[8]胡洋,张猛,郝兰坡,等.骨髓源性血管内皮祖细胞体外分离、培养及分化为内皮细胞研究[J].现代中西医结合杂志,2015,24(22):2421-2424.
[9]徐海春,王伟,徐晓东.利用骨髓间充质干细胞膜片原位构建“三明治”样组织工程牙周膜的实验研究[J].中国医疗美容,2016,6(7):78-81.
[10]Tsigkou O,Pomerantseva I,Spencer JA,et al.Engineered vascularized bone grafts[J].Proc NatI Acad Sci U S A,2010,107(8):3311–3316.
[11]Sekine H,Shimizu T,Hobo K,et al.Endothelial cell coculture within tissue engineered cardiomyocyte sheets enhances neovascularization and improves cardiac function of ischemic hearts[J].Circulation,200 8,118(Suppl):S145-152.
[12]Murohara T.Therapeutic vasculogenesis using human cord blood-derived endothelial progenitors [J].Trends Cardiovasc Med,2001,11(8):303–307.
[13]Annabi B,Naud E,Lee YT,et al.Vascular progenitors derived from murine bone marrow stromal cells are regulated by fl broblast growth factor and are avidly recruited by vascularizing tumors[J].J Cell Bioche,2004,91(6):1146–1158.
[14]Iwata T,Yamato M,Washhio K, et al. Cell sheet for periodontal tissue engineering [J].Cur Oral Health Rep,2015,2(2):252–256.
[15]Nakano K,Murata K,Omokawa S,et al.Promotion of osteogenesis and angiogenesis in vascularized tissueengineered bone using osteogenic matrix cell sheets[J].Plast Reconstr Surg,2016,137(5):1476–1484.
编辑/张惠娟
Engineering Vascularized Bone Graft with Osteogenic and Angiogenic Lineage Differentiated Bone Marrow Mesenchymal Stem Cells
ZHANG Rong,GAO Zhan,GAO Wei
(Department of Oral and Maxillofacial Surgery,General Hospital of Xinjiang Military Command,Urumqi 830000,Xinjiang,China)
Objective We report a novel strategy to engineer vascularized bone grafts with osteogenic and angiogenic lineage differentiated marrow mesenchymal stem cells(MSCs).Methods MSCs were expanded to form an osteogenic cell sheet using a continuous culture method and a scraping technique under osteogenic culture conditions. Another portion of MSCs was directed to differentiate into highly proliferative endothelial progenitor cells (EPCs), which were then seeded onto the cell sheets. Cell sheet–EPCs complexes were implanted subcutaneously in nude mice. Cell sheets without EPCs were also implanted as a control. The mice were sacrificed, and the samples were harvested for evaluation consisting of micro-CT scanning, histological analysis and scanning electronic microscopy 4 and 8 weeks after implantation.Results Cell sheets were composed of viable cells and extracellular matrix and showed apparent mineralization. The obtained EPCs could express the specific antigen marker of CD31 and form capillary-like structures in vitro. The osteogenic cell sheet–EPCs complexes yielded wellvascularized bone grafts 4 and 8 weeks after implantation. Both bone density and vascular density were signiflcantly higher in the cell sheet–EPCs complex group than in the control group.Conclusion The results demonstrated that the introduction of EPCs could not only generate a vascular network but also increase bone formation for cell sheet- based bone engineering.
bone tissue engineering;cell sheet;vascularization;mesenchymal stem cell;endothelial progenitor cells
Q813.1
A
1008-6455(2017)04-0061-06
2017-01-18
2017-04-06

