血竭局部外用对兔耳缺血创面愈合的影响
李 丹,惠 瑞,韩 岩
(1.解放军总医院外科临床部整形修复科 北京 100853;2.海军总医院神经外科 北京 100048)
血竭局部外用对兔耳缺血创面愈合的影响
李 丹1,惠 瑞2,韩 岩1
(1.解放军总医院外科临床部整形修复科 北京 100853;2.海军总医院神经外科 北京 100048)
目的:血竭为传统医学中生肌方剂的主要成分,曾长期应用于临床治疗多种难愈性创面,具有确切的疗效。本课题应用兔耳缺血创面模型,观测血竭对创面愈合的作用。方法:血竭用基质稀释为A1(0.3mg/ml),A2(3mg/ml),A3(30mg/ml),A4(100mg/ml)4种浓度,并以基质A5作对照,作用于兔耳缺血创面,于创面形成后第3、6、9、12天进行大体观察及显微测量,通过苏木精-伊红染色观测创面愈合组织病理变化,天狼猩红染色观察创面愈合过程中Ⅰ、Ⅲ型胶原比例。结果:血竭组A2(13.1±1.7)d、A3(12.3±0.9)d创面愈合速度快于对照组A5(15.7±0.9)d,两者差异具有显著性意义(P<0.01);术后3d到术后12d创面愈合过程中,A2,A3组创面愈合面积与对照组差异具有统计学意义(P<0.01);A3组新生肉芽组织体积与对照组相比差异有显著意义(P<0.01);创面愈合第6天A3组天狼猩红染色Ⅰ、Ⅲ型胶原比值2.23/1大于对照组1.44/1(P<0.01),而第15天Ⅰ、Ⅲ型胶原比例与对照组相比无明显差异(P>0.05)。结论:血竭能够提高兔耳缺血创面愈合速度,改善创面愈合质量,具有显著促进缺血创面愈合的作用。
血竭;创面愈合;兔耳缺血创面
血竭具有显著的促进伤口愈合以及活血止痛的作用。南美洲民间医学常用血竭治疗创伤,我国中医学运用血竭单方或含有血竭的生肌复方治疗难愈性创面,具有确切的疗效。目前关于血竭对动物伤口模型作用的报道仅见Porras-Reyes[1]研究发现南美洲血竭具有促进小鼠线性伤口愈合的作用。国内文献多为对血竭或含血竭复方临床应用中的疗效观察,有文献报道血竭提取物对角质形成细胞与成纤维细胞的增殖有促进作用[2-4],而对血竭作用于难愈性创面动物模型的研究尚未见报道。本实验应用兔耳缺血模型,观测血竭对其愈合时间及愈合质量的影响,为阐明血竭促进难愈性创面愈合的机理提供了有意义的实验资料。
1 材料和方法
1.1 主要试剂:846合剂(长春农牧研究所);天狼猩红染料(Sirius Red F3B,英国);30%饱和苦味酸(广东汕头西陇化工厂);40%甲醛(天津大茂化学试剂厂);0.1%磷酸缓冲液(天津大茂化学试剂厂);血竭(皇冠牌,印度尼西亚);Harris苏木精染液(西京医院病理科)。
1.2 主要仪器:6mm活检打孔器(本科实验室);石蜡切片机(德国Leitz公司);BX-60荧光显微镜及照相系统Olympus(日本)。
1.3 药物的制备
1.3.1 药物的配制:使用乳钵将血竭研磨成粉末,在56℃水浴条件下加热30min,并不断搅拌混匀直至完全溶于基质,基质成分为硬脂酸、凡士林、单硬脂酸甘油酯、尼泊金乙酯、水等混合而成。将血竭制成浓度为0.3mg/ml、3mg/ml、30mg/ml、100mg/ml的药膏待用。
1.3.2 Bouin氏液:苦味酸饱和水溶液(1.22%)75ml、40%甲醛25ml、冰醋酸5ml
1.4 实验动物及方法
1.4.1 动物模型的制作及分组
1.4.1.1 实验动物:新西兰白兔20只,体重3.5~4.0kg,雌雄不限,兔龄2年。随机分为5组:A1(0.3mg/ml),A2(3mg/ml),A3(30mg/ml),A4(100mg/ml)4种浓度,并以基质A5作对照,每组4只。
1.4.1.2 兔耳缺血模型制作:采用846合剂以0.1ml/kg进行耳缘静脉麻醉。在双侧兔耳根部环行切开耳背、耳腹侧皮肤,刮除软骨膜,暴露软骨,分离结扎耳背侧中央动脉及头侧动脉,保留尾侧动脉及所有静脉(图1)。在耳腹侧用活检打孔器制成直径6mm的5个圆形创面,均匀分布,创面内刮除表皮及软骨膜。
1.4.1.3 创面用药:将同一只实验用兔双侧兔耳共10个圆形创面随机分为A1、A2、A3、A4、A5组,每组2个创面,分别以1cm×1cm大小医用纱布薄片蘸取约100mg血竭药膏或基质敷于创面,外层覆盖医用胶布固定于兔耳。其中A1组用药浓度为0.3mg/ml、A2为3mg/ml、A3为30mg/ml、A4为100mg/ml、A5组使用基质作为对照组。术后隔日换药。
1.4.2 创面摄影与大体观察:分别于创面形成后第0、3、6、9、12天行创面摄影(距离4cm,微距拍摄模式)。观察创面愈合过程中不同浓度用药组以及对照组皮温、颜色、肉芽组织生长、表皮爬行增生等变化,并记录愈合时间。
1.4.3 标本切取及处理:创面形成后于第3、6、9、12天分别过量麻醉剂处死动物,以每一创面为中心,切取1cm×1cm正方形组织块(含兔耳全层),并过创面圆心将组织块分为两份。标本置于Bounie氏液中固定24h,常规石蜡包埋、制作厚度为3μl切片。
1.4.4 HE染色:选取术后第3、6、9、12天分别处死的兔耳组织切片进行HE染色。主要步骤为切片浸入苏木精染液,1%盐酸酒精分化,10%氨水使细胞核蓝化,伊红液浸染,经80%、85%、90%、95%无水酒精顺序脱水后用二甲苯透明,中性树胶封片。在光镜下观察炎细胞浸润、组织水肿、肉芽组织生成和表皮增生、移行等情况。
1.4.5 苦味酸-天狼猩红染色:①染液配制:0.1%苦味酸一天狼星红溶液:天狼猩红(Sirius red) 0.1g、饱和苦味酸溶液100ml;②染色步骤:选取术后第6天和第12天兔耳石蜡组织切片在二甲苯中彻底脱蜡,经各级乙醇脱水,0.1%饱和苦味酸一天狼星红溶液中浸染2h以上,流水冲洗5min,按常规方法用Harris苏木精复染,经各级乙醇脱水,二甲苯透明,树胶封片。染色后的切片胶原着色,在普通显微镜下呈红色。使用偏振光显微镜观察染色切片并进行显微摄影。
1.4.6 显微测量与图像分析
1.4.6.1 显微镜下用显微测微标尺(精确到0.1mm) 测量HE染色各组切片的新生上皮间距(EG)、新生肉芽组织间距(GTG)、新生肉芽组织平均厚度(MH),见图1。由此推算在术后第3、6、9、12天创面愈合面积(S愈合)及新生肉芽组织体积(V肉芽组织):
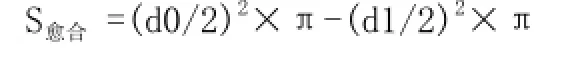
其中d1:新生上皮细胞间距(EG);d0:总创面直径6mm;(d0/2)2×π:总创面面积S总;愈合面积占总创面的百分比:S愈合/S总×100%。S愈合和S愈合/S总均能准确反映创面愈合速度。
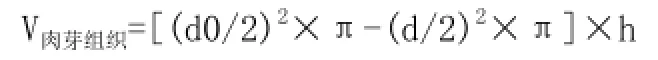
其中d1:新生肉芽组织间距(GTG);d0:总创面直径6mm;h:新生肉芽组织平均厚度(PH)。
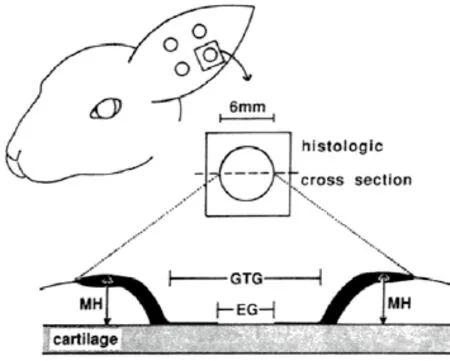
图1 兔耳创面模型及愈合检测指标示意图
1.4.6.2 苦味酸-天狼猩红染色切片,采用Photoshop 7.0图像分析系统分别进行检测。在偏振光显微镜下每张切片按系统抽样法随机抽取5个视野,用Photoshop 7.0中的色彩范围工具选取颜色,用直方图计算不同颜色所占像素大小,分析其比例变化,以此测定I、Ⅲ型胶原含量。
1.5 统计学分析:实验所得数据采用SPSS13.0统计分析软件进行处理,并以均数±标准差表示。两组间比较采用t检验,多组均数间比较采用单因素方差分析,P<0.05表示有统计学意义。
2 结果
2.1 大体观察:创面形成后,周围青紫水肿,前2天最明显,第3天以后基本恢复,术后第3天创缘有少量肉芽形成,用药组分泌物较对照组多,5d后显示实验组肉芽色泽较红润,术后3~6d创缘有新生上皮爬行。前3天各组未见明显差别,第6天后用药组愈合速度快于对照组。第12天A2、A3用药组部分创面已经完全上皮化(图2)。第15天观察愈合后基质组瘢痕与用药组相比并无显著差异。各组愈合时间差异见表1。
2.2 显微测量:通过对创面愈合过程中第3、6、9、12天兔耳切片EG、GTG、MH的显微测量,结合计算公式可以得出S愈合及V肉芽组织。由表2可以得出,A2、A3组的S愈合在术后第3~12天创面愈合过程中均高于对照组,且与血竭呈剂量依赖性,其中A3组最为显著(P<0.01)。由表3可以得出,A2组、A3组、A4组的V肉芽组织在术后第3~12天创面愈合过程中均高于对照组,且在3~30mg/ml浓度范围内与血竭浓度呈剂量依赖关系,其中A3组V肉芽组织与对照组差异最为显著(P<0.01)。
表1 5组创面愈合时间比较 (,d)

表1 5组创面愈合时间比较 (,d)
注:*与对照组A5组比较,P<0.05
A1组 A2组 A3组 A4组 A5组(对照组)愈合时间 16.5±1.1 13.1±1.7* 12.3±0.9* 14.3±1.6 15.7±0.9
表2 各时间点血竭浓度与愈合面积关系 (,mm2)
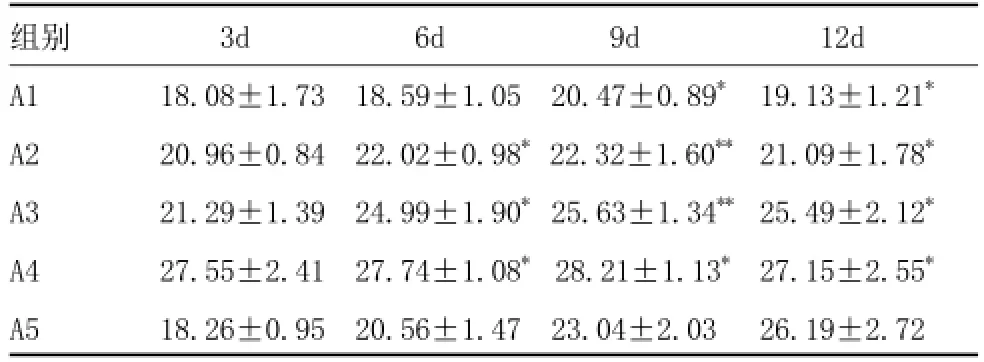
表2 各时间点血竭浓度与愈合面积关系 (,mm2)
注:*与对照组A5组相比 P<0.05**;与对照组A5组相比 P<0.01
组别 3d 6d 9d 12d A1 18.08±1.73 18.59±1.05 20.47±0.89*19.13±1.21*A2 20.96±0.84 22.02±0.98*22.32±1.60**21.09±1.78*A3 21.29±1.39 24.99±1.90* 25.63±1.34**25.49±2.12*A4 27.55±2.41 27.74±1.08* 28.21±1.13*27.15±2.55*A5 18.26±0.95 20.56±1.47 23.04±2.03 26.19±2.72
2.3 组织形态学观察:光镜下观察HE染色切片显示,术后第3天,血竭组创缘部分表皮细胞开始向中心移行,皮脂腺上皮显著增生,多位于真皮浅层。皮下有少量新生血管,组织水肿较轻,炎细胞浸润较少;对照组未见皮脂腺上皮增生,皮下血管较少,组织水肿显著,炎细胞浸润较多。
术后第6天,血竭组表皮进一步向创面中心移行,且表皮层数显著增多,出现多处皮脂腺样结构。皮下有较多新生小血管和成纤维细胞,胶原纤维较粗,且排列平行有序(图2);对照组表皮层数较少,毛囊和皮脂腺上皮细胞增生仍不显著,胶原纤维纤细,排列松散不平行(图3)。
术后第9天,血竭组表皮层增厚更为明显,出现垂直于表皮的“皮钉”,表皮细胞排列致密,上层表皮出现角化。皮下可见大量成纤维细胞已形成成熟的梭形纤维细胞,皮下可见丰富的新生血管;对照组创面也可见较多新生血管,成纤维细胞排列紊乱,纤维细胞数目少,表皮细胞层数较血竭组少。
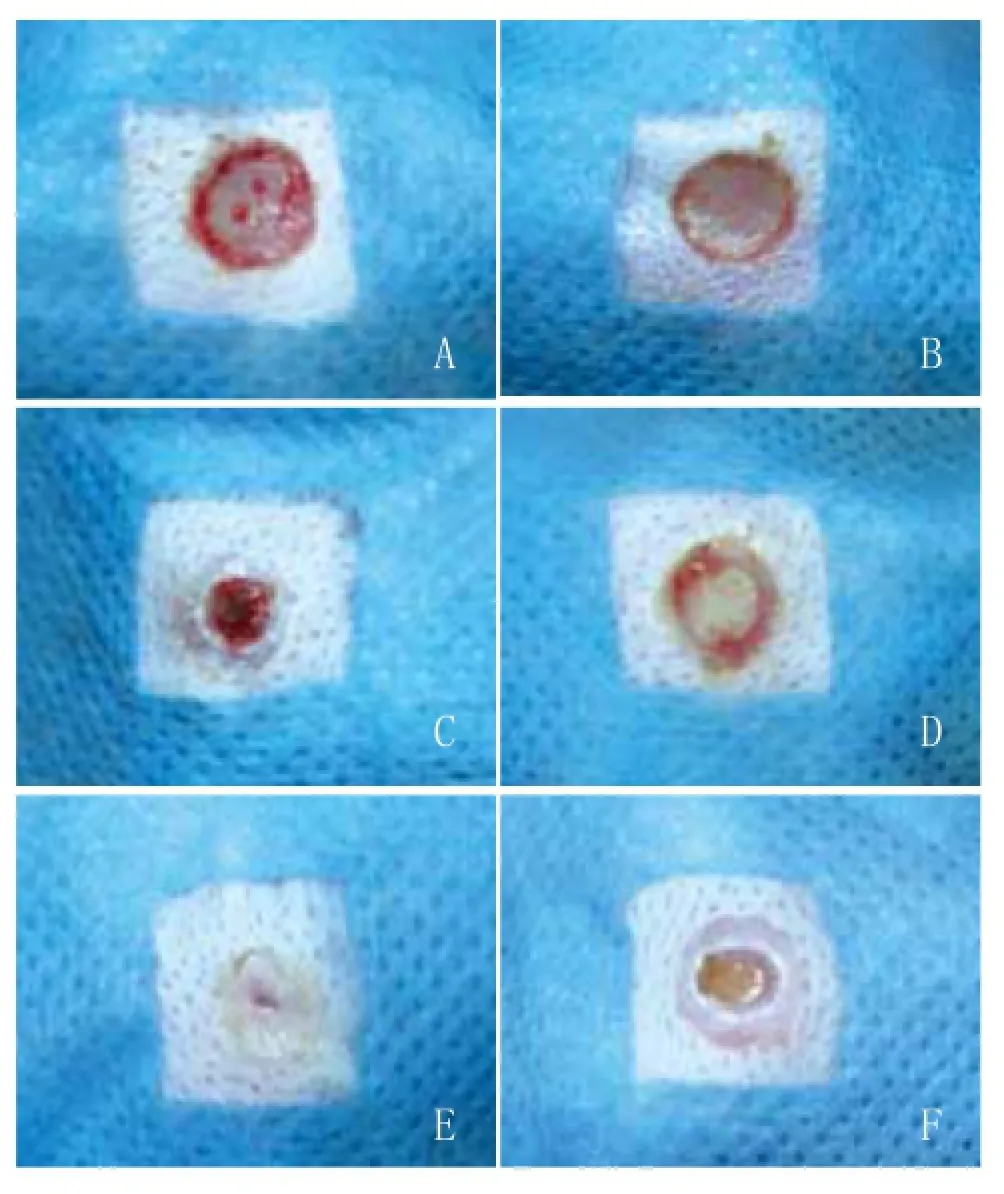
图2 30mg/ml血竭组与对照组兔耳难愈创面愈合情况比较
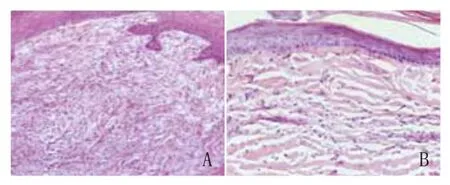
图3 术后第9天30mg/ml血竭组与对照组HE染色镜下观察结果(×200)

图4 术后第6天30mg/ml血竭组与对照组天狼猩红染色镜下观察结果(×400)
表3 各时间点血竭浓度与新生肉芽组织含量关系 (,mm3)
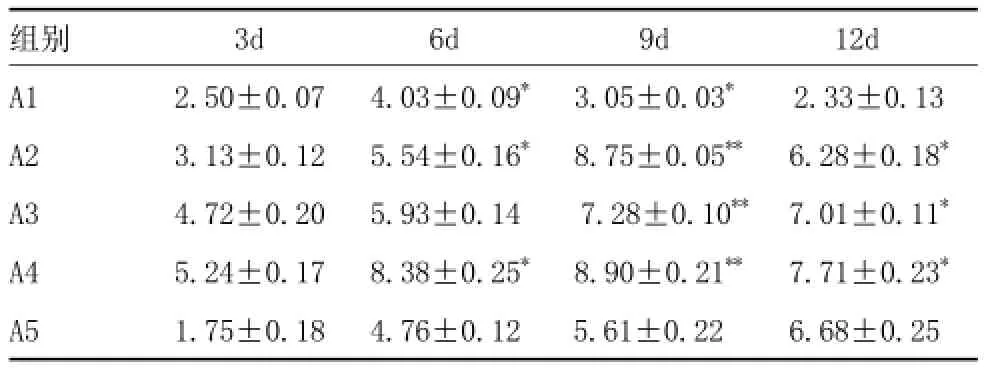
表3 各时间点血竭浓度与新生肉芽组织含量关系 (,mm3)
注:*与对照组A5组相比 P<0.05;**与对照组A5组相比 P<0.01
组别 3d 6d 9d 12d A1 2.50±0.07 4.03±0.09* 3.05±0.03* 2.33±0.13 A2 3.13±0.12 5.54±0.16* 8.75±0.05** 6.28±0.18*A3 4.72±0.20 5.93±0.14 7.28±0.10** 7.01±0.11*A4 5.24±0.17 8.38±0.25* 8.90±0.21** 7.71±0.23*A5 1.75±0.18 4.76±0.12 5.61±0.22 6.68±0.25
术后第12天,血竭组部分创面已基本愈合,表皮层增厚,皮下可见大量梭形的纤维细胞,平行紧密排列,新生血管数较第9天有所减少;对照组创面仍未愈合,新生血管较多,成纤维细胞与用药组相比尚未成熟,间质中胶原排列较为整齐。2.4 创面Ⅰ、Ⅲ胶原比例:使用偏振光显微镜观察天狼猩红染色切片,镜下可见术后第6天A3组、A4组I、Ⅲ型胶原比例较对照组增高,其中A3组与对照组差异最为显著(P<0.01);A2组I、Ⅲ型胶原比例较对照组显著降低(P<0.01)见表4、图4。术后第15天完全愈合时,实验组与对照组相比Ⅰ、Ⅲ胶原比例无明显差异(表4)。
3 讨论
血竭作为古老的止血生肌药物在国内外传统医学中均有广泛的应用。近年来研究表明,血竭除有改善创面血液循环、提高免疫力等作用外,还可能具有直接的促进创面愈合作用[5-9]。目前仅有国外Porras-Reyes报道血竭可以提高小鼠线性伤口愈合后的抗张力强度[1],而尚无关于血竭作用于慢性创面动物模型研究的报道。本实验采用兔耳缺血模型作为慢性创面的动物模型,观察到血竭对兔耳缺血创面具有促进愈合的作用。
慢性难愈性创面是由全身和局部多种因素造成的,主要表现为创面的愈合缓慢或不愈合,目前尚无一种标准的动物模型供研究使用。兔耳缺血模型最早由Ahn ST[10]于1990年报道,是目前应用较多的一种具有局部缺血特征的与人类难愈创面比较接近的理想动物模型。该模型具以下优点:①静脉血气分析以及皮温测定证实低氧状态明确可靠;②较低的感染率及坏死率;③兔耳软骨可以防止创面收缩,利于准确观测其愈合速度;④剥除软骨膜后创基即为无血运的软骨,新生肉芽组织从四周创缘均匀地向创面中心生长,这种规则的愈合方式也有助于准确观测愈合速度[11]。由于兔耳缺血模型的以上优点,本实验采用其来研究血竭对难愈性创面的作用,所得结果确实、可信,具有说服力。目前评价创面愈合的方法较多,其中创面愈合率、创面愈合时间及组织病理学分析,仍是最直接有效的创面愈合评价指标[12]。本实验中,我们采用显微镜下测微尺测量法,精确度高,较适用于规则创面的测量。实验结果表明,血竭对缺血创面修复中再上皮化及肉芽组织形成的促进作用存在着剂量依赖性,当浓度为3mg/ml时,有一定的促进作用;浓度为30mg/ml时,作用最为显著;浓度过低(0.3mg/ml)时,数值虽然与对照组相比存在差异,但无统计学意义。浓度过高(100mg/ml)时,血竭仅对肉芽组织形成具有促进作用,但却延缓了再上皮化过程。

表4 Ⅰ、Ⅲ胶原在创面愈合第6天时在各组中的比例
皮肤胶原主要为Ⅰ、Ⅲ型胶原,其中I型胶原是由两条α2和一条α1肽链构成,Ⅲ型胶原是由三条α1肽链构成。Ⅰ型胶原在占总胶原含量的80%~85%,在组织中起支架的作用。Ⅲ型胶原在皮肤中占总胶原量的15%~20%,含Ⅲ型胶原偏多的皮肤其纤维束较细,且弹性较好。皮肤中15周胎儿皮肤,Ⅰ型胶原与Ⅲ型胶原含量之比为0.8:1,成人则为3.5~6:1。创伤愈合早期Ⅲ型胶原含量相对较多,随着时间的推移,逐渐恢复正常[12]。在创伤修复、愈合过程中,其关键步骤之一是肉芽组织的形成,肉芽组织形成的高峰期在创面形成后3~6d,此期成纤维细胞数量急剧增多,并开始产生胶原纤维,胶原的数量和质量直接影响着创面修复愈合程度[13]。我们在实验中选择创面形成后第6天,来观察血竭在创面愈合早期对Ⅰ、Ⅲ型胶原的影响。苦味酸-天狼星红特殊染色切片经偏振光观察可发现不同创面愈合组织中Ⅰ、Ⅲ型胶原的形态和分布特点,并结合图像分析技术分别测量出肉芽组织中Ⅰ、Ⅲ型胶原的含量[14-15]。本实验结果显示,创面愈合第6天,血竭组中30~100mg/ml浓度范围内,Ⅰ型胶原所占比例均高于对照组,其中30mg/mlⅠ型胶原所占比例最高。而较低浓度0.3~3mg/ml血竭组的Ⅲ型胶原所占比例则高于对照组。创面愈合第12天,血竭组各组Ⅰ、Ⅲ型胶原比例与对照组无显著差异。这与Porras-Reyes[1]报道的浓度为25mg/ml血竭于创面形成后第5~7天可以显著促进伤口愈合的张力强度,而在第12天血竭组与对照组并无明显差别的结果相一致。说明血竭可以在创面愈合早期促进伤口愈合质量,形成较为成熟的Ⅰ型胶原,而在完全愈合后并不会出现由于过度修复所造成的病理性瘢痕现象。由实验结果可以推论出,血竭在浓度为30mg/ml时,对于兔耳缺血创面的再上皮化、肉芽组织形成以及Ⅰ型胶原的比例均有显著促进作用,为血竭促进创面愈合的最适应用浓度。
综上,本试验观察到血竭外敷于兔耳缺血创面,促进了兔耳缺血组织的快速增殖修复。其机制可能为:①可以促进细胞的迁移游走;②促进新生毛细血管化;③促进上皮细胞增殖;④调节胶原合成,提高Ⅰ型胶原合成比例。我们将进一步研究血竭促进兔耳缺血创面愈合过程中,药物对肉芽组织中微血管密度及相关生长因子表达调控的影响。
[1]Porras-Reyes BH,Lewis WH,Roman J,et al.Enhancement of wound healing by the alkaloid taspine def l ning mechanism of action[J].Proc Soc Exp Biol Med,1993,203(1):18-25.
[2]李丹,郭树忠,王胜春,等.血竭提取物对角质形成细胞增殖的影响[J].中国美容医学,2005,14(3):274-276.
[3]李丹,惠瑞.胡咏武.血竭提取物促进成纤维细胞增殖及胶原分泌[J].中国组织工程研究,2014,18(46):7437-7441.
[4]李丹,惠瑞,胡咏武,等.血竭提取物对成纤维细胞增殖及合成透明质酸的影响[J].中华整形外科杂志,2015,32(1):53-57.
[5]Kenneth J.Review of Sangre de Drago (Croton lechleri)—a south american tree sap in the treatment of diarrhea,inflammation,insect bites, viral infections, and wounds:traditional uses to clinical research. the journal of alternative and complementary medicin[J].J Altern Complement Med,2003,9(6):877-896.
[6]李红宾,王正文.血竭治疗皮肤黏膜创伤及其作用机制研究[J].现代中西医结合杂志,2003,12(18):2016-2017.
[7]陈德,高青,施伟民.中药中活血化瘀药对皮肤创伤愈合的影响[J].上海医学,2000,23(3):145-147.
[8]俞琦,王文佳,王平.血竭对组织工程皮肤移植模型大鼠创伤修复的影响[J].中国组织工程研,2016,20(37):5524-5529.
[9]Ahn ST,Mustoe TA.Effects of ischemia on ulcer wound healing: a new model in the rabbit ear[J].Ann Plast Surg,1990,24(1):17-23.
[10]彭湃,鲁开化,郭树忠,等.兔耳缺血创面模型的构建[J].第四军医大学学报,1999,20(11):989-990.
[11]黄康,陈玉林.创面愈合评价指标进展[J].中国修复重建外科杂志,2001,15(2):126-129.
[12]杨力,李荟元.用兔耳模型观察透明质酸与羟脯氨酸含量变化的关系.创伤研究动物模型[M].西安:第四军医大学出版社,2005:95.
[13]黎君友,王会信,付小兵,等.创伤修复的生化及代谢.现代创伤修复学[M].北京:人民军医出版社,1999:20.
[14]Nauta AC,Grova M,Montoro DT,et al.Evidence that mast cell are not required for healing of splinted cutaneous excisional wound in mice[J].PLoS One,2013,8(3):e59167.
[15]刘钰,沈冲,孟琴.体外构建3D人工皮肤[J].中国组织工程研究,2016,20(46):6915-6921.
Effect of Dragon’s Blood for External Use on Ischemic Ulcer Wound Healing of Rabbit Ears
LI Dan1,HUI Rui2,HAN Yan1
(1.Department of Plastic and Reconstructive Surgery,Chinese People’s Liberation Army General Hospital, Beijing 100853,China;2.Department of Neurosurgery,Navy General Hospital,Beijing 100048,China)
Objective To study the effects of Dragon’s blood on ischemic ulcer wound healing of rabbit ears in vivo.MethodsDragon’s blood was diluted into A1(0.3mg/ml), A2(3mg/ml), A3(30mg/ml), A4(100mg/ml) by vanesline, while the vaseline was used as control group. We used the different ointment in ischemic ulcer of rabbit ears. The photos and microscopic observation were carried out at 3,6,9,12,15 days post operation. Picrosirius-polarization method was used to observe the ratio of tape Ⅰ collagen/tape Ⅲ collagen at 6,15 days post operation. Results The wound healing speed of group A2(13.1±1.7)d、A3(12.3±0.9)dwere faster than that of control A5(15.7±0.9)d,the difference was signif l cant (P<0.01). From 3rdto 12thdays post operation, Sheal of A3 were signiflcantly higher than control(P<0.011), Vgranulation of A3 were higher than control(P<0.01).The ratio of tapeⅠcollagen/tape Ⅲ collagen in group A3 2.23/1 was higher than the control 1.44/1 at 6thday post operation(P<0.01),there was no difference between Dragon’s blood group and control at 15thday (P>0.05). Conclusion Dragon’s blood can improve the healing speed and quality of rabbit ear ischemic ulcer.
Dragon’s blood;wound healing;ischemic ulcer of rabbit ears
R285.5
A
1008-6455(2017)04-0056-05
2017-01-18
2017-04-06
编辑/张惠娟
韩岩,中国人民解放军总医院整形修复科,主任医师,教授;E-mail:13720086335@163.com

