HCV感染引起Hsp72的过度表达Hsp72在感染HCV肝癌细胞增殖中的作用
王 曦, 周 巍, 陈 林
(1.上海市食品药品检验所, 上海 2012032.上海五色石医学研究有限公司, 上海 2012033.上海基康生物技术有限公司, 上海 201203)
基础医学
HCV感染引起Hsp72的过度表达Hsp72在感染HCV肝癌细胞增殖中的作用
王 曦1, 周 巍2, 陈 林3
(1.上海市食品药品检验所, 上海 2012032.上海五色石医学研究有限公司, 上海 2012033.上海基康生物技术有限公司, 上海 201203)
目的:评价感染丙型肝炎病毒(HCV)后热激蛋白72(Hsp72)的表达和其在肝癌细胞的增殖和生长过程中的作用。方法:选取感染基因型为1a/1b的HCV慢性肝炎患者32例,HBV和HCV检测为阳性患者20例,感染慢性肝炎病毒C的患者8例和未感染HBV、HCV或者HIV的肝转移瘤作为对照组肝3例,活组织检查样本来自感染慢性HCV的患者,通过ELISA、定量PCR和免疫组化的方法分析Hsp72的表达。运用培养感染HCV/JFH1的肝细胞,通过siRNA和细胞增值的方法来评价Hsp72过度表达对肝癌细胞增殖的作用。结果:①感染HCV后,细胞内的Hsp72蛋白表达显著上调。②HCV通过诱导NFAT5增加Hsp72的表达。③感染HCV后,Hsp72能促进人肝癌细胞的增殖。④MEK抑制剂PD98095可以抑制Hsp72对MAPK/MEK活化和细胞增殖。结论:Hsp72在HCV感染的HCC中过度表达通过激活MEK/ERk1/2而促进细胞增殖。应该重视Hsp72在治疗HCV感染的HCC患者中的作用及其重要性。
肝炎病毒C; 热激蛋白72; 肝癌细胞; 增 殖
肝炎病毒C(HCV)通常可以持续感染患者而引起慢性肝炎,慢性间质性肝炎和肝癌是全球性的健康问题。然而,HCV引起肝细胞致癌的详细机制和病毒感染肿瘤的过程依然不清楚。热激蛋白(Hsp)家族是细胞内高度保守的蛋白质分子,是细胞凋亡和蛋白平衡过程中主要的分子伴侣和生化调节剂[1]。HSPs广泛的在人类肿瘤包括乳腺癌、卵巢癌、结肠癌、肺癌和前列腺癌中过量表达[2]。研究显示,Hsp72在肿瘤组织中表达强烈,并可作为检测肿瘤的生物标志物,尤其是肝癌[3~7]。体外研究揭示,HCV编码的蛋白和Hsp72相互作用能增加HCV扰乱细胞增殖或者损害DNA损伤后细胞的反应[8,9]。本研究中,我们检测了经病毒感染后的细胞系和HCV感染的肝活组织检查样本中的Hsp72的表达,研究Hsp72对感染HCV的肝癌细胞系的生长和增殖的影响,并阐明其可能的机制。
1 材料和方法
1.1 患者材料及检测指标
1.1.1 肝炎患者材料:本实验使用的血清样本来32例感染基因型为1a/1b的HCV慢性肝炎患者。这些患者均未接受过化疗。另外20例血样样本来自上海长征医院的志愿者,并且HCV检测为阳性。肝脏样本来自福州军区总医院2010年至2013年间接受过肝脏活组织检查的感染慢性肝炎病毒C的患者(n=8)。未感染HBV、HCV或者HIV的肝转移瘤作为对照组(n=3)。临床和病理检查结果信息来自患者体格检查和病理报告(表1)。所有研究均获得患者同意并且签字。正常肝组织样本取自有转移肿瘤肝叶周围的正常组织。实验方案由长征医院和福州军区总医院伦理委员会批准。
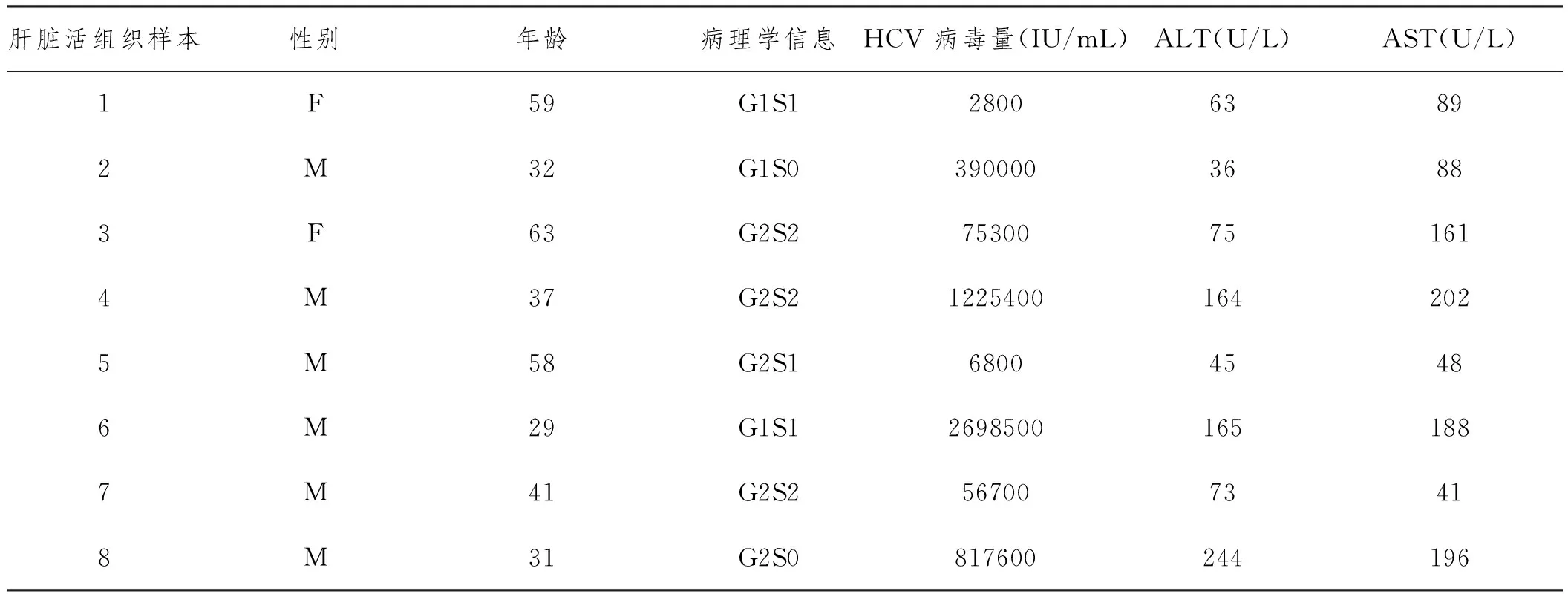
表1 感染HCV患者临床和病毒学参数
注:M,男性;F,女性。正常范围:ALT,5-50U/L;AST,8-40U/L
1.1.2 检测指标及方法:用免疫吸收剂分析试剂盒(ELISA)(Xinfan Biotechnology, 上海)检测HCV感染患者血清中Hsp72的表达。用多克隆抗体对Hsp72进行免疫组织化学染色。肝组织片段切成4μm厚度,用浓度递减的乙醇进行脱水。微波加热20min回收10nM柠檬酸钠缓冲液(pH 6.0)中的抗原。组织片段用3%过氧化氢孵化阻断内源性过氧化酶的活性,然后用1%BSA/PBS稀释的一抗孵化。一抗孵化后,使用生物素标记的二抗孵育,接着用ABC(抗生物素-生物素-过氧化酶复合物技术)方法进行检测。
1.2 细胞系及检测指标
1.2.1 细胞系:Huh7.5.1是Huh7细胞HCV高感染的亚克隆细胞系,培养条件为:含10%胎牛血清(Invitrogen,Carlsbad,CA,USA)的DMEM培养基,在37℃,5% CO2的培养箱下培养。
1.2.2 检测指标及方法
1.2.2.1 Huh7.5.1细胞感染:感染HCV的Huh7细胞(HCVcc)培养过程参照先前研究描述[10]。将含有全长嵌合基因组cDNA的HCV J6和JFH1的pFLJ6/JFH1质粒线性化,并作为模板用MEGAscript试剂盒(Promega)体外进行转录。用电穿孔的方法将体外转录的RNA转到Huh7.5.1细胞中。通过收集转染后8和18d的上清获取病毒并且分装保存在-80℃。参照先前研究中免疫染色的方法检测Huh7.5.1细胞中的病毒滴度。Huh7.5.1细胞种植到24-孔板中,过夜培养,每孔加入50μL 5×105ffu/mL 的HCVcc上清,培养5h后除去上清,并用培养基清洗5次,最后用新鲜培养基继续培养。siRNA处理组,经HCVcc感染后第1天,细胞中分别加入20 nM目标siRNA和阳性对照siRNA进行细胞转染。
1.2.2.2 siRNA的准备和转染:Hsp72siRNA,NFAT5 siRNA和阳性对照siRNA (si NC )购自Santa Cluz 生物技术 (Santa Cruz, CA, USA)。用FUGeneHD转染试剂(Roche, Indianapolis, IN, USA)按照说明书进行转染。
1.2.2.3 实时定量PCR:用Trizol 试剂(Invitrogen, Carlsbad, CA, USA)按照说明书操作分离得到总RNA。PCR得到RNA质量的最低要求为A260 nm/A280 nm比值为1.9,28S/18S 比值为1.8。将2 μg总RNA用SuperScript Ⅲ 第一链合成系统带有特异性反向引物或者Oligo (dT) (Invitrogen)进行反转录。用SYBR RT-PCR试剂盒 (Takara, Shiga, Japan)进行扩增。在96孔板中95℃孵育反应5 min,接着95℃15 s 和 60℃1 min循环40次。在StepOne Plus 实时定量PCR仪 (Applied Biosystems, Foster City, CA, USA)中进行PCR反应,用SDS v2.3软件收集数据。β-actin作为内标。
1.2.2.4 Western蛋白印迹:在蛋白酶抑制剂cocktail (Complete mini, Roche)中加入含0.5%SDS的改良缓冲液用于提取Huh7.5.1细胞蛋白,将25mg细胞蛋白加入SDS-PAGE凝胶中进行电泳,转移到PVDF膜上。用5%非脂牛奶进行封闭,将膜放入一抗中4℃条件下过夜孵育,然后用HRP-偶联羊抗兔或者羊抗鼠抗体 (1:10000 稀释, KPL, Gaithersburg, MA,USA)室温孵育1h。最后用Super Signal West Pico 化学发光底物 (Pierce)激发信号,在Gene Gnome HR 图像扑捉系统 (Syngene, Frederick, MD, USA)进行观察, Gene tools (Syngene) 进行分析。一抗是:Hsp72, NFAT5, HSF1, RAF, phosphor-RAF(p-RAF), MEK, p-MEK, ERK1/2 和 p-ERK1/2 多克隆抗体 (Abcam, MA) 和 β-actin 单克隆抗体 (ImmunoGen, 上海,中国)。
1.2.2.5 细胞增殖分析:siRNA在6-孔板中转染细胞24h后,细胞重悬并接种到96-孔板,每孔1×104个,然后每孔加入10 μL 5mg/mL的MTT,37℃培养4 h后除去培养基,每孔加入100 μL DMSO,孵育10min,用微板阅读仪(Model 550, Bio-Rad, Richmond, CA)读取每孔细胞的吸光率。用重组Hsp72(Sigma)评价Hsp72对细胞增殖的影响和相关是信号通路。PD98095(Sigma)是MAP激活酶选择抑制剂,用于抑制MEK/ERK信号通路。细胞用20μM PD98095预处理,然后用5μg/mL rHsp72孵育。
1.2.2.6 伤口愈合分析:将感染HCV J6/JFH1的Huh7.5.1 细胞接种到6-孔板中(2×105/孔)培养2d。确认细胞铺满板底后,用塑料片在培养板上划痕,立刻清洗掉残渣,显微镜下观察并拍照。然后37℃培养48 h,观察细胞并显微镜下拍照[11]并计算细胞运动的距离。伤口愈合计算方法:(划痕宽度的平均值-剩下宽度的平均值)/划痕宽度的平均值
1.2.2.7 细胞周期分析:处理48h后,用胰酶消化细胞后,每组收集2×106细胞用PBS洗2次,用冷70%乙醇在4℃下过夜固定。然后用PBS清洗细胞一次,用200μL RNase (1 mg/mL) 37℃消化30 min,在用800 μL碘化丙啶(50 μg/mL)室温下染色30min,最后用EPICS Elite ESP 流式细胞仪(USA)分析细胞周期。
2 结 果
2.1 HCV感染上调Hsp72的表达:为了评价HCV感染后对Hsp72的表达作用,我们用ELISA的方法评价了32例来自临床慢性HCV感染患者血清中的Hsp72水平。20例健康患者血清作为对照用于比较。与正常相比,患者血清中Hsp72水平显著增加(图1-a)。实时定量PCR分析感染HCV的肝组织活检样本中Hsp72mRNA水平。8例中有5例肝组织活检样本Hsp72mRNA水平(>3倍)显著高于正常肝组织(图1-b),用柱形图(图1-c)比较对照组和HCV感染组肝组织活检样本中mRNA表达水平的平均值进一步证明与前面结果一致。接下来,我们用免疫组化染色评价HCV感染后Hsp72的表达情况。8例患者有6例患者肝细胞中发现Hsp72聚集,而对照组肝脏中只检测到一点。在HCV感染患者的肝脏中,Hsp72定位主要在肝血窦和分散在肝叶的单个肝细胞细胞质里(图1-d)。
为了证明Hsp72上调是否与HCV感染有关,对感染HCVcc J6/JFH1的细胞系Huh7.5.1中Hsp72的表达进行评价。收集不同时间点感染HCVcc的Huh7.5.1细胞,用实时定量PCR检测Hsp72 的表达。在感染24h后Hsp72 的表达稳定增加(图1-e)。相反,没有感染组的Hsp72表达在整个实验过程中没有显著的变化(数据没有列)。Western蛋白印记法分析结果同样表明,Huh7.5.1感染HCVcc后每个时间点的Hsp72均过量表达(图1-f)。以上结果表明,HCV感染能上调Hsp72的表达。
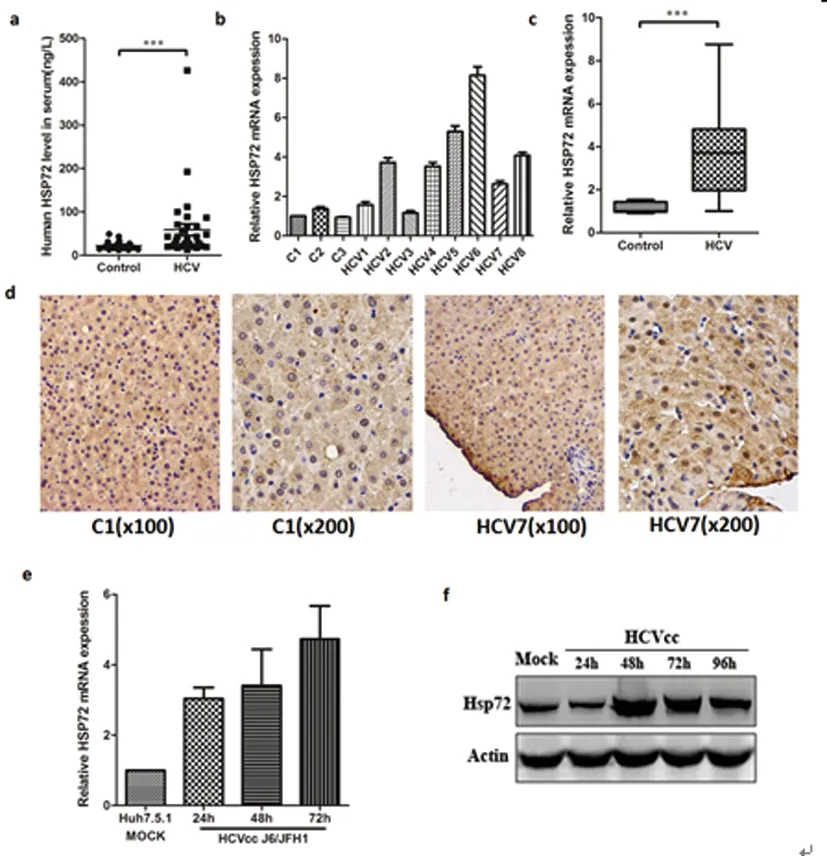
图1 HCV感染上调Hsp72表达
(a) 比较感染HCV患者血清 (n=32) 与正常血清 (n=20) 中总Hsp72 的表达情况。 (b和c) 用实时定量PCR的方法比较感染HVC肝脏活组织检查样本与未感染HCV对照肝脏组织样本 (C1-3) 中Hsp72 mRNA 表达情况。(d) 感染HCVcc J6/JFH1的Huh7.5.1细胞Hsp72免疫组化染色结果。(e) 感染HCVcc J6/JFH1 的Huh7.5.1细胞中Hsp72 mRNA 表达情况。(f) 感染HCVcc J6/JFH1的Huh7.5.1细胞中Hsp72蛋白表达情况。***P<0.001
2.2 HCV通过诱导NFAT5增加Hsp72 的表达:Hsp72的表达的是由HSF1和NFAT5转录因子调控[12]。为了调查这两个因子是否参与HCV感染增加Hsp72 的表达,我们分析了感染HCVcc的肝癌细胞中NFAT5和HSF1蛋白表达水平。我们发现NFAT5水平增加,而HSF1总蛋白水平却没有改变(图2-a),并且NFAT5mRNA的水平也显著增加(图2-b)。为了进一步证明在NFAT5依赖转录激活中Hsp72水平是否由HCV的调控,对模拟感染和HCVcc感染的细胞转染抗NFAT5 siRNA敲出内源性NFAT5。NFAT5沉默后,不但NFAT5mRAN的水平减少而且Hsp72mRNA的水平也减少图 (2-c) 。同时HCVcc感染细胞中Hsp72 蛋白水平上调也在NFAT5沉默后降低(图2-d),这说明,HCV感染后通过诱导NFAT5上调Hsp72的表达。
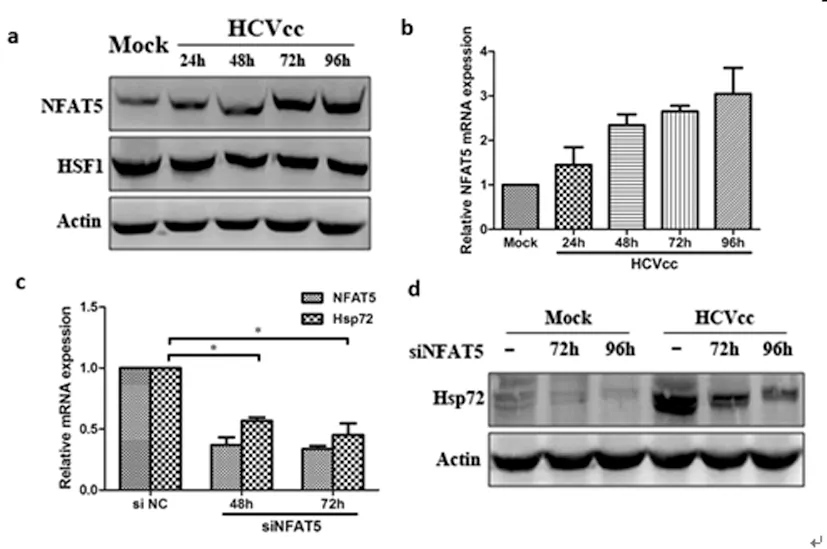
图2 HCV通过诱导NFAT5增加Hsp72表达水平
(a) Western blot 分析感染HCVcc的Huh7.5.1细胞溶解物中NFAT5 和HSF1 的表达情况。(b) NFAT5 mRNA 表达情况。 (c) NFAT5 siRNA下调NFAT5和Hsp72 mRNA 的表达。 (d) Huh7.5.1转染NFAT5 siRNA后Hsp72蛋白表达情况。 *P<0.05
2.3 Hsp72沉默抑制HCV感染人肝癌细胞的增殖:Hsp72涉及肿瘤发生并可能通过各种致瘤产物相互作用介导致瘤性蛋白的形成,最后促进肿瘤细胞生长和增殖。用细胞增殖来评价感染HCV的HCC中Hsp72过量表达的意义。细胞层伤口愈合实验表明,HCVcc感染细胞敲出Hsp72后伤口愈合的恢复比转染对照siRNA的细胞慢(图3-a、b)。此外,用MTT评价细胞增殖情况。经Hsp siRNA敲出Hsp72后,细胞增殖显著降低(图3-c)。接着,考察Hsp72过量表达对细胞周期的影响。如表3-c所示,Hsp72显著抑制G1/S期。流式细胞检测结果显示,G2和S期细胞百分比降低,G0/G1期细胞百分比增加。而这些发现在对照中却没有出现。

图3 Hsp72 沉默抑制感染HCV的Huh7.5.1细胞增殖并且是细胞周期阻滞在S期
(a) 转染48h后荧光显微镜下观察EDU标记的复制细胞。(b)EDU阳性细胞百分比。(c)转染48h后流式细胞仪检测细胞周期分别情况。(d)细胞周期结果图谱。*P<0.05,**P<0.001
2.4 Hsp72通过激活MEK/ERK信号通路诱导HCV感染肝癌细胞增殖:为了确定Hsp72诱导了哪条信号通路而促进细胞增殖,HCV感染的肝癌细胞转染Hsp72 siRAN或者siNC后,检测细胞蛋白中RAF, MEK, phosphor-MEK (p-MEK), ERK1/2 和 p-ERK1/2的表达。结果表明RHsp72显著诱导细胞增值和p-MEK的表达(图4-a、b),Hsp72敲除后显著下调p-MEK和p-MEK1/2的表达(图4-a)。通过在细胞中加入MEK抑制剂PD98095来研究MEK/ERK1/2通路参与的过程。PD98095能显著减少rHsp72诱导的HCV感染后Huh7.5.1细胞的增加(图4-c)。这些结果说明MEK/ERK1/2信号通路介导Hsp72诱导HCV感染后的肝癌细胞增殖。
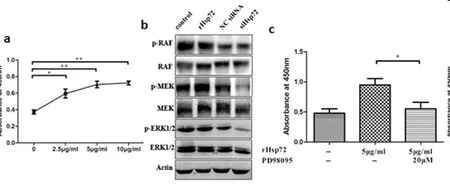
图4 MEK/ERK信号通路参与Hsp72诱导的细胞增殖。
(a)处理24h后CK8分析不同剂量rHSP72对细胞增殖的影响。(b)处理60h后RAF,MEK,ERK1/2蛋白表达水平和其磷酸化形式(对照,5μg/mL rHsp72,阳性对照siRNA和20nM Hsp72 siRNA)。(c)细胞经5μg/mL rHsp72 或者20μM MEK 抑制剂(PD98095)孵育24h后 CCK8 分析表明,Hsp72诱导细胞增值是由MEK/ERK1/2信号通路介导的。。*P<0.05, ** P<0.01
3 讨 论
热激蛋白能防止蛋白经过热激或者其他刺激后变性[13]。HCV感染能引起细胞应答包括应激反应蛋白如Hsp72。本研究发现,慢性感染HCV患者的血清及肝活组织检查样本中Hsp72均显著增加。同时,对感染HCV的肝细胞进行培养后发现细胞中Hsp72的表达也显著增加。Hsp72的表达是受两种不同的转录因子HSF1和NFAT5调控。我们发现HSF1蛋白水平不受HCV感染的影响。然而,NFAT5蛋白水平和mRNA水平却显著增加。将NFAT5沉默后,Hsp72表达水平显著降低。结果说明,经HVC感染后,Hsp72上调是受NFAT5诱导介导的。
众所周知Hsp72是细胞内分子伴侣,协助细胞中蛋白折叠特别是在应激的时候[14]。在对应激和损伤应答时,Hsp72可能会从已经溶解的细胞和通过受体介导胞吐作用从肝脏细胞中释放出来[15]。很多体内外研究已经证明细胞外Hsp72可能担任应激应答的调节子[16-19]。一些研究认为,Hsp72涉及到肿瘤的发生,并且可能与一些致瘤产物(c-myc,p53,scr,c-fos,Rb)相互作用而调节致瘤蛋白的构成,最后促进肿瘤细胞生长和增殖[20-23]。另外,Hsp72被证明能是大量刺激引起凋亡的蛋白抑制剂[24]。癌组织细胞中大量表达Hsp72可能会使细胞抵抗环境应激而提高活性。
本研究证明,感染HCV后Hsp72过度表达能促进肝癌细胞增殖。将Hsp72沉默后,HCV感染的Huh7.5.1细胞增殖显著被抑制,G0/G1期细胞数量也显著增加,G2期和S-期细胞数量显著降低。细胞周期在调节肿瘤细胞生长和凋亡中起着重要的作用。目前研究[25]已经提出,HSPs可能通过与某些原癌基因产物结合参与细胞生成和增殖从而调节一些如信号转导或者细胞周期的进程。Hsp72是细胞进入S期的必需蛋白。本实验结果显示,Hsp72沉默诱导HCV感染的Huh7.5.1细胞滞留在G0/G1期,从而不能进入S期。这些结果证明,Hsp72和HCV-HCC之间的功能和机制关系,强调Hsp72在HCV-HCC分子病因方面对恶性增殖调控的重要作用。
Hsp72在保护细胞免受损失调节的各种靶点包括Bax,细胞色素C释放,磷脂酶A2抑制剂和p38/MAPK与细胞增殖有关[26]。本实验结果表明,MEK/ERK1/2信号通路参与Hsp72诱导HCV感染后的肝癌细胞的增殖。Hsp72敲出后,p-MEK和P-ERK1/2表达水平显著下调。加入抑制剂PN98095后,rHSp72诱导的经HCVcc感染的Huh7.5.1细胞增殖也减少。总之,本实验结果证明,Hsp72通过MEK/ERK信号通路促进HCV感染的肝癌细胞增殖。然而,我们也应该考虑HCV对MEK/ERK信号通路的直接影响。我们之前的报告提出,HCV蛋白能通过沿着信号通路的多个步骤介导MAPK(ERK)信号。说明,HCV E2蛋白激活MAPK(ERK)通路促进人肝癌细胞Huh7细胞增殖。最近研究提出,Hsp72可能直接通过磷酸化作用激活MEK/ERK1/2。我们之前的报告没有描述上游刺激因子表达,也有可能HCV蛋白通过激活各种刺激因子调节MAPK(ERK)通路,包括Hsp72。正如该研究报告,我们进一步阐明了Hsp72参与MEK/ERK1/2信号通路,并且促进HCV感染的肝癌细胞增殖。
综上所述,最近研究结果证明,Hsp72在HCV感染的肝癌细胞中过度表达可以通过激活MEK和Erk1/2促进细胞增殖。Hsp72过度表达的结果对感染HCV的HCC患者的治疗有负影响。Hsp72过度表达可以作为治疗感染HCV的HCC患者的潜在靶标,以后的研究将研究该可能性。
[1] Morimoto RI. Cells in stress: transcriptional activation of heat shock genes[J].Science,1993,259: 1409~1410.
[2] Ciocca DR, Calderwood SK. Heat shock proteins in cancers: diagnostic, prognostic, predictive, and treatment implications[J].Cell Stress Chaperones,2005,10: 86~103.
[3] Zhang L, Fok JJ, Mirabella F, et al. Hsp70 inhibition induces myeloma cell death via the intracellular accumulation of immunoglobulin and the generation of proteotoxic stress[J].Cancer Lett,2013,339: 49~59.
[4] Wang XP, Wang QX, Lin HP, et al.Significance of clinicopathology and expression of heat shock protein 72 and glycoprotein 96 in human hepatocellular carcinomas[J].Afr Microbiol Res,2011,5:5607~5614.
[5] Romanucci M, D'Amato G, Malatesta D, et al.Heat shock protein expression in canine osteosarcoma[J].Cell Stress Chaperones,2012,17:131~138.
[6] Szondy K, Rusai K, Szabó AJ, et al.Tumor cell expression of heat shock protein (HSP) 72 is influenced by HSP72 [HSPA1B A(1267)G] polymorphism and predicts survival in small Cell lung cancer (SCLC) patients[J].Cancer Invest,2012,30: 317~322.
[7] Aghdassi A, Phillips P, Dudeja V, et al.Heat shock protein 70 increases tumorigenicity and inhibits apoptosis in pancreatic adenocarcinoma[J].Cancer Res,2007,67: 616~625.
[8] Chen YJ, Chen YH, Chow LP, et al.Heat shock protein 72 is associated with the hepatitis C virus replicase complex and enhances viral RNA replication[J].Biol Chem,2010,285: 28183~2890.
[9] Lim YS, Shin KS, Oh SH, et al.Nonstructural 5A protein of hepatitis C virus regulates heat shock protein 72 for its own propagation[J].Viral Hepat,2012,19: 353~363.
[10] Lindenbach BD, Evans MJ, Syder AJ, et al.Complete replication of hepatitis C virus in cell culture[J].Science,2005,309:623~266.
[11] Ohta H, Hamada J, Tada M, et al.HOXD3-overexpression increases integrin alpha v beta 3 expression and deprives E-cadherin while it enhances cell motility in A549 cells[J].Clin Exp Metastasis,2006,23: 381~390.
[12] Woo SK, Lee SD, Na KY, et al.TonEBP/NFAT5 stimulates transcription of HSP70 in response to hypertonicity[J].moL Cell Biol,2002,22: 5753~5760.
[13] Bukau B, Weissman J, Horwich A. moLecular chaperones and protein quality control[J].Cell,2006,125:443~451.
[14] Shiber A, Ravid T. Chaperoning Proteins for Destruction: Diverse Roles of Hsp70 Chaperones and their Co-Chaperones in Targeting Misfolded Proteins to the Proteasome[J].BiomoLecules,2014,4: 704~724.
[15] Asea A. Mechanisms of HSP72 release[J].Bio sci,2007,32: 579~584.
[16] Luo X, Tao L, Lin P, et al.Extracellular heat shock protein 72 protects schwann cells from hydrogen peroxide-induced apoptosis[J].Neurosci Res,2012,90: 1261~1269.
[17] Krause M, Keane K, Rodrigues-Krause J, et al.Elevated levels of extracellular heat-shock protein 72 (eHSP72) are positively correlated with insulin resistance in vivo and cause pancreatic β-cell dysfunction and death in vitro[J].Clin Sci (Lond),2014,126: 739~752.
[18] Ogawa K, Kim HK, Shimizu T, et al.Plasma heat shock protein 72 as a biomarker of sarcopenia in elderly people[J].Cell Stress Chaperones,2012,17: 349~359.
[19] Luo X, Zuo X, Mo X, et al.Treatment with recombinant Hsp72 suppresses collagen-induced arthritis in mice[J].Inflammation,2011,34: 432~439.
[20] Meng L, Hunt C, Yaglom JA, et al.Heat shock protein Hsp72 plays an essential role in Her2-induced mammary tumorigenesis[J].Oncogene,2011,30: 2836~2845.
[21] Bonvini P, Zorzi E, Mussolin L, et al.Consequences of heat shock protein 72 (Hsp72) expression and activity on stress-induced apoptosis in CD30+ NPM-ALK+ anaplastic large-cell lymphomas[J].Leukemia,2012,26: 1375~1382
[22] Isomoto H, Oka M, Yano Y, et al.Expression of heat shock protein (Hsp) 70 and Hsp 40 in gastric cancer[J].Cancer Lett,200,198:219~228.
[23] Thanner F, Sütterlin MW, Kapp M, et al.Heat-shock protein 70 as a prognostic marker in node-negative breast cancer[J].Anticancer Res,2003,23:1057~1062.
[24] Cheng L, Smith DJ, Anderson RL, et al.Modulation of cellular Hsp72 levels in undifferentiated and neuron-like SH-SY5Y cells determines resistance to staurosporine-induced apoptosis[J].PLoS One,2011,6: e24473.
[25] Nyman U, Muppani NR, Zhivotovsky B, et al.Hsp72 mediates TAp73α anti-apoptotic effects in small cell lung carcinoma cells[J].Cell moL Med,2011,15: 1757~1768.
[26] Asea A. Stress proteins and initiation of immune response: chaperokine activity of hsp72[J].Exerc Immunol Rev,2005,11: 34~45.
Over-expression of Hsp72 Induced by Hepatitis C virus: Role of Hsp72 in Proliferation of Hepatocellular Carcinoma with HCV Infection
WANGXi,etal
(InstituteforFoodandDrugControlinShanghai,Shanghai201203,China)
Objective:To investigate the expression of Heat shock protein 72(Hsp72) in HCV infection and its role on the growth and proliferation of hepatocellular carcinoma cells with hepatitis C virus (HCV) infection. Methods: Sera and liver biopsy specimens from patients chronically infected with HCV were obtained for analysis of Hsp72 expression by ELISA, quantitative PCR and immunohistochemical staining. Hepatocytes upon infection with cell culture-grown HCV J6/JFH1 were used to investigate the role of over-expressed Hsp72 in proliferation of hepatocellular carcinoma cell with HCV infection by siRNA and cell proliferation assays. Results: Hsp72 expression was significantly upregulated in HCV infection. HCV increases Hsp72 expression level via induction of NFAT5. Hsp72 promotes proliferation of human hepatocellular carcinoma cells with HCV infection. The MAPK/MEK activation and cell proliferation driven by Hsp72 were suppressed by MEK inhibitor PD98095. Conclusions: The over-expressed of Hsp72 in HCV related HCC contributes to cell proliferation by activating MEK/Erk1/2. The role of Hsp72 and its importance for elimination of HCV in patients with HCC needs to take into account.
Hepatitis virus C; Heat shock protein 72; Hepatocellular carcinoma; Proliferation
1006-6233(2017)04-0645-06
上海市2015年度“科技创新行动计划”生物医药领域产学研医合作项目,(编号:15DZ1940700)
A 【doi】10.3969/j.issn.1006-6233.2017.04.034

