补骨脂煎剂对2型糖尿病大鼠骨折愈合过程中Wnt/PPARγ信号通路影响研究
曹大宁, 阳春华, 李 聪
(湖南省长沙市第一医院骨科, 湖南 长沙 410000)
补骨脂煎剂对2型糖尿病大鼠骨折愈合过程中Wnt/PPARγ信号通路影响研究
曹大宁, 阳春华, 李 聪
(湖南省长沙市第一医院骨科, 湖南 长沙 410000)
目的:探讨补骨脂煎剂对2型糖尿病大鼠骨折愈合过程中Wnt/PPARγ信号通路的影响。方法:选取健康雄性SD大鼠72只,随机分为对照组、模型组、氟化钠组以及补骨脂组,各18只。对照组建立胫骨骨折模型,其余各组采用链脲佐菌素腹腔注射建立2型糖尿病胫骨骨折模型,并给予相应的药物治疗。对大鼠胫骨BMD、FPG及血清Ca、P、ALP水平、胫骨弯曲强度和扭矩、骨组织β-catenin、p-GSK3β、PPARγ蛋白表达水平进行检测。结果:治疗后,与模型组比较,各组大鼠胫骨BMD水平较高,且补骨脂组>氟化钠组(P<0.05);各组大鼠血清Ca、P水平较低,且补骨脂组<氟化钠组(P<0.05),各组大鼠血清ALP水平较高,且补骨脂组>氟化钠组(P<0.05);各组大鼠胫骨弯曲强度和扭矩水平较高,且补骨脂组>氟化钠组(P<0.05);各组大鼠骨组织β-catenin蛋白表达水平较高,且补骨脂组>氟化钠组(P<0.05),各组大鼠骨组织p-GSK3β蛋白表达水平较低,且补骨脂组<氟化钠组(P<0.05);各组大鼠骨组织PPARγ蛋白表达水平较低,且补骨脂组<氟化钠组(P<0.05)。结论:补骨脂煎剂能够明显提高2型糖尿病骨折大鼠BMD、血清ALP水平,降低血清Ca、P水平,提高骨的生物力学强度,加速骨折愈合,可能与上调β-catenin蛋白表达,下调p-GSK3β、PPARγ蛋白表达,激活Wnt信号通路、抑制PPARγ信号通路有关。
补骨脂煎剂; 2型糖尿病; 大 鼠; 骨折愈合; Wnt/PPARγ信号通路
骨折愈合是骨骼重生及其原始连续性重建的复杂修复过程[1],涉及成骨细胞、破骨细胞、骨细胞、间充质干细胞等多种细胞,同时受到年龄、内分泌因素、营养状况、某些疾病、骨代谢调节因子、骨折局部损伤程度、血供等多种因素的影响[2]。资料显示,由于各种原因导致骨折不愈合的发生率为2.5%~4.4%[3],对患者生活质量和健康造成严重影响。2型糖尿病(T2DM)是以高血糖为特征的慢性全身代谢性疾病,近年来在我国的发病率逐年升高。T2DM除存在糖、脂肪、蛋白质代谢紊乱之外,也对骨代谢产生不良影响,是导致骨折风险增加和骨折不愈合的重要原因之一[4]。目前,针对T2DM骨折不愈合尚无特效疗法,控制血糖、手术、生物刺激、物理治疗等常规治疗方法的治愈率也较低。补骨脂是骨科临床常用的中药,具有补肾壮阳、补脾健胃之效,研究认为,其能够影响成骨细胞及间充质干细胞的增殖,对于骨代谢、骨质疏松有良好的治疗作用[5],但对于T2DM骨折的治疗研究较少。本研究主要探讨补骨脂煎剂对2型糖尿病大鼠骨折愈合过程中Wnt/PPARγ信号通路的影响。
1 资料与方法
1.1 材 料
1.1.1 研究对象:选取周龄为8周的健康清洁雄性SD大鼠72只,购自上海泽生科技开发有限公司,动物许可证号:SYXK(沪)2015-0003,体重240-300g,平均体重(264.74±14.28)g。将大鼠单笼饲养,饲以普通标准饲料及消毒自来水,大鼠活动与进食自由,实验室环境安静、通风、阳光充足,温度22℃左右,湿度保持在50%-70%,每周两次更换垫料。
1.1.2 主要药品与试剂:补骨脂,由辽宁省中医院药房,加水浸泡、煎煮、过滤、浓缩,制成浓度为1g/mL的水煎剂备用;氟化钠,纯度:>99%,货号:7681-49-4,美国USP公司产品,加生理盐水溶液制成浓度为2mg/mL的溶液;柠檬酸—柠檬酸钠缓冲液(1moL/L,pH4.5),货号:JD-7001,上海晶都生物技术有限公司;链脲佐菌素(STZ),纯度:≥99.0%,CAS号:18883-66-4,美国Sigma公司产品,加高温消毒后的柠檬酸-柠檬酸钠缓冲液配置成浓度为1%,PH为4.5的溶液,即用即配;10%水合氯醛溶液,江莱生物科技有限公司;钙(Ca)测定试剂盒(邻甲酚酞络合酮比色法)、磷(P)测定试剂盒(磷钼酸盐法)、碱性磷酸酶(ALP)测定试剂盒(对硝本苯磷酸二钠法),购自宁波博泰生物技术有限公司;兔抗β连环蛋白(β-Catenin)抗体、兔磷酸化糖原合酶激酶3β(p-GSK3β)抗体、兔过氧化酶活化增生受体γ抗体(PPAR-γ)、β-Actin抗体,北京柏奥莱博科技有限公司;Western及IP细胞裂解液(P0013)、Bradford蛋白浓度测定试剂盒、辣根过氧化物酶(HRP)标记山羊抗兔IgG,碧云天生物技术研究所;ECL显色试剂盒。
1.1.3 主要仪器设备:XR-46 双能X线骨密度仪,美国NORLAND公司产品;ACCU-CHEK Performa血糖仪及试纸,瑞士罗氏公司(Roche);ALLEGRA X-12离心机、AU680自动生化分析仪,美国贝克曼(Beckman)公司;CUT6062全自动石蜡切片机,德国SLEE公司产品;QX-W200生物力学测试仪,上海企想检测仪器有限公司产品;ChemiDoc XRS化学发光成像系统,美国伯乐BIO-RAD公司; Q550CW图象采集和分析系统,德国LEICA公司产品。
1.2 方 法
1.2.1 造模及实验方法[6]:适应性饲养1周后,从72只大鼠中随机抽取18只作为对照组,给予1.0moL/L柠檬酸-柠檬酸钠缓冲液50mg/kg腹腔注射,其余54只建立糖尿病模型,首先禁食24h,给予1%STZ溶液50mg/kg一次性腹腔注射,,继续饲养,2周后,取除对照组外所有大鼠的空腹尾静脉血,检测空腹血糖(FPG)≥7.0mmoL/L即为2型糖尿病模型建立成功,此次所有大鼠造模成功;成模后,采用随机数字表法将大鼠简单随机分为模型组、氟化钠组以及补骨脂组,每组18只。各组大鼠均给予10%水合氯醛3mL/kg腹腔注射进行麻醉,固定于手术架上,左下肢胫骨部常规备皮、消毒、铺巾,逐层切开皮肤、分离肌肉,显露左胫骨,采用线锯锯断左胫骨上段,造成骨折,冲洗、缝合伤口,外用复位夹板固定,建立大鼠骨折模型;术后第2d,氟化钠组给予2mg/mL氟化钠溶液10mL/kg,1次/d灌胃;补骨脂组给予1g/mL的补骨脂煎剂10mL/kg,1次/d灌胃;模型组及对照组分别给予等量生理盐水,1次/d灌胃;两组大鼠连续给药6周。
1.2.2 骨密度测定:最后一次给药后,禁食12h,给予10%水合氯醛3mL/kg腹腔注射麻醉大鼠,将大鼠仰卧固定于检查台,采用双能X线骨密度仪检测各组大鼠胫骨的骨密度值(BMD)。
1.2.3 标本采集:骨密度检测结束后,切开颈部,自颈总动脉采血,首先测量血糖,然后将采集的血液静置4h,离心机3000r/min离心10min,分离血清,置于-80℃冰箱保存备用;处死大鼠,切开皮肤及肌肉组织,完整取出大鼠左侧胫骨干,进行生物力学强度检测,之后取骨折断端组织,置于-80℃冰箱保存,用于Western blot及RT-PCR检测。
1.2.4 血液指标检测:采用血糖仪检测各组大鼠FPG水平,采用AU680自动生化分析仪,按照钙(Ca)测定试剂盒(邻甲酚酞络合酮比色法)、磷(P)测定试剂盒(磷钼酸盐法)、碱性磷酸酶(ALP)测定试剂盒(对硝本苯磷酸二钠法)说明书进行操作。测定血清Ca、P、ALP水平。
1.2.5 生物力学强度测定:取大鼠左侧胫骨干,清理后生理盐水浸透,将其两端固定,采用QX-W200生物力学测试仪检测各组大鼠胫骨的弯曲强度和扭矩。
1.2.6 Western blot法检测骨组织β-catenin、p-GSK3β、PPARγ蛋白表达水平:取出冻存的骨组织,置于匀浆器内,添加200μL细胞裂解液,4℃环境充分裂解细胞,12000转/min离心20min,弃上清得到蛋白样品,采用Bradford蛋白浓度测定试剂盒测定总蛋白含量;目的蛋白通过聚丙烯酰胺凝胶电泳(SDS-PAGE)分离目的蛋白,并将其转移至PVDF膜上,室温封闭后分别滴加β-catenin抗体(1:2000稀释)、p-GSK3β抗体(1:1000稀释)、PPARγ抗体(1:1000稀释),β-Actin抗体(1:1000稀释)作为内参,37℃孵育1h后,洗膜,滴加HRP标记山羊抗兔IgG(1:2000稀释)二抗,37℃孵育1h后,洗膜,在暗室内采用ECL显色试剂盒显影、定影,采用化学发光成像系统进行拍照,并分析图像灰度值,观察β-catenin、p-GSK3β、PPARγ蛋白表达水平。
1.3 统计学分析:所有统计数据均统一整理,采用SPSS17.0软件包分析,符合正态性的计量资料采用均数±标准差表示,大鼠胫骨BMD、FPG及血清Ca、P、ALP水平、胫骨弯曲强度和扭矩、骨组织β-catenin、p-GSK3β、PPARγ蛋白表达水平除对照组外各组间比较采用单因素方差分析以及LSD多重比较,模型组与对照组比较采用独立样本t检验,P<0.05存在统计学意义。
2 结 果
2.1 各组大鼠胫骨BMD水平比较:与对照组比较,模型组大鼠胫骨BMD水平均较低,差异具有统计学意义(P<0.05);与模型组比较,氟化钠组、补骨脂组大鼠胫骨BMD水平较高,且补骨脂组>氟化钠组,差异具有统计学意义(P<0.05),见表1。

表1 各组大鼠胫骨BMD水平比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与氟化钠组比较,△P<0.05
2.2 各组大鼠FPG及血清Ca、P、ALP水平比较:与对照组比较,模型组大鼠FPG及血清Ca、P水平较高,模型组大鼠血清ALP水平较低,氟化钠组、补骨脂组大鼠血清ALP水平较高,差异具有统计学意义(P<0.05);与模型组比较,氟化钠组、补骨脂组大鼠血清Ca、P水平较低,且补骨脂组<氟化钠组(P<0.05),氟化钠组、补骨脂组大鼠血清ALP水平较高,且补骨脂组>氟化钠组,差异具有统计学意义(P<0.05)见表2。
2.3 各组大鼠胫骨弯曲强度和扭矩比较:与对照组比较,模型组大鼠胫骨弯曲强度和扭矩水平较低,差异具有统计学意义(P<0.05);与模型组比较,氟化钠组、补骨脂组大鼠胫骨弯曲强度和扭矩水平较高,且补骨脂组>氟化钠组,差异具有统计学意义(P<0.05),见表3。
2.4 各组大鼠骨组织β-catenin、p-GSK3β蛋白表达水平比较:与对照组比较,模型组大鼠骨组织β-catenin蛋白表达水平降低,p-GSK3β蛋白表达水平升高,差异具有统计学意义(P<0.05);与模型组比较,氟化钠组、补骨脂组大鼠骨组织β-catenin蛋白表达水平较高,且补骨脂组>氟化钠组(P<0.05),氟化钠组、补骨脂组大鼠骨组织p-GSK3β蛋白表达水平较低,且补骨脂组<氟化钠组,差异具有统计学意义(P<0.05),见表4,图1。

表2 各组大鼠FPG及血清Ca、P、ALP水平比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与氟化钠组比较,△P<0.05

表3 各组大鼠胫骨弯曲强度和扭矩比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与氟化钠组比较,△P<0.05

表4 各组大鼠骨组织β-cateninp-GSK3β蛋白表达水平比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与氟化钠组比较,△P<0.05
2.5 各组大鼠骨组织PPARγ蛋白表达水平比较:与对照组比较,模型组大鼠骨组织,PPARγ蛋白表达水平升高,差异具有统计学意义(P<0.05);与模型组比较,氟化钠组、补骨脂组大鼠骨组织PPARγβ蛋白表达水平较低,且补骨脂组<氟化钠组,差异具有统计学意义(P<0.05),见表5,图2。
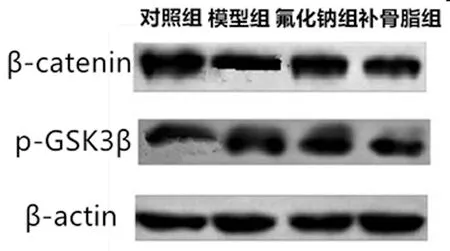
图1 各组大鼠骨组织β-catenin、p-GSK3β蛋白表达情况
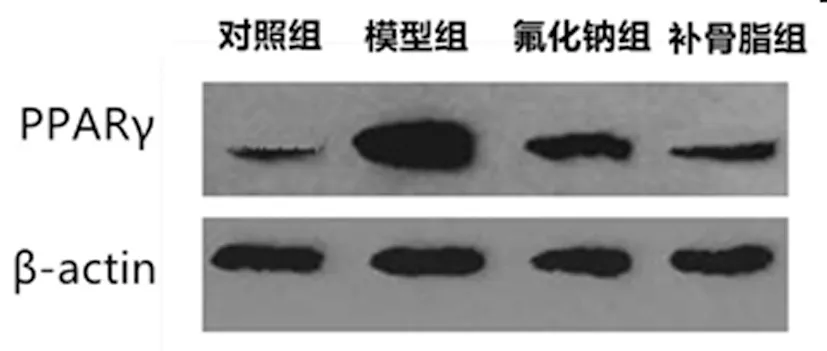
图2 各组大鼠骨组织PPARγ蛋白表达情况

表5 各组大鼠骨组织PPARγ蛋白表达水平比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与氟化钠组比较,△P<0.05
3 讨 论
骨折愈合包括细胞迁移、血管生成、骨痂改建等过程[7],此过程由多种细胞和因子参与完成,任何方面受到影响都可能造成骨折不愈合。T2DM是重要的内分泌系统疾病,长期代谢紊乱能够造成多系统损伤,也能从多个方面对骨折愈合过程产生影响,一方面,T2DM能够造成骨量流失影响愈合[8];另一方面,T2DM多伴有血管病变,影响骨折端血供,高糖状态也造成细胞活性降低、胶原合成异常[9],骨形成速度及强度下降;此外,T2DM还对胰岛素生长因子、血小板衍生生长因子、成纤维细胞生长因子、骨形态蛋白等有调控作用,妨碍骨折愈合。T2DM造成的骨折愈合障碍成因复杂,在治疗上较为困难。中医认为,T2DM合并骨折属于“消渴”“骨折”“骨萎”范畴,与脾、肾亏虚关系密切,治疗上应健脾益肾,强筋健骨。补骨脂也称破故纸、婆固脂等,有温肾壮阳、补脾健胃之效,常用于中药复方中治疗骨科疾病。现代药理研究发现,补骨脂含有黄酮类、香豆素类、豆甾醇等多种活性成分[10],具有抗肿瘤、抗氧化、抗菌、抗白癜风、调节免疫等作用,还能通过影响成骨细胞增殖、分化,诱导骨髓间充质干细胞分化成成骨细胞,调节骨形成和骨吸收以及雌激素样作用防治骨质疏松。本次研究选取健康雄性SD大鼠,采用STZ腹腔注射法建立T2DM大鼠模型,并造成骨折,来探讨补骨脂煎剂对T2DM大鼠骨折愈合的影响以及分子机制本研究结果显示,与模型组比较,各组大鼠胫骨BMD水平较高,且补骨脂组>氟化钠组(P<0.05);各组大鼠胫骨弯曲强度和扭矩水平较高,且补骨脂组>氟化钠组(P<0.05),BMD是影响骨的生物学强度的主要因素,骨折愈合的质量与其生物学强度密切相关,研究结果表明补骨脂煎剂能够有效提高骨密度,改善骨折愈合质量。
T2DM的高血糖状态形成高渗性利尿作用,能够使体内Ca、P流失,一方面骨合成原料减少,另一方面能刺激甲状旁腺激素分泌,骨吸收作用增强,骨折愈合缓慢,血清Ca、P水平升高。本研究结果显示,各组大鼠血清Ca、P水平较低,且补骨脂组<氟化钠组(P<0.05),表明补骨脂煎剂能够抑制骨吸收作用,降低血清Ca、P水平;骨代谢的基本过程是骨形成和骨吸收,只有骨形成作用强于骨吸收,骨折才能顺利愈合,而骨形成过程与成骨细胞活性关系密切,ALP由成骨细胞分泌,能够促进骨的钙化,也是成骨细胞分化的早期标志,能够反映骨形成能力。本研究结果显示,各组大鼠血清ALP水平较高,且补骨脂组>氟化钠组(P<0.05),表明补骨脂煎剂能够提高骨形成能力,促进骨折愈合。
Wnt 信号通路和PPARγ信号通路均是调节骨代谢的重要途径,能够调控成骨细胞及破骨细胞的增殖、存亡。β-catenin蛋白、p-GSK3β蛋白是Wnt 信号通路的重要组分,Wnt 信号通路激活,则β-catenin蛋白与细胞因子/淋巴增强因子转录因子结合形成复合体,从而激活成骨基因转录,促进细胞向成骨细胞分化,有利于骨折愈合;Wnt 信号缺失,p-GSK3β能够诱导β-catenin蛋白降解,导致细胞内β-catenin蛋白水平降低,成骨细胞分化受到抑制。PPARγ蛋白是一种核激素受体,能够通过抑制成骨细胞特异转录因子表达来成骨细胞分化、抑制骨钙素基因表达、促进破骨细胞发育等,从而造成骨吸收增加,造成骨折愈合障碍。另外,Wnt 信号通路和PPARγ信号通路具有相互影响、相互制约的作用。本研究结果显示,各组大鼠骨组织β-catenin蛋白表达水平较高,且补骨脂组>氟化钠组(P<0.05),各组大鼠骨组织p-GSK3β蛋白表达水平较低,且补骨脂组<氟化钠组(P<0.05);各组大鼠骨组织PPARγ蛋白表达水平较低,且补骨脂组<氟化钠组(P<0.05),表明补骨脂煎剂能够通过激活Wnt信号通路、抑制PPARγ信号通路发挥促进骨折愈合的作用。
[1] 孙贤杰.骨折愈合的影响因素[J].中国医药指南,2012,10(17):82~84.
[2] 盛华刚.影响骨折愈合因素的研究进展[J].北方药学,2013,10(3):53.
[3] 刘建恒,张里程,唐佩福.骨折延迟愈合和不愈合的诊治现状[J].中华外科杂志,2015,53(6):464~467.
[4] Wang C Y,Yang H B,Hsu H S,et al.Mesenchymal stem cell-conditioned medium facilitates angiogenesis and fracture healing in diabetic rats[J].Journal of Tissue Engineering&Regenerative Medicine,2012,6(7):559~569.
[5] 李凯明,郝延科.补骨脂抗骨质疏松症的研究进展[J].中医药临床杂志,2016,28(6):886-889.
[6] 刘振东,刘亚江,高敏伟,等.2型糖尿病大鼠骨折愈合障碍与体内晚期糖基化终末产物的变化[J].中国组织工程研究,2014,18(20):3122~3126.
[7] 李溪,向盈盈,龚跃昆,等.糖尿病大鼠骨折愈合早期局部骨痂组织中Ⅰ型胶原纤维表达和骨密度的变化[J].中国组织工程研究,2012,16(33):6097~6101.
[8] Stolzing A,Sellers D,Llewelyn O,et al.Diabetes induced changes in rat mesenchymal stem cells[J].Cells Tissues Organs,2010,191(6):453.
[9] Parizi A M,Jelodar G,Moslemi H,et al.Influence of hydroxyapatite on fracture healing in diabetic rats:biomechanical and radiographic studies[J].Veterinary Archives,2010,80(1):113~120.
[10] 柴丽娟,张晗,王少峡,等.中药补骨脂的药理作用研究进展[J].海峡药学,2013,25(7):12~14.
Study on the Effect of Buguzhi Decoction on Wnt/PPARγ Signal Pathway in Healing Process of Fracture in Type 2 Diabetic Rats
CAODaning,YANGChunhua,LICong
(TheFirstHospitalofChangsha,HunanChangsha410000,China)
Objective:To analysis the effect of Buguzhi Decoction on Wnt/PPARγ signal pathway in healing process of fracture in type 2 diabetic rats. Methods: Seventy-two healthy male SD rats were randomly divided into control group, model group, sodium fluoride and Buguzhi group, each with 18 rats. The tibial fracture model was established in control group, type 2 diabetic tibial fracture model were established by intraperitoneal injection of streptozotocin in the other groups, and were given corresponding drug treatment. The tibia BMD, FPG and serum Ca、P、ALP levels, tibia bending strength and torque, the expression levels of β-catenin, p-GSK3β and PPARγ in bone tissue were detected. Results: After treatment, compared with model control group, the tibia BMD levels were higher in rats of each group,and Buguzhi group was higher than sodium fluoride group(P<0.05);the serum Ca、P levels were lower in rats of each group,and Buguzhi group was lower than sodium fluoride group (P<0.05);the serum ALP levels were higher in rats of each group,and Buguzhi group was higher than sodium fluoride group (P<0.05);the tibia bending strength and torque levels were higher in rats of each group,and Buguzhi group was higher than sodium fluoride group (P<0.05);the expression of β-catenin protein in bone tissue of rats in each group was higher in rats of each group, and Buguzhi group was higher than sodium fluoride group (P<0.05);the expression of p-GSK3β protein in bone tissue of rats in each group was lower in rats of each group, and Buguzhi group was lower than sodium fluoride group (P<0.05);the expression of PPARγ protein in bone tissue of rats in each group was lower in rats of each group, and Buguzhi group was lower than sodium fluoride group (P<0.05). Conclusions: Buguzhi Decoction can effectively improve the BMD、serum ALP levels of fracture and type 2 diabetic rats, reduce serum Ca、P levels, improve the biomechanical strength of bone, accelerate fracture healing, it may be associated with up regulation ofβ-catenin protein expression, down regulation of p-GSK3β、PPARγ protein expression, activation of the Wnt signaling pathway and inhibition of the PPAR signaling pathway.
Buguzhi decoction; Type 2 diabetes; Rat; Fracture healing; Wnt/PPAR signal pathway
1006-6233(2017)04-0651-06
湖南省2013年科技基本建设项目投资计划,(编号:2013HS02356)
A 【doi】10.3969/j.issn.1006-6233.2017.04.035

