变“无形”为“有形” 展化学之神奇
向庆元+向裕兵

一些化学反应无明显现象,在反应过程中不发光、不变色、无沉淀和无气体生成,从而不易判断是否发生了化学反应。如:二氧化碳与氢氧化钠溶液的反应、稀盐酸(或稀硫酸)和氢氧化钠溶液的反应等均无明显现象。如何证明这些物质之间确实发生了化学反应呢?此类问题是历年来各地中考的一个热点探究题,考生在解答时往往因为没有掌握方法和规律,对探究的问题无从下手。下面结合近几年来各地中考题中的此类探究问题的一些规律性进行探讨。
1 类型一
根据反应中物质的状态变化引起气压的变化,设计特殊装置进行对比实验。
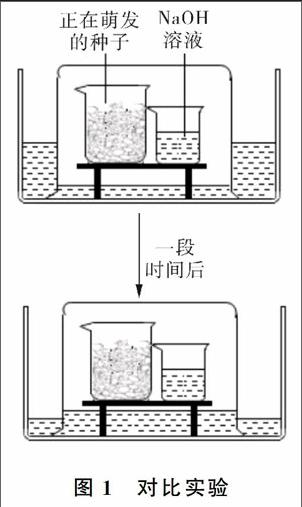
例1:在科学拓展性课程学习中,小柯做了如下实验。先在水槽里的支架上放2个小烧杯,一个盛有较多正在萌发的种子,另一个烧杯装有适量的NaOH溶液,再往水槽内注入一定量的水,最后用一个大烧杯罩住2个小烧杯,如图1所示。持续一段时间后,观察到大烧杯内的水面上升,水槽的水面下降。为什么杯外的水会进入杯内呢?请分析实验过程,并结合所学知识作出解释。
思路点拨:此题属于化学与生物学科综合题,可以根据呼吸作用的产物以及容器内压强的变化来分析解答。种子进行呼吸作用,消耗了氧气,同时产生了等体积的二氧化碳气体,而二氧化碳气体被氢氧化钠溶液吸收,导致大烧杯内气体压强减小。大烧杯内气体压强小于外界大气压强,水槽的水被外界大气压压入烧杯内,使大烧杯内水面上升,水槽内的水面下降。
点评:本题考查了种子的萌发过程和呼吸作用的相关知识,意在考查学生的理解和应用能力。该实验设计原理适用于针对有气体参加的反应,设计在一个密闭容器内进行反应,造成装置内压强的减小,使装置或装置的一部分(如:软塑料瓶、与装置连接的气球等)外形发生变化,从而证明反应的发生。
2 类型二
借助酸碱指示剂的变色反应或测定溶液pH值的变化进行判断。
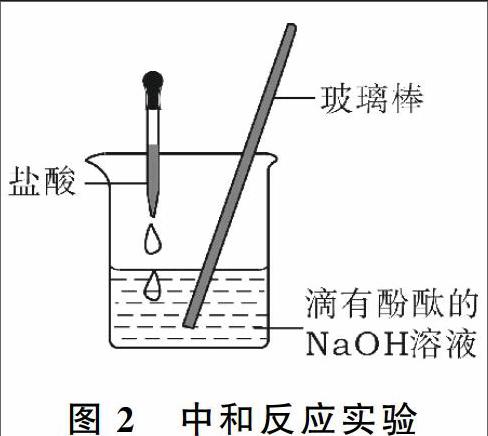
例2:某同学用盐酸与氢氧化钠溶液按照如图2所示的方式进行中和反应实验。
(1)此反应的化学方程式为_____________ 。
(2)向烧杯中逐滴滴入盐酸至过量,在这个过程中,能够说明盐酸与氢氧化钠发生了化学反应的实验现象是_____________ 。
思路点拨:盐酸和氢氧化钠能够发生:HCl+NaOH=NaCl+H2O,该反应没有明显的现象,可以借助酸碱指示剂的颜色变化来证明反应的发生。氢氧化钠呈碱性,能使无色酚酞试液变红,加入盐酸的过程中要不断搅拌,使盐酸与氢氧化钠充分反应,防止局部酸液过量,酚酞在中性或酸性溶液中都显无色,当溶液红色消失时,说明盐酸与氢氧化钠溶液发生了反应。故答案为:(1)HCl+NaOH=NaCl+H2O;(2)溶液由红色变为无色。
点评:该实验设计原理利用了酸碱指示剂的显色反应,即无色酚酞溶液在碱性溶液中为红色,在酸性溶液和中性溶液中显无色。实验时要注意操作的顺序和要点:首先在碱性溶液中加入酚酞试液,使溶液显红色,然后用胶头滴管逐滴滴加酸溶液,边加边搅拌,直至溶液刚好变成无色为止,证明酸和碱恰好完全中和。此实验如果先加酸溶液,反应后再加酚酞,就不能说明酸和碱是否完全反应(也可能是酸溶液过量导致的)。
3 类型三
通过验证反应物的消耗或新物质的产生进行判断。
例3:实验室有一瓶敞口放置的过氧化钠(Na2O2)固体。同学们想证明这瓶过氧化钠是否变质,进行了如下实验探究。
查阅资料:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑。
提出猜想:①没有变质;②部分变质;③全部变质。
实验过程及结论:
(1)取少量样品于试管中,加入足量水,无明显现象,证明猜想_____________正确(填序号)。
(2)取少量步骤(1)中所得的溶液于试管中,滴加适量稀盐酸,有无色气体产生,证明原样品中一定含有_____________。
(3)请在原有实验的基础上,进一步设计实验证明原样品中还可能含有什么物质。(写出简要的实验步骤、现象和结论)_____________。
思路点拨:(1)由于过氧化钠能够与水反应生成氧气,取少量样品于试管中,加入足量水,无明显变化,说明不含过氧化钠,故是全部变质,猜想③正确。(2)取少量(1)中所得的溶液于试管中,滴加适量稀盐酸,有无色气体产生,证明原样品中含有碳酸。(3)依据资料提供的信息可知,原样品中还可能含有氢氧化钠。要证明氢氧化钠的存在,需要先除去碳酸钠,再用酚酞试液检验。故答案为:(1)③;(2)碳酸钠(Na2CO3);(3)取少量步骤(1)中所得的溶液于试管中(或取少量原样品于试管中,加入足量水溶解),加入足量CaCl2溶液(或BaCl2溶液),充分反应后静置,取上层清液于试管中,滴加酚酞试液,若溶液变红,则原样品中含有氢氧化钠,反之则不含有氢氧化钠。
点评:该实验设计依据的原理是利用反应物或生成物的有关化学性质,设计对应物质的性质实验,依据实验现象判断该物质是否存在,从而得出正确的结论。此类实验探究题需要注意的是:证明某种物质存在时,要排除其他物质的干扰,如本题中碳酸钠的存在就会对氢氧化钠的检验产生干扰。两者的溶液都显碱性,能够使无色酚酞试液变为红色,故在检验氢氧化钠时,要先除去碳酸钠。
例4:如图3所示:甲瓶中盛放的是浓H2SO4,乙瓶中放的是用石蕊试液染成紫色的干燥小花。若关闭阀门Ⅰ,打开阀门Ⅱ,紫色小花不变色;若关闭阀门Ⅱ,打开阀门Ⅰ,紫色小花( )。
A.变红色 B.变蓝色 C.变白色 D.不变色
思路点拨:二氧化碳本身不显酸性,二氧化碳与水反应生成碳酸,碳酸显酸性。若关闭阀门Ⅰ,打开阀门Ⅱ,让潮湿的二氧化碳气体经过甲瓶浓硫酸后,通入乙瓶,干燥的紫色小花不变红,说明干燥的二氧化碳不能使石蕊试液变成红色;若关闭阀门Ⅱ,打开阀门Ⅰ,进来的是潮湿的二氧化碳,二氧化碳和水反应产生的碳酸使紫色的小花变成红色。故答案为A。
点评:二氧化碳与水反应生成碳酸,该反应本身没有明显的现象,需要借助反应产物的验证进行判断。使紫色石蕊试液变为红色的物质不是二氧化碳,也不是水,而是二氧化碳和水反应后生成的碳酸。
4 类型四
通过测定溶液温度的变化进行判断。
例5:将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图4所示。
(1)在滴加的过程中,烧杯中溶液的pH值逐渐_____________(填“增大”“减小”或“不变”)。
(2)由图4可知,稀盐酸与氢氧化钠溶液发生的反应是 _____________(填“放热”或“吸热”)反应。
(3)图中B点时,溶液中的溶质是_____________ (填化学式)。
思路点拨:氢氧化钠溶液显碱性,pH>7,加入稀盐酸后发生中和反应,pH值逐渐减小。由图像可知,反应过程中溶液的温度逐渐升高,当恰好完全反应时,温度达到最高值,故该反应是放热反应。当处于图中B点时,中和反应恰好完全,溶液中只有反应后生成的盐,即NaCl。故答案为:减小;放热;NaCl。
点评:有些中和反应没有明显的现象,但反应过程中会放出热量,使溶液的温度发生变化,故可以借助温度计或温度传感器测量两种溶液混合后温度的变化情况,从而判断反应的发生情况。
总之,实验探究题是化学中考难度较大的一类题型,它根据已有的化学知识和生活经验,选择有探究价值的科学问题设置情境,引导学生利用科学的方法“追寻”科学家探究的“足迹”。这类试题设计新颖,构思巧妙,源于生活,基于实践,要求学生既要善于应用已有的化學知识解决问题,也要掌握科学的思维方法和探究能力。只要教师善于引导学生发现问题,在不断地比较归纳中总结规律,这类问题就不会成为学生求知路上的“拦路虎”,反而能够使他们在解决探究问题的过程中体验到学习的快乐,感受到化学的“神奇”之处。

