土壤微生态环境对樱桃树“黑疙瘩”病发生的影响①
杨 璐,杜岩新,徐利娟,黄建新
(西北大学生命科学学院,西安 710069)
土壤微生态环境对樱桃树“黑疙瘩”病发生的影响①
杨 璐,杜岩新,徐利娟,黄建新*
(西北大学生命科学学院,西安 710069)
研究陕西“黑疙瘩”病樱桃树根际土壤微生态环境,分析其对樱桃树“黑疙瘩”病发病的影响,可为后期防治工作提供理论和实践依据。本研究采用传统微生物学、分子生物学及生物化学相结合的方法,对陕西白鹿原发病樱桃树根际土壤理化性质、土壤酶活性及可培养微生物数量、优势细菌种类与健康樱桃树根际的差异进行了分析,结果表明:健康樱桃树根际土壤全磷、速效钾、有效磷、碱解氮平均含量高于病株根际,土壤有机碳含量低于病株根际,而土壤全氮、全钾含量及pH根际间差异不显著;健康樱桃树根际土壤蛋白酶、脲酶、转化酶及多酚氧化酶活性高于病株根际,而脱氢酶和过氧化氢酶活性低于病株根际。土壤根际微生物分析表明,健康樱桃树根际土壤的可培养细菌、放线菌数量显著高于病株根际,尤其是优势细菌种类及数量;而霉菌平均数量则相反,但差异不显著。因此,根际土壤可培养细菌、放线菌的减少及优势细菌分布不均,以及速效养分的减少、酶活性的降低可能是影响樱桃树“黑疙瘩”病发生的原因之一。
樱桃树;黑疙瘩病;土壤微生态环境
樱桃(Cerasus pseudocerasus),某些李属类植物的统称,因其果实外表晶莹剔透、色泽鲜艳且富含多种营养元素,作为水果食用备受人们的喜爱。国内现已有许多大型樱桃产地,陕西白鹿原万亩樱桃园就是其一,樱桃产业已成为陕西农业发展的重要支柱。但近年来该地区的樱桃树出现一种严重的病害,症状为地上树干、树枝及分叉处木质部凸起形成深褐色、黑色瘤状病斑并伴有流胶现象。实地调查发现该症状是已有研究报道中的根癌病、流胶病以及枝枯病症状的综合。其与根癌病最为相似,但两者发病部位不同,根癌病发病部位主要集中在近表土树根部,树枝上少有[1],但陕西白鹿原所发现的病害树根部感染极少,且经调查多年来农民按照冠瘿病所进行的治疗是无效的,当地农民根据病状的表征称其为“黑疙瘩”病。该病害传播速度快,同一果园在3年内感染率高达80%,减产20% 以上,严重时甚至出现毁园现象。因其病状特殊,故下文中也称其为“黑疙瘩”病。
根际土壤微生态环境与植物健康状况之间的关系已成为近年来研究的热点。已有研究表明,果树根际土壤状况与果树的抗逆性和病害的发生密切相关[2]。由于目前陕西樱桃树这种病害产生的原因尚无定论,因此,本研究拟通过分析病害园(发病率高达90%)与健康园(发病率为0)樱桃树根际土壤的理化特征、酶活性,以及可培养微生物数量、优势细菌的种类差异来分析病状发生的可能原因,以期为防治樱桃病害提供新的途径。
1 材料与方法
1.1 材料
1.1.1 土壤样品的采集与处理 土壤样品在2014年7月采集于陕西省白鹿原樱桃园(108°59′ ~ 109°16′E,34°10′ ~ 34°27′N)。选取连作6年红灯樱桃品种的两个樱桃园,健康园(约0.2 hm2)位于龙湾村,发病率为 0;病害园位于西塘村田园樱桃标准示范园(约1 hm2),发病率约90% 以上。两个樱桃园在地理位置上相隔约10 km,土壤均为黄土类型。采用五点取样法分别对樱桃健康园和病害园中各 7株樱桃树采集其根际土壤[3],健康园样品编号为J1 ~ J7;病害园均为病情严重植株,编号为B1 ~ B7。采集的土样分别放于灭菌平皿中并用保鲜袋独立包装,快速运回实验室,放于–4 ℃冰箱中保存。
1.1.2 所用培养基[4]牛肉膏蛋白胨培养基用于细菌分离培养;高氏1号培养基(加入1% 的苯酚溶液)用于放线菌分离培养;马丁氏培养基用于真菌的分离培养。
1.2 方法
1.2.1 根际土壤理化性质的测定 依据《土壤农化分析》[5]分别测定健康与患病樱桃树根际土壤有机碳、全氮、全磷、全钾、碱解氮、有效磷、速效钾的含量;按照《土壤质量——pH的测定(ISO 10390: 2005)》分别测定根际土壤pH。
1.2.2 根际土壤酶活性的测定 土壤中积累的酶种类很多,本研究主要检测与植物生长相关的6种酶类:过氧化氢酶(CAT)活性采用高锰酸钾滴定法测定[6],以1 g土壤消耗0.1 mol/L高锰酸钾(对照与试验滴定的差) 的体积(ml)来表示;脲酶活性采用苯酚钠–次氯酸钠比色法测定[6],以1 g土壤产生NH3-N的质量(mg)来表示;转化酶活性采用Na2S2O3滴定法测定[6],以1 g土壤消耗0.1 mol/L硫代硫酸钠(对照与试验滴定的差)的体积(ml)来表示;多酚氧化酶(PPO)活性采用邻苯三酚比色法测定[6],以1 g土壤产生的 棓红紫 精(purpurogallin)的质量来表示;脱氢酶(DHA)活性采用TTC法测定,以1 g土壤产生的三苯基甲 臜质量(mg)来表示[6]。蛋白酶活性采用的改良茚三酮法测定,以 1 g土壤 50℃培养 2 h产生的NH2-N 质量(mg)来表示[7]。
1.2.3 根际土壤可培养微生物数量及优势种群的测定 土样于无菌水中梯度稀释,以平板菌落计数法进行微生物数量计数:细菌选取稀释度为10–4~ 10–6;放线菌稀释度为 10–3~ 10–5;霉菌稀释度为 10–3~10–5,每组设置 3个重复。30℃恒温培养,细菌培养2 d、放线菌培养6 d、霉菌培养4 d,观察结果并记录。
优势细菌为最大梯度(均为10–6)平板菌落,分别挑取平板所有菌落并纯化,根据《伯杰细菌鉴定手册》[8]及《常用细菌系统鉴定手册》[9]对纯化的优势细菌进行初步鉴定归类。同时提取不同菌落 DNA,以细菌16S rDNA 引物27F和1495R对提取的DNA进行PCR扩增,送上海生工生物工程有限公司测序,测序结果在NCBI上BLAST鉴定。
1.2.4 数据统计分析 用 Microsoft Office、Origin等软件对实验数据进行处理并绘图;用SPSS 20.0 对数据进行统计及差异显著性分析。
2 结果与分析
2.1 健康园与病害园樱桃树根际土壤理化性质差异
经测定,健康与患病樱桃树根际土壤的pH均在6.8 ~ 7.5,二者差异不显著。其根际土壤的主要营养元素含量测定结果见图1。由图1E、F、D、B可见:健康园樱桃树根际土壤全磷、有效磷、速效钾、碱解氮的平均含量高于病害园樱桃树根际,且分别是其平均含量的1.17倍、1.26倍、1.42倍、1.07倍;健康园樱桃树根际土壤有机碳平均含量明显低于病害园樱桃树根际(图1G);两园根际土壤的全氮、全钾含量差异并不显著(图 1A、C)。由此可见,病害严重的樱桃树根际土壤中植物可直接利用的营养元素相对健康樱桃树根际呈现减少的趋势。
2.2 健康园与病害园樱桃树根际土壤酶活性差异
根际土壤酶来源于微生物细胞产生释放的外酶、内酶及一些结构酶类,是土壤新陈代谢的重要因素[10],有促进土壤中腐殖质、植物动物残体的分解的作用,并且被作为评价土壤肥力以及健康状况的一个良好潜在指标[11]。
本研究健康与患病樱桃树根际土壤酶活性测定结果见图2。由图2A、B、C、D可见:健康园樱桃树根际土壤中蛋白酶、脲酶、转化酶和多酚氧化酶活性平均值高于病害园樱桃树根际,且是其平均含量的1.92倍、10.23倍、1.67倍、1.61倍;脱氢酶、过氧化氢酶酶活性平均值则低于病害园樱桃树根际,呈现为脱氢酶平均活性值是健康园樱桃树根际土壤 2.25倍(图2F),过氧化氢酶活性平均值两园间则差异不大(图2E)。可见,患病樱桃树根际土壤中大部分酶活性相对健康樱桃树根际呈现减弱的趋势,不利于营养物质的转化循环及有机体的分解与代谢[6]。
2.3 健康园与病害园樱桃树根际土壤可培养菌群差异
2.3.1 可培养微生物数量 土壤微生物对植物根系养分吸收、土壤肥力形成、营养物质分解转化都有非常重要的作用[2]。健康和患病樱桃树根际土壤中细菌、放线菌及霉菌数量测定结果见表1。表1数据表明,健康樱桃树根际土壤细菌、放线菌数量平均值分别是患病樱桃树根际的2.04倍、1.64倍,且差异显著;霉菌数量平均值表现为患病樱桃树根际大于健康樱桃树根际,但差异不显著。可见,患病樱桃树根际土壤细菌及放线菌数量相对健康樱桃树根际土壤有所减少,而霉菌数量则有所增加。
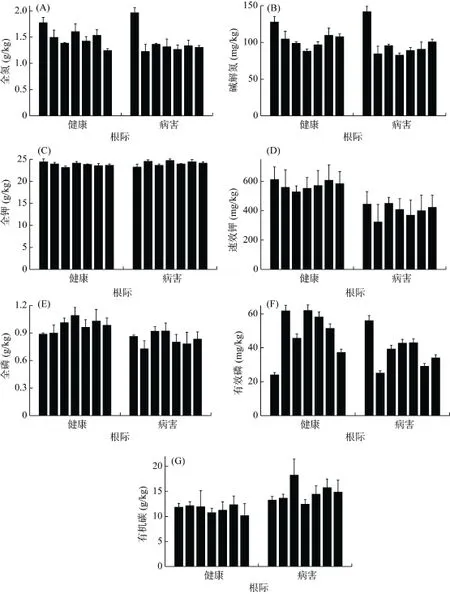
图1 健康与患病樱桃树根际土壤营养元素的对比Fig. 1 Comparison of nutrient elements in healthy and diseased rhizosphere soils of cherry tree
2.3.2 优势细菌种类 从健康园樱桃树根际土壤中分离出优势细菌145株,病害园樱桃树根际土壤中分离出89株,通过形态学和生理生化分析鉴定,将结果相似的菌株进行归类,其中健康园的145株优势细菌可归为16种相似菌株;病害园的89株优势细菌归为15种相似菌株。分别进行16S rDNA测序,结果见表2。
健康樱桃树根际土壤分离出来的 145株菌分别属于9个不同的属;患病样品分离出来的89株菌分别属于8个不同的属。健康与患病樱桃树根际土壤优势细菌种类组成情况如图3所示。
从图3中可见,两种土壤中细菌类群存在一定的差异性,具体表现在健康樱桃树根际土壤优势种属包括芽孢杆菌属(Bacillus)、微小杆菌属(Microbacterium)、考克氏菌属(Kocuria)、类芽孢杆菌属(Arthrobacter),其占总量比例依次为 25.52%、19.31%、17.93% 和12.41%;患病樱桃树根际土壤中仅芽孢杆菌属(Bacillus)是最明显的优势种属,所占比例为44.94%。仅在健康樱桃树根际土壤中发现的种属有壤霉菌属(Agromyces)、贪噬菌属(Variovorax);患病樱桃树根际土仅有的是微球菌属(Micrococcus)。可见,患病樱桃树根际土壤相比健康樱桃树根际细菌优势菌的种类、数量减少,而且菌群结构比例发生变化。
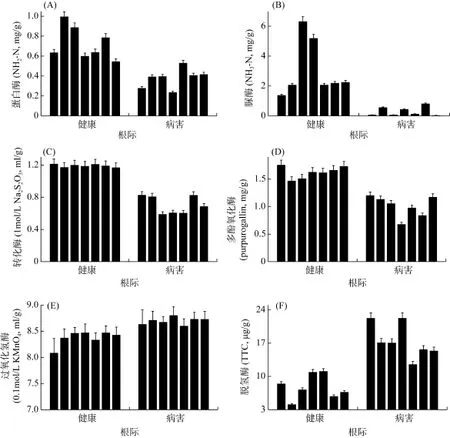
图2 健康与患病樱桃树根际土壤酶活性值对比Fig. 2 Comparison of enzyme activities between healthy and diseased rhizosphere soils of cherry tree

表1 健康与患病樱桃树根际土壤微生物数量Table 1 Numbers of microorganisms in healthy and diseased rhizosphere soils of cherry tree
3 讨论
根际微环境是一个由植物根系细菌、真菌、放线菌及土壤动物组成的多因素相关联的复杂系统[12],是植物和微生物交流活跃的土壤微区[13]。本研究中患病樱桃树根际土壤养分平均含量相对较低的有效磷、速效钾、碱解氮均是植物可直接利用的营养[14],由此可见患病樱桃树根际土壤的速效肥力差且营养缺失严重;而患病樱桃树根际土壤的有机碳平均含量相对较高,这可能是患病植株落叶过多所导致的[15]。
患病樱桃树根际土壤平均酶活性值较低的有蛋白酶、脲酶、转化酶和多酚氧化酶,其中脲酶、蛋白酶参与土壤生态系统氮素循环,尿素的分解,与土壤中氮素的含量呈正相关[16];转化酶与土壤中微生物呼吸强度呈正相关[6];多酚氧化酶与土壤腐殖质程度呈正相关[17]。由此可见,患病樱桃树根际土壤肥力、熟化程度以及微生物活性都不及健康樱桃树根际高。其中,健康樱桃树根际土壤脲酶活性是患病樱桃树根际的10倍,差异最大,结合营养元素结果可见患病根际土壤氮素缺失严重。而患病樱桃树根际土壤酶活性较高的仅有脱氢酶,这可能是因为脱氢酶与土壤中碳源有密切关系[18],患病樱桃树根际土壤有机碳含量高所导致的。

表2 健康与患病樱桃树根际土壤优势细菌鉴定结果Table 2 Numbers of microorganisms in healthy and diseased rhizosphere soils of cherry tree
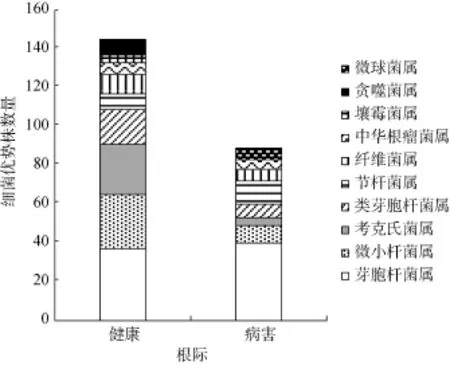
图3 健康与患病樱桃树根际土壤细菌优势菌种类组成Fig. 3 Composition of dominant bacterium species in healthy and diseased rhizosphere soils of cherry tree
根际土壤微生物是土壤–根系间养分转化和转运的调节器[19]。健康樱桃树根际土壤的细菌、放线菌数量相对患病樱桃树根际较多且差异显著,而两园霉菌数量表现为差异不显著。优势细菌的鉴定结果显示,患病樱桃树根际土壤的优势细菌数量及种类不仅少于健康樱桃树根际且菌群结构比例发生变化,其土壤优势细菌考克氏菌属、微小杆菌属、类芽孢杆菌属比重降低且缺少壤霉菌属和贪噬菌属。综合土壤微环境菌群的数量及种类差异,可能是患病樱桃树根际土壤菌群结构比例变化后病菌入侵引起病害,进而患病植株营养传输阻断,造成根际土壤营养不均衡,不利于微生物的生长,土壤失去自我修复的能力,植物病害持续加重。
4 结论
通过比较健康与患病樱桃树根际土壤微环境,发
现在自然环境相同的条件下,患病植株根际土壤相对健康样品氮、磷、钾速效肥力及催化氮素转化循环的酶活性减弱;细菌、放线菌数量,尤其是优势细菌种类及数量减少且菌群结构比例发生变化。由此可见,速效养分氮的减少及微生物菌落的变化可能是导致樱桃树“黑疙瘩”病发生的原因。
[1] 马德钦, 张洪胜, 梁卫东. 利用土壤杆菌防治植物冠瘿病[J]. 微生物学通报, 1995, 22(4): 238–242
[2] 倪志华, 李晶, 廖娇, 等. 果树根际微生态研究现状及展望[J]. 中国农业科技导报, 2010, 12(4): 34–38
[3] Wang X, Zabowski D. Nutrient composition of Douglas-fir rhizosphere and bulk soil solutions[J]. Plant Soil, 1998, 200: 13–20
[4] 沈萍, 范秀容, 李广武. 微生物学实验[M]. 3版. 北京:高等教育出版社, 1999: 214–215
[5] 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000: 25–108
[6] 中国科学院南京土壤研究所微生物室. 土壤微生物研究法[M]. 北京: 科学出版社, 1985: 44–58, 263
[7] 蔡红, 沈仁芳. 改良茚三酮比色法测定土壤蛋白酶活性的研究[J]. 土壤学报, 2005, 42(2): 306–312
[8] 布坎南, 吉本斯. 伯杰细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984
[9] 蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 科学出版社, 2001
[10] Huner A H. Laboratory and greenhouse techniques for nutrient survey to determine the soil amendment required for optimum plant growth[J]. Florida USA: Mimeograph, Agro, Service International, 1998: 56–68
[11] 杨鹏鸣, 周俊国. 不同肥料对土壤蔗糖酶和过氧化氢酶活性的影响[J]. 广东农业科学, 2011(11): 78–80
[12] Campbell R, Greaves M P. Anatomy and community structure of the rhizosphere[M]//Lynch J M. The rhizosphere. Chichester: John Wiley and Sons, 1990: 11–34
[13] 李增强, 赵炳梓, 张佳宝. 玉米品种对根际微生物利用光合碳的影响[J]. 土壤学报, 2016, 53(5):190–199
[14] 杨瑞, 刘帅, 王紫泉. 秦岭山脉典型林分土壤酶活性与土壤养分关系的探讨[J]. 土壤学报, 2016, 53(4): 1037–1046
[15] 李博, 王金满, 王洪丹, 等. 煤矿区土壤有机碳含量测算与影响因素研究进展[J]. 土壤, 2016, 48(3): 434–441
[16] 李娜, 汤洁, 张楠, 等. 冻融作用对水田土壤有机碳和土壤酶活性的影响[J]. 环境科学与技术, 2015, 38(10): 1–6
[17] 郝建朝, 吴沿友, 连宾, 等. 土壤多酚氧化酶性质研究及意义[J]. 土壤通报, 2006, 37(3): 470–474
[18] 张凯煜, 谷洁, 赵听, 等. 土霉素和磺胺二甲嘧啶对堆肥过程中酶活性及微生物群落功能多样性的影响[J]. 环境科学学报, 2015, 35(12): 3927–3936
[19] 孙波, 廖红, 苏彦华, 等. 土壤–根系–微生物系统中影响氮磷利用的一些关键协同机制的研究进展[J]. 土壤, 2015, 47(2): 210–219
Effects of Soil Microecological Environment on Occurrence of‘Black Humor’ Disease in Cherry Tree
YANG Lu, DU Yanxin, XU Lijuan, HUANG Jianxin*
(College of Life Sciences, Northwest University, Xi’an 710069, China)
The methods of traditional microbiology, molecular biology and biochemistry were combined to study the differences of rhizosphere soil physical and chemical properties, soil enzyme activities and the culturable microorganism diversities between healthy and diseased cherry trees in the White Deer Prairie Shaanxi for the prevention and control of ‘Black tumor’ disease. The results showed that the contents of total phosphorus, available potassium, available phosphorus and available nitrogen of healthy rhizosphere soil were significantly higher than those of diseased one, organic carbon content of healthy rhizosphere soil was significantly lower than that of diseased one. Total nitrogen, total potassium contents and pH had no significant difference between healthy and diseased rhizosphere soils. The activities of protease, urease, invertase and PPO enzymes of healthy rhizosphere soil were much higher than those of diseased one, but the activities of DHA and CAT enzymes of healthy rhizosphere soil were lower. The population of culturable bacteria and actinomyces of healthy rhizosphere soil were significantly more than diseased one, particularly of dominant bacteria, the mean population of streptomyces of healthy rhizosphere soil were lower than those of diseased one but without significant difference. The decrease of the number of culturable bacteria and actinomycetes, the imbalance proportion of dominant bacteria in the rhizosphere soil, the decrease of available fertilizer and enzyme activities may be the causes of Black tumor disease.
Cherry tree; Black tumor disease; Soil microecological environment
Q93
A
10.13758/j.cnki.tr.2017.02.015
陕西省自然科学基金项目(SJ08ZT08-2)资助。
* 通讯作者(jxhuang@nwu.edu.cn)
杨璐(1991—),女,山西运城人,硕士研究生,研究方向为应用微生物学。E-mail: lululily91@163.com

