一株高效溶解钾长石芽孢杆菌的分离鉴定与生物学特性研究①
谢庆东,何琳燕,王 琪,盛下放
(农业部农业环境微生物实验室,南京农业大学生命科学学院,南京 210095)
一株高效溶解钾长石芽孢杆菌的分离鉴定与生物学特性研究①
谢庆东,何琳燕,王 琪,盛下放*
(农业部农业环境微生物实验室,南京农业大学生命科学学院,南京 210095)
从风化的钾质粗面岩表面分离筛选到1株高效风化钾长石的芽孢杆菌E31菌株,通过菌株的生理生化特征并结合菌株16S rDNA序列分析,E31菌株被鉴定为苏云金芽孢杆菌(Bacillus thuringiensis)。同时对E31菌株溶解钾长石的效应与机制以及生物学特性进行了研究。结果表明,E31菌株能风化钾长石并释放出其中的元素,28℃ 振荡培养不同时间,接菌处理发酵液中可溶性K、Fe、Ca、Al含量分别比对照提高了19.6% ~ 25.6%、1 ~ 12.5倍、10.4% ~47.2% 和1.2 ~ 4.5倍。在钾长石存在条件下接菌处理发酵液pH为3.62 ~ 3.80,发酵液中葡萄糖酸含量达61 ~ 1 794 mg/L,发酵液细胞数量达 (8.7 ~ 16.1)×106cfu/ml,表明菌株可以通过代谢产生的有机酸来加速对钾长石的分解作用。另外,E31菌株能够合成生长素和铁载体,E31菌株对温度、pH和盐浓度具有较强的耐受性。
钾质粗面岩;钾长石;苏云金芽孢杆菌;矿物风化;葡萄糖酸;生物学特性
微生物–矿物相互作用是地球上广泛发生的一种地质作用,微生物作用下硅酸盐矿物的风化作用是表生环境中普遍存在的地球化学过程[1]。细菌可以通过产生的有机酸、胞外多聚物以及铁载体等不同的机制加速土壤矿物的溶解,对于岩石风化、土壤形成以及土壤肥力的维持有重要的作用,同时在长时间尺度上对土壤环境和大气CO2产生重要的影响[2–6]。芽孢杆菌(Bacillus spp.)是一类革兰氏染色阳性、能够产生抗逆性芽孢、好氧或兼性厌氧,且分布广泛的一类细菌种群[7]。芽孢杆菌的芽孢对高温、干燥、强电离辐射、紫外线、各种有害物质都有很强的抗性,良好的抗逆性使得它在各种恶劣的环境下可以正常地生长繁殖[8]。芽孢杆菌在矿物的生物风化和元素的释放等方面的研究已受到人们的重视。Song 等[9]发现Bacillus subtilis能够显著增强矿物风化的速率;Basak 和Biswas[10]的研究表明,胨冻样芽孢杆菌能够风化云母并能够活化淋溶土中的 K元素;黄智等[11]在摇瓶条件下研究了Bacillus altitudinis溶解钾长石的效应,发现菌株能明显降低发酵液的 pH并释放矿物中的Fe、Si、Al、K等元素。虽然芽孢杆菌分解矿物及其机制的研究已有报道,但从风化的钾质粗面岩表面分离筛选高效风化钾长石的芽孢杆菌并研究其对钾长石的溶解效能与机制等至今未见报道。本研究采用选择性培养基,从钾质粗面岩表面分离筛选到一株高效分解钾长石的苏云金芽孢杆菌,并探明该菌株溶解钾长石的效能、机制及其生物学特性,丰富矿物风化芽孢杆菌资源库,同时为研发高效微生物肥料、提高土壤矿质营养提供理论依据和菌种资源。
1 材料与方法
1.1 钾长石和培养基
钾长石(购自烟台市华威矿业有限公司)元素组成:SiO263.6%,K2O 13.5%,Al2O318.4%,Fe2O31.7%,MgO 0.1%,CaO 0.04%。矿物样品处理参照文献[12]。矿物样品研磨、过100 ~ 300目筛,去离子水超声波清洗、盐酸溶液浸泡、去离子水超声清洗若干次,烘干备用。
BHm培养基:150 mg MgSO4⋅7H2O,80 mg NaH2PO4,90 mg Na2HPO4,65 mg (NH4)2SO4,20 mg CaCl2,2 g葡萄糖,1 L蒸馏水,调节pH至7.0;LB培养基:10 g 胰蛋白胨,5 g 酵母粉,10 g 氯化钠,1 L 蒸馏水,调节pH至7.0;有氮改良培养基:10 g蔗糖,2 g K2HPO4,1 g (NH4)2SO4,0.5 g MgSO4⋅7H2O,0.1 g NaCl,1 L蒸馏水,调节pH至7.0。
1.2 芽孢杆菌分离、纯化与筛选
采用LB培养基按文献[12]分离。已风化钾质粗面岩样品采自南京小龙山钾矿区(118°45′E,31° 47′N)。岩石样品 10 g 加入 90 ml 无菌水中,充分振荡(10 min)以制备成菌悬液,菌悬液置于80℃水浴锅中水浴15 min以杀死非芽孢杆菌,采用稀释涂布的方法分离岩石样品中的芽孢杆菌,平板在 30℃培养3天后挑取单菌落并进行菌种划线纯化。
采用贫营养的 BHm培养基,以发酵液中有效Al含量的增加作为钾长石溶解的标志。100 ml 塑料三角瓶中分装BHm培养基30 ml,加入0.15 g 钾长石粉,调节培养基pH为7.0,115℃ 灭菌30 min,将供试菌株分别接种于2 ml LB培养基中培养12 ~16 h,离心(8 000 r/min,5 min)收集菌体后,用无菌水洗涤2次后重悬于无菌水中,调整其OD600为0.8左右(108cfu/ml),接种于每一只塑料瓶中,对照接等量灭活菌液,28℃振荡(150 r/min)培养7天后分析发酵液中有效Al含量,以筛选高效分解钾长石的芽孢杆菌菌株。发酵液中有效Al含量的测定:将发酵液10 000 r/min离心5 min,取上清液用电感耦合等离子发射光谱仪(ICP-OES)测定溶液中Al的含量。
1.3 高效菌株对钾长石的溶解作用
高效菌株对钾长石的溶解试验同1.2。摇瓶培养时间分别为0、1、2、3、5、7和15 d,在不同培养时间取样分析发酵液pH,细胞数量,有机酸以及其中有效态Fe、Al、K、Ca等元素的含量。发酵液pH采用pH计测定,细胞数量采用平板计数,发酵液高速离心(10 000 r/min,15 min),0.25 μm 滤膜过滤,滤液用高效液相色谱法测定发酵液中有机酸,测定条件:色谱柱:C18 Agilent ZorbaxSB-AQ (4.6 mm × 250 mm),流速0.6 ml/min,进样量20 μl,流动相:0.02 mol/L KH2PO4(pH 2.4)和1% 色谱甲醇,检测波长214 nm;发酵液有效态Fe、Al、K、Ca等元素的含量采用ICPOES测定。
1.4 高效矿物风化芽孢杆菌形态、生理生化特性与鉴定
按常规方法对菌株形态和生理生化特性进行分析。将菌株接种于灭菌的2 ml LB液体培养基,30℃、180 r/min振荡培养12 h。取1.5 ml纯培养物6 000 g离心5 min,细菌基因组总DNA的提取采用CTAB法[13]。菌株16S rDNA扩增采用细菌通用引物27F(5′-AGAGTTTGATCGGCTCAG-3′)和 1492R(5′-TACGGCTACCTTGTTACGACTT-3′),扩增片段长度为 1.5 kb。反应体系为 25 μl,包括 12.5 μl 2×Taq Master Mix,0.5 μl浓度为10 μmol/L的引物,1 μl DNA模板,10.5 μl ddH2O;PCR反应条件为95℃ 预变性5 min,95℃ 变性45 s,56℃ 退火45 s,72℃ 延伸1.5 min,30个循环,最后72℃ 延伸10 min。PCR产物用经EB染色的1% 的琼脂糖凝胶电泳检测。将获得的序列用BLAST软件与GenBank中已知的16S rRNA基因序列进行比对分析,鉴定菌株。
1.5 菌株产吲哚乙酸(IAA)和铁载体能力测定
菌株产IAA能力测定采用王璐等[14]方法。将供试菌株接入有氮培养基中振荡培养,发酵液离心,取上清液,加正磷酸和Sackowski’s显色剂,混匀,黑暗下显色,测定530 nm波长处吸光值。以IAA标准液作标准曲线,计算发酵液中IAA的浓度[15]。
菌株产铁载体能力测定参照王璐等[14]方法。将供试菌株接入有氮液体培养基,振荡培养,发酵液离心,取上清液加入CAS检测液,混匀,以去离子水作对照,测定630 nm波长处的吸光值;取未接菌的LB液体培养基与CAS检测液混匀,同法测定为参比值[16–17]。
1.6 温度、初始 pH和盐浓度对芽孢杆菌生长的影响
温度、初始pH和盐浓度对芽孢杆菌生长的影响采用王璐等[14]方法进行分析。将供试菌株点接于LB固体平板,分别在4℃、15℃、30℃、45℃和55℃的温度下培养 72 h,观察其能否生长及生长情况;用1 mol/L的HCl和1 mol/L的NaOH将LB培养基的pH调节至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0。将活化的供试菌株分别点接于上述不同pH的培养基中,28℃ 培养72 h,观察其能否生长及生长情况;按质量百分比浓度分别配制NaCl浓度为0.1%、0.5%、1.0%、5.0%、10%、20% 和 30% 的LB培养基,将供试菌株分别点接于上述培养基上,30℃ 培养72 h,观察其能否生长。
1.7 数据处理
所有试验数据均采用Microsoft Office Excel 2007处理,采用SPSS 19.0对数据进行方差分析。
2 结果与讨论
2.1 芽孢杆菌的分离筛选
细菌广泛分布在岩石(矿物)表面和土壤中[12,18]。采用热处理和添加钾长石的贫营养培养基(BHm培养基)筛选到18株能够从钾长石中释放Al的芽孢杆菌,其中菌株 E31风化钾长石的能力最强,接菌处理发酵液中的有效Al(0.53 mg/L)含量比对照(0.09 mg/L)增加了4.9倍,因此,以下试验均以菌株E31为供试菌株。另外,供试钾质粗面岩表面可培养细菌数量达2.86×106cfu/g,芽孢杆菌数量达3.24×105cfu/g,芽孢杆菌数量占总细菌数量的11.3%。
2.2 E31菌株对钾长石的溶解作用及其机制
研究表明,细菌可以通过产生的有机酸、铁载体、多糖以及氧化还原作用加速矿物的风化并释放其中的元素[5,9,12,19]。由图 1可以看出,芽孢杆菌E31菌株具有显著的溶解钾长石的能力。接菌处理的发酵液中有效性K、Ca、Fe、Al的含量分别比对照增加了19.6% ~ 25.6%、10.4% ~ 47.2%、1 ~ 12.5倍和1.2 ~ 4.5倍(图1)。随着培养时间的延长,菌株E31溶解钾长石的能力增强,而对照处理发酵液中的K、Ca、Fe、Al含量没有显著变化。菌株E31在含钾长石的贫营养培养基中能够正常生长,培养1 d后发酵液中活细胞数量由初始的 1.4×106cfu/ml增加到1.5×107cfu/ml,培养时间在1 ~ 7 d内发酵液中活细胞数量没有显著变化,培养7 d后发酵液中的活细胞数量显著下降(图2A)。另外,菌株E31在风化钾长石的过程中可以通过产酸来降低发酵液中的pH,培养1 d后,接菌处理的发酵液pH为3.66 ~ 3.80,而对照处理发酵液中的pH在培养过程中没有显著变化(图2B)。菌株E31在含钾长石的贫营养培养基中能够大量合成葡萄糖酸,培养1 d后发酵液中葡萄糖酸含量最高(1 794 mg/L),随着培养时间的延长,发酵液中葡萄糖酸含量快速下降,培养后期发酵液中葡萄糖酸含量为61 ~ 66 mg/L(图3)。由此可见,菌株 E31能够在贫营养条件下通过细胞生长和代谢活动来降低发酵液中的pH,并通过发酵液的酸化作用和合成的葡萄糖酸的络合作用来溶解钾长石并释放出其中的元素,增加发酵液中可溶性K、Ca、Fe、Al含量[5,12]。
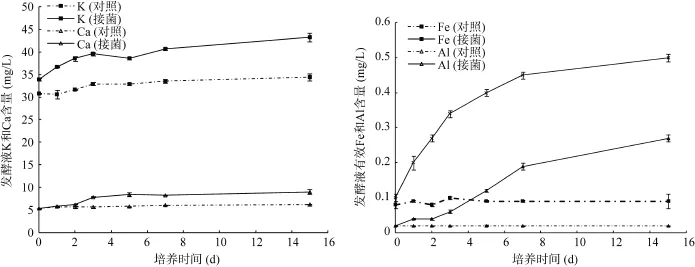
图1 E31菌株对K、Ca、Fe和Al的溶解作用Fig. 1 K, Ca, Fe, and Al releases from feldspar in presence of strain E31
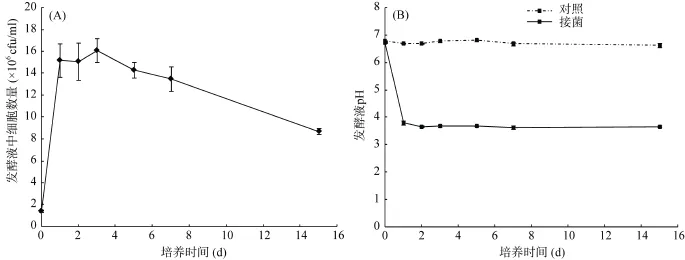
图2 发酵液细胞数量(A)和pH (B)的变化Fig. 2 Change of cell numbers and pH in culture medium in presence of strain E31

图3 芽孢杆菌E31菌株合成的葡萄糖酸Fig. 3 Production of gluconic acid by strain E31 during feldspar weathering process
2.3 菌株E31的鉴定
菌株E31的鉴定主要依据16S rRNA序列并结合菌株基本特征进行。菌株 E31的基本特征:革兰氏阳性、好氧、杆状、菌体大小为(1.5 ~ 2.0) μm×(3.0 ~3.5) μm,能产生芽孢。在LB培养基上菌落为白色、圆形、边缘不规则、厚实且较湿润、易挑取。将E31菌株16S rRNA序列在数据库中进行相似性比对,采用MEGA 5.0软件经临近法(Neighbor-joining)构建系统发育树(图4)。由系统发育树可以看出,菌株 E31与Bacillus thuringiensis ATCC 10792T(ACNF01000156)的16S rRNA基因序列相似性为100%。因此,E31菌株被鉴定为Bacillus thuringiensis。
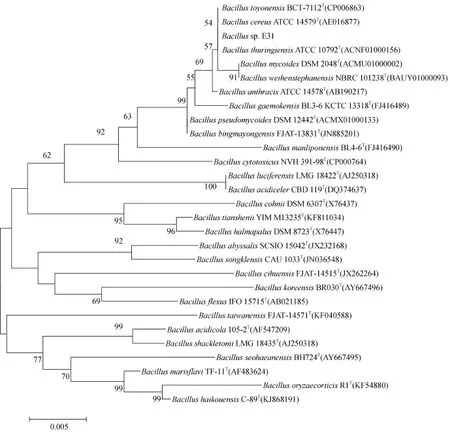
图4 基于16S rDNA 序列系统发育树(邻接法)Fig. 4 Neighbour-joining phylogenetic tree based on 16S rDNA gene sequences
2.4 苏云金芽孢杆菌E31菌株产生长素和铁载体能力
菌株E31具有产IAA的能力,产量为30.8 mg/L。铁载体是一类特异性螯合剂,是微生物在限铁条件下(即铁离子浓度较低时)产生并分泌的一种低分子量(<1 000 Da)、能够螯合Fe (III) 离子的化合物。本试验采用CAS通用检测法检测供试菌株产铁载体的能力[16–17]。根据A/Ar比值(即菌株测定值/对照值)对细菌铁载体产量进行半定量比较,A/Ar比值越小菌株产铁载体能力越强[15–16]。菌株 E31的 A/Ar比值为0.45(在0.4 ~ 0.6范围内),产铁载体能力中等。
2.5 苏云金芽孢杆菌E31菌株对环境的适应能力
苏云金芽孢杆菌E31菌株对不同的温度、pH和盐浓度等表现出一定的耐受性。菌株E31为中温菌,在15 ~ 37℃下能较好生长,最适生长温度为30℃左右;菌株E31生长的pH范围是3 ~ 10,最适生长pH 7.0;菌株E31在0.5% ~ 20% 的NaCl中良好生长,最适生长盐浓度为1.0% NaCl,值得注意的是,菌株E31耐高渗能力较强,在20% NaCl中能够正常生长。
3 结论
1) 从风化的钾质粗面岩表面分离筛选到一株高效风化钾长石的苏云金芽孢杆菌E31菌株。
2) 研究表明,苏云金芽孢杆菌E31菌株能够显著促进钾长石的溶解并释放出其中的 Fe、K、Al、Ca等元素,E31菌株主要通过培养基的酸化和合成的葡萄糖酸加速钾长石的风化。
3) E31菌株能够合成植物促生物质生长素和铁载体,同时对温度、酸碱有一定的耐受性,尤其具有较强的耐高渗能力。
[1] Ehrlich H L. Geomicrobiology: Its significance for geology[J]. Earth-Science Reviews, 1998, 45: 45–60
[2] Schulz S, Brankatschk R, Dümig A, et al. The role of microorganisms at different stages of ecosystem development for soil formation[J]. Biogeosciences, 2013, 10: 3983–3996
[3] Ahmed E, Holmström S J M. Microbe–mineral interactions: The impact of surface attachment on mineral weathering and element selectivity by microorganisms[J]. Chemical Geology, 2015, 403: 13–23
[4] Shirokova L S, Bénézeth P, Pokrovsky O S, et al. Effect of the heterotrophic bacterium Pseudomonas reactans on olivine dissolution kinetics and implications for CO2storage in basalts[J]. Geochimica et Cosmochimica Acta, 2012, 80: 30–50
[5] 连宾. 矿物–微生物相互作用研究进展:地质微生物专栏文章评述[J]. 矿物岩石地球化学通报, 2014, 33(6): 759–763
[6] 张亮, 袁玲, 黄建国. 自生固氮菌对土壤钾的活化作用[J]. 土壤学报, 2015, 52(2): 399–405
[7] 杨苏声. 细菌分类学[M]. 北京: 中国农业大学出版社, 1997
[8] Nicholson W L, Munakata N, Horneck G, et al. Resistance of Bacillus endospores to extreme terrestrial and extraterrestrial environments[J]. Microbiology and Molecular Biology Reviews, 2000, 64: 548–572
[9] Song W, Ogawa N, Oguchi C T, et al. Effect of Bacillus subtilis on granite weathering: A laboratory experiment[J]. Catena, 2007, 70: 275–281
[10] Basak B B, Biswas D R. Influence of potassium solubilizing microorganism (Bacillus mucilaginosus) and waste mica on potassium uptake dynamics by sudan grass (Sorghum vulgare Pers.) grown under two Alfisols[J]. Plant and Soil, 2009, 317: 235–255
[11] 黄智, 何琳燕, 盛下放, 等. 矿物分解细菌 Bacillus sp.L11对钾长石的风化作用[J]. 微生物学报, 2013, 53(11): 1172–1178
[12] Sheng X F, Zhao F, He L Y, et al. Isolation and characterization of silicate mineral-solubilizing Bacillus globisporus Q12 from the surfaces of weathered feldspar[J]. Canadian Journal of Microbiology, 2008, 54: 1064–1068
[13] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA[J]. Nucleic Acid Research, 1980, 8: 4321−4326
[14] 王璐,何琳燕,盛下放. 耐铜苏丹草根内产ACC脱氨酶细菌的分离筛选及其生物学特性研究[J]. 土壤, 2016, 48(1): 95–101
[15] Gordon S A, Weber R P. Colorimetric estimation of indole acetic acid[J]. Plant Physiology, 1951, 26: 192–195
[16] Schwyn B, Neilands J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytic Biochemistry, 1987, 160: 47–56
[17] Manjanatha M G, Loynachan T E, Atherly A G. Tn5 mutagenesis of Chinese Rhizobium fredii for siderophore overproduction[J]. Soil Biology and Biochemistry, 1992, 24: 151–155
[18] Wang R R, Wang Q, He L Y, et al. Isolation and the interaction between a mineral-weathering Rhizobium tropici Q34 and silicate minerals[J]. World Journal of Microbiology and Biotechnology, 2015, 31: 747–753
[19] Balland C, Poszwa A, Leyval, C, et al. Dissolution rates of phyllosilicates as a function of bacterial metabolic diversity [J]. Geochimica et Cosmochimica Acta, 2010, 74: 5478–5493
Isolation and Identification of a Feldspar-dissolving Bacillus Strain and Its Biological Characteristics
XIE Qingdong, HE Linyan, WANG Qi, SHENG Xiafang*
(Key Laboratory of Agricultural and Environmental Microbiology, Ministry of Agriculture, College of Life Science, Nanjing Agricultural University, Nanjing 210095, China)
One mineral-weathering Bacillus strain was isolated from the surface of weathered potash trachyte and was identified as Bacillus thuringiensis based on the physiological and biochemical traits and 16S rDNA sequence analysis. The dissolution of feldspar by strain E31 and the mechanism involved as well as the biological characteristics were characterized. The results showed that strain E31 could weather feldspar and release elements from the mineral. The concentrations of K, Fe, Ca, and Al were increased by 19.6%–25.6%, 1–12.5 times, 10.4%–47.2% and 1.2–4.5 times in the presence of strain E31 compared with the controls respectively during the mineral weathering process. pH value, gluconic acid content, and cell numbers in the culture medium were 3.62–3.80, 61–1 794 mg/L, and (8.7–16.1)×106cfu/ml, respectively, in the presence of strain E31, suggesting that strain E31 could promote the mineral weathering by increasing the production of organic acids in the culture medium. Furthermore, E31 strain has the ability to produce IAA and siderophores in culture medium and also has the characteristics of acid or alkali and salt tolerance and temperature resistance.
Potash trachyte; Feldspar; Bacillus thuringiensis; Mineral weathering; Gluconic acid; Biological characteristics
Q93;S1
A
10.13758/j.cnki.tr.2017.02.014
国家自然科学基金项目(41473075)资助。
* 通讯作者(xfsheng@njau.edu.cn)
谢庆东(1990—),男,山西晋城人,硕士研究生,主要从事硅酸盐矿物–细菌相互作用研究。E-mail: 2013116076@njau.edu.cn

