细胞壁组分在红酵母RS1高耐铝中的作用研究①
胡振民,赵学强,王 超,沈仁芳*
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)
细胞壁组分在红酵母RS1高耐铝中的作用研究①
胡振民1,2,赵学强1,王 超1,沈仁芳1*
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)
红酵母RS1是从酸性油茶土壤中分离到的一株高耐铝微生物,能够忍耐高达200 mmol/L以上的铝,前期研究表明 RS1高耐铝能力与细胞壁有关,但是其具体机制还不清楚。因此,本文进一步研究了细胞壁组分在 RS1高耐铝中的作用,以期为RS1高耐铝的具体机制提供新信息。结果表明,高于70 mmol/L的铝对RS1生长产生抑制作用,0 ~ 70 mmol/L铝处理后细胞壁主要组分甘露糖和葡聚糖含量都没有显著改变,而细胞壁磷含量在70 mmol/L铝处理后显著升高。在高铝处理时,糖蛋白抑制剂抗生素衣霉素(tunicamycin)极大加重RS1的铝毒害。由此说明,细胞壁多糖组分含量并不对RS1高耐铝起到主要作用,细胞壁结构修饰如细胞壁磷含量响应和细胞壁N连接的糖蛋白修饰在RS1高耐铝中可能起到一定作用。
红酵母;铝毒;细胞壁;甘露糖蛋白
当土壤pH低于5时,铝(Al)主要以毒性Al3+形式存在,是酸性土壤中对植物和微生物造成毒害的主要因子之一[1–3]。对植物的耐铝机制研究较多,其耐铝机制主要包括外部排斥和内部耐受[4–6]。同时,在酸性土壤中存在着高耐铝微生物,相对植物,耐铝微生物可以耐受高达100 mmol/L的铝[7–9]。相对于培养基中高浓度铝,耐铝微生物能保持细胞极低铝浓度,说明高耐铝微生物主要通过有效地将铝屏蔽于细胞外达到解铝毒目的[10–11],但关于微生物屏蔽铝的具体机制并不清楚。对于进入到细胞质内的铝,微生物主要通过有机酸或其他螯合物质与铝螯合减轻细胞内铝毒害[12–13]。同时微生物生长快、周期短、易变异、单细胞等特点为铝毒研究提供了便利,其高耐铝机制的阐明也可为植物耐铝机制提供借鉴,在未来有望应用于改良酸性土壤和改善生态环境[14]。
本实验室前期在江西鹰潭酸性油茶土壤中筛选得到一株高耐铝红酵母RS1,可以在200 mmol/L铝下生长,并发现高浓度铝处理下 RS1细胞壁增厚,这种响应机制可能对RS1耐高浓度铝起到重要作用[15–17],但是细胞壁在 RS1高耐铝中的确切作用还不清楚。酵母细胞壁主要由葡聚糖和甘露糖蛋白组成,葡聚糖位于细胞壁内侧,主要维持细胞壁的机械强度[18];甘露糖蛋白位于细胞壁表面,并广泛被 O(丝氨酸或苏氨酸)和 N(天冬酰胺)糖基化修饰,决定了细胞壁的疏水性、电荷及对溶质分子的透过性[19]。酿酒酵母中与囊泡运输和蛋白甘露糖基化有关的基因缺失后,酵母细胞壁结构受到影响,突变体对铝更为敏感,说明细胞壁相关组分及其代谢在酵母耐铝中起到作用[20]。细胞壁糖蛋白抑制剂衣霉素,作为一种抗生素,其对酵母进行处理后能够抑制甘露糖N连接的糖基化修饰,会影响到细胞壁甘露糖蛋白组成及结构[21],进而可能会影响到RS1耐铝性。
在本实验室前期研究及相关文献的基础上[15–21],本文进一步研究了细胞壁在 RS1高耐铝中的作用,并用糖蛋白抑制剂衣霉素处理细胞,以期阐明细胞壁组分在RS1耐铝中的作用。
1 材料与方法
1.1 试验材料
采用红酵母Rhodotorula taiwanensis RS1 (RS1) (=China General Microbiological Culture Collection (CGMCC) 2.4753)为试验材料,其分离自江西酸性
红壤[15, 22]。
1.2 培养条件
试验采用低pH低磷低镁 (low pH, low Phosphate and low Magnesium, LPM) 培养基,具体组成参照文献[23],其中镁、磷含量都降低为0.1 mmol/L,pH 3.5,同时添加50 mmol/L琥珀酸作为pH缓冲液[24]。液体培养在30℃、200 r/min下进行。固体培养基在上述液体培养基基础上添加2% 琼脂糖,在30℃ 倒置静止培养。铝采用AlCl3,配备1 mol/L母液,抽滤灭菌后加入高温灭菌LPM培养基中,获得不同铝浓度的LPM培养基。
1.3 RS1对铝的耐性
混凝土的防护措施主要是对温度的控制,为了保证混凝土可以顺利的进行硬化,可以采用相关的防护措施对于混凝土浇筑过程中的温度进行合理的控制,控制在混凝土规定的标准范围之内,凝固过程中需要采取一定的手段控制好温度,防止温度发生急剧的变化。混凝土的养护是保障混凝土质量的有效措施,避免混凝土在阳光下暴晒,温差会影响混凝土的成型。混凝土养护主要针对温度、湿度的控制,高温时可以在混凝土的表面覆盖一层塑料布,避免了阳光直射造成水分的蒸发[4]。
RS1预培养至对数期,3 000 g离心5 min收集菌体,去离子水清洗两次,加入含不同铝浓度 LPM培养基,至初始OD600= 0.01,培养24 h后取样,测定OD600反应菌体生长状况。
1.4 细胞壁组分测定
按照1.3中方法,RS1预培养并接种至含不同浓度铝LPM培养基中,处理24 h后,离心收集菌体,加入玻璃珠(450 ~ 600 μm)置于冰上,FastPrep-24匀浆仪间隔破碎细胞1 min,间隔置于冰上冷却1 min,共计破碎4个循环后,2 000 g离心10 min,用预冷的去离子水清洗数次直至上清液澄清,离心管底部沉淀即为细胞壁[25]。Labconco-2.5L台式冻干机冷冻干燥,称取一定量细胞壁,用 2 mol/L硫酸水解将 β-葡聚糖完全转化为葡萄糖,甘露聚糖转化为甘露糖,然后参照文献中方法测葡萄糖和甘露糖含量[26]。
1.5 细胞壁磷含量
按照1.3中方法,不同浓度铝处理24 h后,离心收集菌体,按照1.4中方法破壁,清洗并冷冻干燥后,称取5 mg细胞壁,加入0.5 ml浓HNO3(优级纯)消煮,定容后用电感耦合等离子体光谱仪 PerkinElmer-Optima8000测定消煮液中磷含量。
1.6 细胞壁代谢抑制剂衣霉素对RS1耐铝性的影响
对数期RS1细胞在含不同浓度衣霉素(0、0.05、0.1 μg/ml)液体LPM培养基预培养4 h,3 000 g离心5 min收集菌体,按照1.3中方法,分别转接至对照和含50 mmol/L铝的LPM培养基中,培养24 h后测定OD600。
1.7 数据分析
数据采用Excel 2013和SPSS 18.0统计软件进行分析,差异水平通过 Duncan法进行检验(P<0.05)。作图采用SigmaPlot 12.5进行。
2 结果与分析
2.1 RS1对铝的耐性
相对我们前面试验中使用的半合成培养基GM[15],完全合成培养基 LPM 中磷、镁含量更低,都为0.1 mmol/L,这有助于降低外界因子磷和镁缓解铝毒的作用,从而更好地阐述红酵母本身的铝毒害或耐铝机制。在LPM培养基中,RS1仍具有很高的耐铝性,10 mmol/L时对 RS1生长有促进作用,铝浓度达到70 mmol/L时,才对RS1生长产生显著抑制作用,100 ~200 mmol/L铝对RS1生长抑制更为显著(图 1)。

图1 RS1在不同浓度铝下生长状况Fig. 1 Tolerances of RS1 to different concentrations of Al
2.2 铝对RS1细胞壁组分的影响
不同浓度铝处理24 h后,RS1细胞壁葡聚糖、甘露糖含量都没有显著变化(图 2)。细胞壁磷含量在0.1、10 mmol/L铝处理后较对照未有显著变化,70 mmol/L铝处理24 h后显著升高(图 3)。由此可见,RS1细胞壁多糖组分占细胞壁的比例不受铝处理的影响,而高浓度铝处理后细胞壁磷含量升高,暗示高浓度铝处理导致细胞壁吸附了更多的磷酸根或者细胞壁磷酸化修饰程度升高。
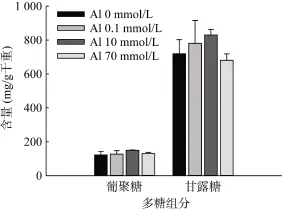
图2 铝处理24 h后RS1细胞壁葡聚糖和甘露糖含量Fig. 2 Glucan and mannan contents in cell walls of RS1 after treatment with Al for 24 hours
2.3 糖蛋白抑制剂衣霉素对RS1耐铝性的影响

图3 铝处理24 h后细胞壁磷含量Fig. 3 Phosphorus contents of cell walls of RS1 after treatment with Al for 24 hours
RS1在含不同浓度糖蛋白抑制剂衣霉素的LPM培养基中预培养4 h,再转入含50 mmol/L铝培养基中处理24 h,不含抑制剂预培养对照组细胞生长基本不受铝抑制,随抑制剂预培养浓度增加,细胞生长受铝抑制逐渐增强(图 4)。进一步计算了加铝相对于不加铝条件下细胞的相对生长率,0、0.05、0.10 μg/ml衣霉素预处理的相对生长率分别为 102%、58%、37%,可见糖蛋白抑制剂加重了RS1铝毒害,这说明N连接的甘露糖蛋白在RS1耐铝中起到作用。
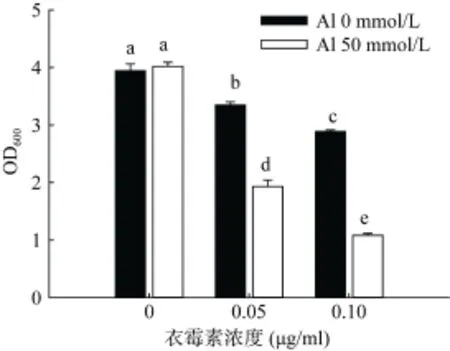
图4 衣霉素对RS1耐铝性的影响Fig. 4 Effects of tunicamycin on growths of RS1 under control and Al condition
3 讨论与结论
铝毒害受培养基中多种因素影响,其中磷和镁是培养基中影响铝毒害的重要因子,磷与铝螯合,会降低培养基中铝效应[27];细胞对镁的吸收受低浓度铝抑制,提高培养基中镁浓度或者过表达镁离子通道蛋白,都会提高酿酒酵母耐铝性[28–29]。这里采用的低磷低镁LPM培养基降低了外界因子磷和镁对RS1铝毒害的缓解作用,相对 GM 培养基[15],更适合研究RS1本身内在的耐铝机制。10 mmol/L铝能够促进RS1细胞生长,酿酒酵母中低浓度铝能够通过铝剂量和细胞密度依赖的方式促进细胞分裂,进而促进细胞生长[30]。70 mmol/L铝处理下RS1相对对照生长率为44.7%,对RS1生长起到中等抑制作用,所以后续试验最大铝处理浓度选为70 mmol/L;而100 ~ 200 mmol/L铝对 RS1生长抑制程度过大,所以未采用 100 ~200 mmol/L铝处理浓度。
本实验室前期结果表明,RS1的高耐铝性是本身遗传固有的,不被诱导产生[17],细胞壁增厚可能在RS1耐高浓度铝中起到重要作用[15]。GM培养基中高浓度铝处理后RS1细胞壁增厚,细胞壁占细胞比重升高,但各多糖组分占细胞壁的比例并没有显著变化[15]。本试验中铝处理后RS1各细胞壁多糖组分占细胞壁的比例同样没有显著变化,但不同细胞壁组分间交联程度或方式可能发生了改变,以适应高浓度铝胁迫。另外,虽然各多糖组分在细胞壁的比例没有变化,但是细胞壁在铝胁迫下厚度增加[15],这会导致多糖组分的总量增加。葡聚糖和甘露糖,作为细胞壁的主要组分交织在一起但并非均匀分布在细胞壁中,其中甘露糖蛋白主要位于细胞壁外侧,葡聚糖位于内侧;内侧葡聚糖赋予细胞壁刚度,外侧的甘露糖蛋白及其修饰则决定了细胞壁的孔隙度及所带电荷[31–32],细胞壁中位于外侧的甘露糖蛋白与铝毒害关系可能最为密切。
甘露糖蛋白的修饰,如磷酸化等,使得细胞壁带有负电荷。磷酸根在细胞壁中可能以吸附[33]或者甘露糖磷酸的形式存在,其赋予了细胞壁负电荷,决定了细胞壁与环境中阳离子电荷的吸附能力[34]。磷能缓解水稻的铝毒害,耐铝品种水稻根表及根自由空间中磷浓度高于敏感品种,表现出更强的质外体解铝毒能力,这可能与更强的磷吸收效率有关[35];同时磷能增强铝耐性胡枝子的耐铝性,施磷后更多的铝被从根尖排除[36]。可见,根质外体中较高的磷含量有助于缓解铝毒,红酵母 RS1细胞壁中的磷也可能会影响到RS1铝毒害。70 mmol/L铝处理后,RS1细胞壁磷含量显著增高,此时细胞壁铝含量也升高[15],细胞壁吸附更多的铝,导致细胞壁带有更多的正电荷,这可能会吸附更多带负电荷的磷酸根,从而导致细胞壁磷含量升高。细胞壁磷含量增高也可能是由于铝处理后细胞壁甘露糖磷酸化修饰增多造成的,对胁迫蛋白的甘露糖磷酸化修饰有助于胁迫条件下蛋白的稳定,也可能会导致细胞壁表面负电荷增加[34]。磷含量增高可能是 RS1适应高浓度铝胁迫的响应机制,也可能仅是高浓度铝对细胞的毒害作用。
糖蛋白抑制剂衣霉素作为一种抗生素,能抑制N-乙酰氨基葡糖胺-1-磷酸从 UDP-N-乙酰氨基葡糖胺转移至磷酸多萜醇,阻断N-糖基化中蛋白和糖链的交联,进而影响细胞壁甘露糖蛋白的糖基化修饰[37]。酿酒酵母用衣霉素处理后,甘露糖蛋白合成受抑制,细胞壁完整性受破坏,导致细胞壁具有更高的孔隙度[38],这会使得培养基中的物质更容易透过细胞壁与细胞膜接触。白念珠菌中,衣霉素能抑制细胞壁甘露糖蛋白形成,进而抑制生物膜的形成[39]。衣霉素处理细胞后,还会抑制胞外蛋白,如果糖苷酶的分泌[40]。本试验中细胞壁甘露糖蛋白合成受抑制后,同时加入50 mmol/L铝处理,极大加重了RS1铝毒害,可见N连接的甘露糖蛋白在RS1耐铝中起到重要作用。N连接的甘露糖蛋白受抑制后,可能导致了细胞壁结构改变,位于细胞壁最外层的甘露糖蛋白层失去对铝的有效屏蔽作用,从而 RS1耐铝性下降,其中涉及到的具体机制有待进一步试验验证。本文中采用的糖蛋白抑制剂衣霉素本身即为抗生素,高浓度时能够抑制细胞壁合成从而完全抑制细胞生长,考虑到抑制剂在较低浓度下并不能达到完全、即时抑制细胞壁糖蛋白合成的效果,这可能造成了本实验中糖蛋白合成受抑制,铝毒害只是加重,但并未达到50 mmol/L铝完全抑制细胞生长的效果。为阐述不同细胞壁组分在 RS1耐铝中的作用,后续试验需采用细胞壁相关组分突变体。
综上所述,RS1在LPM培养基中仍能够耐受高浓度铝,细胞壁多糖组分含量不受外部供铝的影响,细胞壁磷含量可能对 RS1耐铝性起作用,高浓度铝处理下 N-连接的甘露糖蛋白在 RS1耐铝中起到作用,其具体作用机制有待进一步研究。
[1] Kinraide T B. Identity of the rhizotoxic aluminium species[J]. Plant and Soil, 1991, 134: 717–728
[2] 沈仁芳. 铝在土壤–植物中的行为及植物的适应机制[M].北京: 科学出版社, 2008
[3] Zhao X Q, Chen R F, Shen R F. Co-adaptation of plants to multiple stresses in acidic soils[J]. Soil Science, 2014, 179: 503–513
[4] 陈荣府, 董晓英, 赵学强, 等. 木本植物适应酸性土壤机理的研究进展[J]. 土壤, 2015, 47(2): 252–258
[5] Ma J F, Chen Z C, Shen R F. Molecular mechanisms of Al tolerance in gramineous plants[J]. Plant and Soil, 2014, 381(1–2): 1–12
[6] 赵学强, 沈仁芳. 提高铝毒胁迫下植物氮磷利用的策略分析[J]. 植物生理学报, 2015, 10: 1583–1589
[7] Kawai F, Zhang D, Sugimoto M. Isolation and characterization of acid- and Al-tolerant microorganisms[J]. FEMS Microbiology Letters, 2000, 189(2): 143–147
[8] Kanazawa S, Chau N T T, Miyaki S. Identification and characterization of high acid tolerant and aluminum resistant yeasts isolated from tea soils[J]. Soil Science and Plant Nutrition, 2005, 51(5): 671–674
[9] 赵丽伟, 罗义勇, 谭浩, 等. 茶园土壤耐酸铝酵母菌的分离鉴定及其耐铝特性的初步研究[J]. 中国微生态学杂志, 2011, 23(9): 792–796
[10] Yoshimura E, Nagasaka S, Sato Y, et al. Extraordinary high aluminium tolerance of the acidophilic thermophilic alga, Cyanidium caldarium[J]. Soil Science and Plant Nutrition, 1999, 45(3): 721–724
[11] Zhang D M, Dunine J A, Kawai F. The extremely high Al resistance of Penicillium janthineleum F-13 is not caused by internal or external sequestration of Al[J]. Biometals, 2002, 15(2): 167–174
[12] Hamel R, Appanna V D, Viswanatha T, et al. Overexpression of isocitrate lyase is an important strategy in the survival of Pseudomonas fluorescens exposed to aluminum[J]. Biochemical and Biophysical Research Communications, 2004, 317(4): 1189–1194
[13] Mailloux R J, Lemire J, Kalyuzhnyi S, et al. A novel metabolic network leads to enhanced citrate biogenesis in Pseudomonas fluorescens exposed to aluminum toxicity[J]. Extremophiles, 2008, 12(3): 451–459
[14] 梁月荣, 陆建良, 周孟莲, 等. 茶园土壤耐酸铝微生物分离[J]. 茶叶科学, 1997(S1): 74–75
[15] Wang C, Zhao X Q, Aizawa T, et al. High aluminum tolerance of Rhodotorula sp. RS1 is associated with thickening of the cell wall rather than chelation of aluminum ions[J]. Pedosphere, 2013, 23(1): 29–38
[16] Wang C, Wang C Y, Zhao X Q, et al. Proteomic analysis of a high aluminum tolerant yeast Rhodotorula taiwanensis RS1 in response to aluminum stress[J]. Biochimica et Biophysica Acta, 2013, 1834(10): 1969–1975
[17] 王超, 赵学强, 沈仁芳. 高耐铝红酵母 RS1耐铝特性初步研究[J]. 土壤, 2013, 45(3): 501–505
[18] Kim K S, Yun H S. Production of soluble β-gluan from the cell wall of Saccharomyces cereviseae[J]. Enzyme and Microbial Technology, 2006, 39: 496–500
[19] Ibeas J I, Lee H, Damsz B, et al. Fungal cell wall phosphomannans facilitate the toxic activity of a plant PR-5 protein[J]. The Plant Journal, 2000, 23(3): 375–383
[20] Kakimoto M, Kobayashi A, Fukuda R, et al. Genome-wide screening of aluminum tolerance in Saccharomyces cerevisiae[J]. Biometals, 2005, 18(5): 467–474
[21] Koizumi N, Ujino T, Sano H, et al. Overexpression of a gene that encodes the first enzyme in the biosynthesis of asparagine-linked glycans makes plants resistant to tunicamycin and obviates the tunicamycin-induced unfolded protein response[J]. Plant Physiology, 1999, 121: 353–361
[22] Zhao X Q, Aizawa T, Schneider J, et al. Complete mitochondrial genome of the aluminum-tolerant fungus Rhodotorula taiwanensis RS1 and comparative analysis of Basidiomycota mitochondrial genomes[J]. Microbiologyopen, 2013, 2(2): 308–317
[23] Sherman F. Getting started with yeast[J]. Methods in Enzymology, 2002, 350: 3–41
[24] Tani A, Inoue C, Tanaka Y, et al. The crucial role of mitochondrial regulation in adaptive aluminum resistance in Rhodotorula glutinis[J]. Microbiology, 2008, 154: 3437–3446
[25] Liu H Z, Wang Q, Liu X Y, et al. Effects of spaceflight on polysaccharides of Saccharomyces cerevisiae cell wall[J]. Applied Microbiology and Biotechnology, 2008, 81(3): 543–550
[26] François J M. A simple method for quantitative determination of polysaccharides in fungal cell walls[J]. Nature Protocols, 2006, 1(6): 2995–3000
[27] Harris W R, Berthon G, Day J P, et al. Speciation of aluminum in biological systems[J]. Journal of Toxicology and Environmental Health, 1996, 48(6): 543–568
[28] MacDiarmid C W, Gardner R C. Al toxicity in yeast – A role for Mg?[J]. Plant Physiology, 1996, 112(3): 1101–1109 [29] MacDiarmid C W, Gardner R C. Overexpression of the Saccharomyces cerevisiae magnesium transport system confers resistance to aluminum ion[J]. Journal of Biological Chemistry, 1998, 273(3): 1727–1732
[30] Zheng K, Pan J W, Ye L, et al. Programmed cell death-involved aluminum toxicity in yeast alleviated by antiapoptotic members with decreased calcium signals[J]. Plant Physiology, 2007, 143(1): 38–49
[31] Bowman S M, Free S J. The structure and synthesis of the fungal cell wall[J]. Bioessays, 2006, 28(8): 799–808
[32] Lipke P N, Ovalle R. Cell wall architecture in yeast: New structure and new challenges[J]. Journal of Bacteriology, 1998, 180(15): 3735–3740
[33] Clarkson D T. Interaction between aluminum and phosphorus on root surfaces and cell wall material[J]. Plant and Soil, 1967, 27(3): 347–356
[34] Jigami Y, Odani T. Mannosylphosphate transfer to yeast mannan[J]. Biochimica et Biophysica Acta, 1999, 1426(2): 335–345
[35] 张启明, 陈荣府, 董晓英, 等. 铝胁迫下磷对水稻苗期生长的影响及水稻耐铝性与磷效率的关系[J]. 土壤学报, 2011, 48(1): 103–111
[36] Sun Q B, Shen R F, Zhao X Q, et al. Phosphorus enhances Al resistance in Al-resistant Lespedeza bicolor but not in Al-sensitive L. cuneata under relatively high Al stress[J]. Annals of Botany, 102(5): 795–804
[37] Mahoney W, Duksin D. Biological activities of the two major components of monensin[J]. Journal of Biological Chemistry, 1979, 254(14): 6572–6576
[38] De Nobel J G, Klis F M, Priem J, et al. The glucanasesoluble mannoproteins limit cell wall porosity in Saccharomyces cerevisiae[J]. Yeast, 1990, 6(6): 491–499
[39] Pierce C G, Thomas D P, Lopez-Ribot J L. Effect of tunicamycin on candida albicans biofilm formation and maintenance[J]. Journal of Antimicrobial Chemotherapy, 2009, 63: 473–479
[40] Faye L, Chrispeels M J. Apparent inhibition of βfructosidase secretion by tunicamycin may be explained by breakdown of the unglycosylated protein during secretion[J]. Plant Physiology, 1989, 89: 3845–3885
Role of Cell Wall Components in High Aluminum Tolerance of Rhodotorula taiwanensis RS1
HU Zhenmin1,2, ZHAO Xueqiang1, WANG Chao1, SHEN Renfang1*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China)
RS1 was a high Al tolerant Rhodotorula taiwanensis strain which was isolated from the acidic oil tea soil, and our previous studies showed that cell wall played an important role in the Al tolerance of RS1. However, the exact role of cell wall in the high Al tolerance of RS1 is still unclear. The role of cell wall components in the Al tolerance of RS1 was further investigated in this paper in order to clarify the mechanism underlying the high Al tolerance of RS1. The results showed that, the growth of RS1 was severely inhibited by Al higher than 70 mmol/L. The glucan and mannan contents of cell wall of RS1 did not change after Al treatment, whereas the content of phosphorus of cell wall was elevated under 70 mmol/L Al. The growth of RS1 was inhibited by Al much more after additions of cell wall metabolism inhibitor tunicamycin. In conclusion, phosphorus accumulation of cell wall and N-linked mannoproteins may play important roles in high Al tolerance of RS1.
Rhodotorula; Al toxicity; Cell wall; Mannoproteins
S154.3
A
10.13758/j.cnki.tr.2017.02.007
国家自然科学基金项目(41271257)、中国科学院“战略性先导科技专项重点研究计划”项目(XDB15030302)和国家重点基础研究发展计划项目(2014CB441000)资助。
* 通讯作者(rfshen@issas.ac.cn)
胡振民(1986—),男,山东临沂人,博士研究生,主要从事植物营养研究。E-mail: zmhu@issas.ac.cn

