三唑类抗真菌药物的药源性肝损伤主动监测研究
朱 曼,郭茂文,2,郭代红,吴 旭,3,马 亮,赵鹏芝,赵 靓(.解放军总医院药学部临床药学中心,北京 00853;
2.首都儿科研究所附属儿童医院,北京 100020;3.重庆医科大学药学院,重庆 401331)
三唑类抗真菌药物的药源性肝损伤主动监测研究
朱 曼1,郭茂文1,2,郭代红1,吴 旭1,3,马 亮1,赵鹏芝1,赵 靓1(1.解放军总医院药学部临床药学中心,北京 100853;
2.首都儿科研究所附属儿童医院,北京 100020;3.重庆医科大学药学院,重庆 401331)
目的:研究应用计算机辅助系统主动监测住院患者3种三唑类抗真菌药物致药源性肝损伤的可行性和关键要素。方法:利用住院患者药品不良事件主动监测与评估警示系统,通过团队论证的方式优化住院患者三唑类抗真菌药物致药源性肝损伤主动监测的事件配置器。回顾性调取2015年1月1日– 2015年11月30日我院经静脉途径应用氟康唑氯化钠注射液、注射用伏立康唑、伊曲康唑注射液的住院患者,对系统提示的阳性预警病例进行人工再评价。结果:计划3参数为最优的事件配置器参数,分别筛查氟康唑组、注射用伏立康唑组和伊曲康唑组病例840例、211例和81例。其中氟康唑组系统阳性预警病例377例,人工再评价实际阳性病例为42例,人工阳性预警率为5.00%;注射用伏立康唑组系统阳性预警病例94例,人工再评价实际阳性病例为15例,人工阳性预警率为7.11%;伊曲康唑注射液组系统阳性预警病例28例,人工再评价实际阳性病例为4例,人工阳性预警率为4.94%。结论:本研究中设置的肝损伤事件配置器结合了多种标准参数,可操作性好,弹性空间大,阳性病例丢失率低。采用该系统进行主动监测研究时,事件配置器的参数设置为关键要素,应基于不同目标药物和药品不良事件特点进行个体化设置。
三唑类抗真菌药物;药源性肝损伤;主动监测;氟康唑;伏立康唑;伊曲康唑
药源性肝损伤(drug-induced liver injury,DILI)是一类较为严重的药品不良反应(adverse drug reaction,ADR),发生率仅次于皮肤黏膜损害和药物热,约占ADR的10% ~ 15%[1],占急性肝损伤的50%以上[2],据世界卫生组织调查显示,以每年5%的速度上涨[3]。据报道,有1000种以上的药物可能引起肝损伤[4],其中抗感染药物为引起DILI的常见药物类别之一。三唑类抗真菌药物[5-6]是临床上应用广泛的抗真菌药物,因该类药物可与体内的P-450蛋白血红素辅基Fe原子配位结合,普遍具有一定的肝、肾毒性[7]。住院患者药品不良事件(ADE)主动监测与评估警示系统是我院依托军卫1号医院信息系统,采用触发器技术原理设计开发,对接军队ADR监测管理系统,完成了药物相关性血小板减少、贫血、肝损伤、肾损伤4个事件的自动识别规则设计,建立了集自动监测、用药审查、辅助评估、特征分析、风险警示、高危筛选为一体的监测构架[8]。本研究开展住院患者因三唑类抗真菌药物致药源性肝损伤的主动监测研究,旨为药品安全风险防范重点监测工作提供参考。
1 资料与方法
1.1 三唑类抗真菌药致药源性肝损伤的事件配置器参数
事件配置器设定包括4个模块:①病例排除模块,子条件包括排除病区、排除诊断、排除合并用药、排除基值异常、排除临时医嘱、排除指标缺失、检验指标取值时间范围等;②肝功能异常触发器模块,参列指标有:ALT、AST、TB、DB高于2倍正常值上限或连续2次高于正常值上限或较基值增幅等;ALP高于2倍正常值上限或连续2次高于正常值上限且ALT、AST、TB、DB一项高于正常值上限;③肝功能严重程度分级标准模块,含美国国立、中国抗癌协会、国家ADR中心、DELIN2012等官方标准及自定义严重程度标准可供研究者选择;④辅助提示模块,含其他怀疑药品、解救药品目录。研究者可根据不同的研究目的和需求,灵活组合设定主动监测事件配置器各项参数,详见图1。

图1 药源性肝损伤主动监测的事件配置器Fig 1 The event configurator of drug-induced liver injury
1.2 病例入选标准
回顾性调取解放军总医院2015年1月1日– 2015年11月30日期间经静脉途径应用氟康唑氯化钠注射液、注射用伏立康唑、伊曲康唑注射液的住院患者。年龄不限;临床资料及用药医嘱完整、准确、可靠。
1.3 病例排除及肝功能异常触发器参数
基于国内外文献对于药源性肝损伤的定义、临床特点、诊断标准、因果关系评价[9-14]、临床实践指南[15]、三唑类药物说明书等资料,由临床药师与药品不良反应监测专职人员共同设定本次研究的药源性肝损伤主动监测的事件配置器参数。研究中对事件配置器参数设置先后做了3次调整优化,分别命名为计划1、2、3,(○表示“无”;●表示“有”),详见表1。

表1 病例排除及肝功能异常触发器参数Tab 1 The exclusion criteria of cases and trigger parameters of liver dysfunction
2 结果
2.1 事件配置器参数的优化设置
对回顾性抽取的研究对象,依托住院患者药品不良事件主动监测与评估警示系统分别用事件配置器计划1、2、3进行主动监测,其中患者的年龄和性别分布详见表2。不同事件配置器主动监测的排除病例情况、实际筛查病例以及系统阳性预警结果详见表3。
2.2 人工再评价结果
临床药师和专职药品不良反应监测人员依托住院患者药品不良事件主动监测与评估警示系统自动提取的用药医嘱、合并用药、检验指标变化情况结合临床药学工作站综合评价患者的个体化情况,对事件配置器计划3的系统阳性预警涉及的可疑ADE进行人工关联性评价,结果详见表4,其中氟康唑、伏立康唑和伊曲康唑组的人工阳性预警率分别为5.00%、7.11%和4.94%。
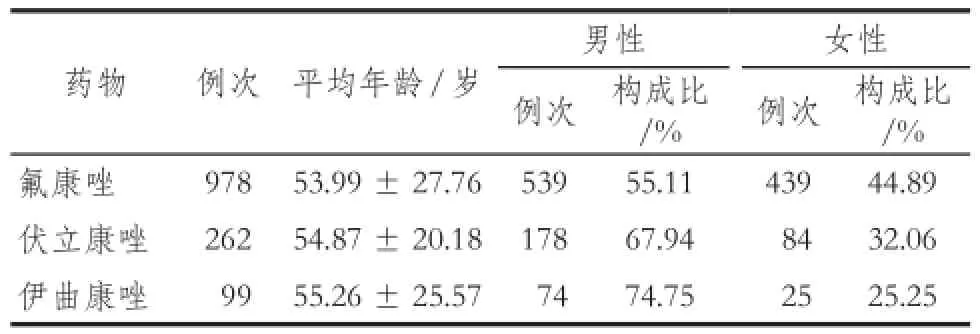
表2 患者年龄和性别分布Tab 2 The patients' age and gender distribution
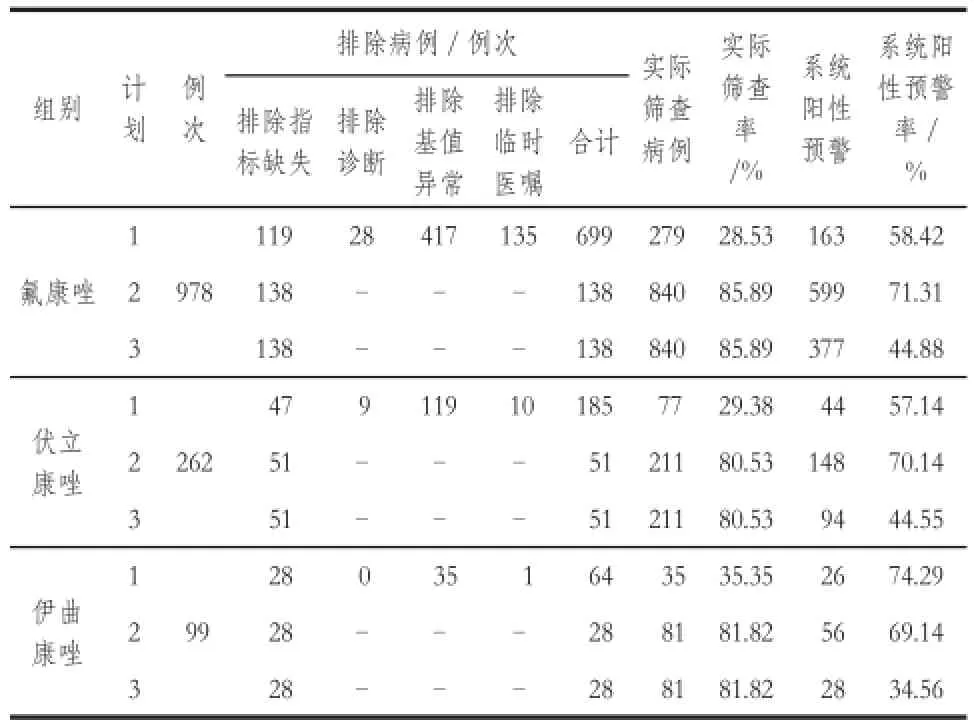
表3 住院患者三唑类抗真菌药物致肝损伤主动监测结果Tab 3 The active surveillance of inpatients' drug-induced liver injury of triazoles
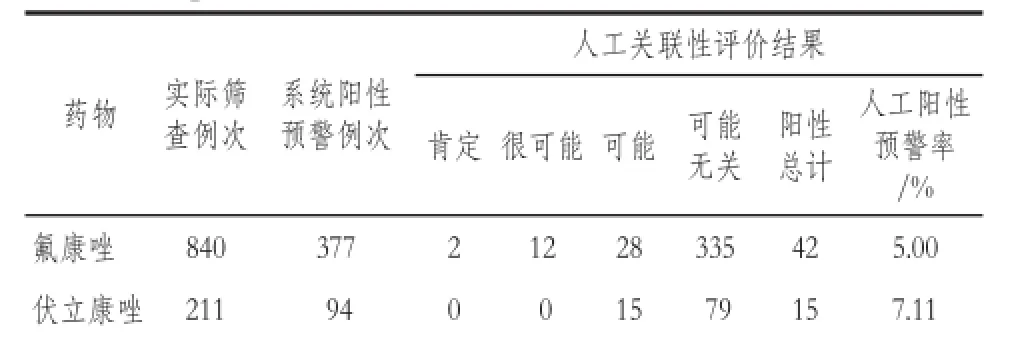
表4 计划3系统阳性预警病例的人工关联性评价结果Tab 4 The manual relevance re-evaluation of system warning cases of the third plan
3 讨论
3.1 事件配置器参数优化为主动监测研究的关键要素
从表3可见:计划1中氟康唑组、伏立康唑组和伊曲康唑组的实际筛查率仅为28.53%、29.38%和35.35%,提示排除病例过多,导致实际筛查病例过少。通过对计划1病例排除标准4个子条件的细化分析,考虑到“基础疾病、基值异常”等因素分析起来复杂多变,有的异常表现也是对个体化评价有参考意义的,需要依靠临床药师和ADR监测人员结合具体病例进行人工评价,并且在临床实际中,存在以“临时医嘱”的形式长期用药的情况,只有“指标缺失”会导致无法对照评价患者用药前后药源性肝损伤情况,最终计划2和计划3均调整为只保留排除指标缺失的子条件,以规避后续关联性评价中因患者指标不完全,而对ADE关联性判定结果的干扰,调整后计划2和3的实际筛查率在80%以上。
此外,计划2中三组药物的系统阳性预警率分别为71.31%、70.14%和69.14%,提示系统阳性预警比例偏高,可能造成需进行后续人工再评价的病例过多,预警特异性不足。经对计划2的事件配置器参数分析发现:“较基值增加≥0.5 ULN”和“较基值增幅≥50%”两个触发条件使预警特异性不足,以伊曲康唑组中人工评价结果为“可能无关”的原因为例,“较基值增加≥0.5 ULN”和“较基值增幅≥50%”两个条件触发报警器的病例数为19例,占“可能无关”病例数的37.25%,因此计划3的事件配置器参数在计划2的基础上,删除了“较基值增加≥0.5 ULN”和“较基值增幅≥50%”两个触发报警器的条件。最终计划3的氟康唑、伏立康唑和伊曲康唑组的系统阳性预警率分别为44.88%、44.55%和34.56%。
研究结果提示在肝损伤事件配置器参数的优化设置中,过于严苛的排除条件可能导致部分阳性预警病例漏报,但排除条件的放宽,又必然使阳性预警率降低,需要研究人员结合临床对肝功能相关指标的监测频率和数量不能完全达到评价标准理想需求的实际情况,在运用中针对不同目标药物和ADE,设置个体化的事件配置器参数。
3.2 系统阳性预警病例的人工再评价结果分析
本研究中三组药物的人工阳性预警率分别为5.00%、7.11%和4.94%,而氟康唑注射液、注射用伏立康唑和伊曲康唑注射液药品说明书中提及的肝损伤相关数据分别为常见(≥1/100 ~ <1/10)、2.7%和2% ~ 6%,两者差异的可能原因分析为药品说明书中ADR数据主要源于上市前Ⅰ~Ⅲ期药物临床试验,而上市前药物临床试验是对较小范围、特殊群体的病人进行药品评价,病人是经过严格筛选和控制的。而上市后临床试验需要达到上市前试验例数的5 – 8倍,通常在3000例以上,并且是用于更多不同类型的病人,包括儿童、老年及合并多系统疾病的人群。本研究中纳入的这些临床住院患者病情及实际联合用药情况极其复杂,分析为本研究人工阳性预警率高于药品说明书所给数据的可能原因。
此外,本研究中受临床药物实际使用情况、医院信息管理系统数据调取时限等条件限制,不同药物的入组例数差异较大,有的组别样本量不足,也给研究结果带来一定局限性,我们将在后期的工作中加以完善。
[1] Stickel F, Patsenker E, Schuppan D. Herbal Hepatotoxicity[J]. J Hepatol, 2005, 43(43): 901-910.
[2] Ostapowicz G, Fontana RJ, Schiødt FV,et al. Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States[J]. Ann Intern Med, 2002, 137(12): 947-954.
[3] Björnsson E, Olsson R. Suspected drug-induced liver fatalities reported to the WHO database[J]. Dig Liver Dis, 2006, 38(1): 33-38.
[4] Grant LM, Rockey DC. Drug-induced liver injury[J]. Curr Opin Gastroenterol, 2012, 28(3): 198-202.
[5] Pfaller MA,Diekema DJ,Messer SA,et al.In vitroactivities of voriconazole,posaconazole, and four licensed systemic antifungal agents against canadida species infrequently isolated from blood[J]. J Clin Microbiol, 2003, 41(1): 78-83.
[6] 曹江,白艳,王冬,等.抗真菌药物的TDM文献计量分析[J].中国药物应用与监测,2015,12(3):184-187.
[7] 谢海伟,杨贤松,吕超田,等.抗真菌药物及其作用机制研究[J].中国微生态学杂志,2015,27(12):1477-1479.
[8] 陈超,郭代红,薛万国,等.住院患者药品不良事件主动监测与评估警示系统的研发[J].中国药物警戒,2013,10(7):411-414.
[9] Danan G. Causality assessment of drug-induced liver injury. Hepatology Working Group[J]. J Hepatol, 1988, 7(1): 132-136.
[10] Danan G,Benichou C. Causality assessment of adverse reactions to drugs-I.A novel method based on the conclusions of international consensus meetings: application to drug-induced liver injuries[J]. J Clin Epidemiol, 1933, 46(11): 1323-1330.
[11] Maria VA, Victorino RM. Development and validation of a clinical scale for the diagnosis of drug-induced hepatitis[J]. Hepatology, 1997, 26(3): 664-669.
[12] 滝川一,朱丽影,谷仁烨.诊断标准的变迁经纬概要[J].日本医学介绍,2006,27(6):243.
[13] 熊木天児,朱丽影,谷仁烨.新版诊断标准的实用性及贻留问题[J].日本医学介绍,2006, 27(6): 244-247.
[14] 中华医学会消化病学分会肝胆疾病协作组.急性药物性肝损伤诊治建议(草案)[J].中华消化杂志,2007,27(11):765-767.
[15] Chalasani NP, Hayashi PH, Bonkovsky HL,et al. ACG clinical guideline: the diagnosis and management of idiosyncratic drug-induced liver injury[J]. Am J Gastroenterol, 2014, 109(7): 950-966.
The active surveillance of triazole antifungal agents-induced liver injury
ZHU Man1, GUO Mao-wen1,2, GUO Dai-hong1, WU Xu1,3, MA Liang1, ZHAO Peng-zhi1, ZHAO Liang1(1. Department of Clinical Pharmacy, PLA General Hospital, Beijing 100853, China; 2. Capital Institute of Pediatrics, Beijing 100020, China; 3. College of Pharmacy, Chongqing Medical University, Chongqing 401331, China)
Objective: To study the feasibility and key elements of active surveillance of inpatient's drug-induced liver injury on three kinds of triazole antifungal agents based on computer-aided system. Methods: Based on inpatient's active monitor and assessment system of adverse drug events and team work, the event configurator of drug-induced liver injury on triazole antifungal agents was optimized. Retrospective method was used for evaluating the inpatients in PLA general hospital from January 1, 2015 to November 30, 2015 who intravenously used the fl uconazole and sodium chloride injection, voriconazole for injection and itraconazole injection. The positive warning cases were re-evaluated manually. Results: The event monitor con fi gurator parameters of plan three were the most reasonable. The screening cases about fl uconazole, voriconazole and itraconazole were 840, 211 and 81 cases, respectively. A total of 377 warning cases of f l uconazole were screened by the system, and after the manual re-evaluation, the actual positive cases and warning rate were 42 cases and 5.00%. 94 warning cases about voriconazole were screened by the system, while the actual positive cases and warning rate were 15 cases and 7.11%. 28 warning cases about itraconazole were screened by the system, and the actual positive cases and warning rate were 4 cases and 4.94%. Conclusion: In this study, we considered diverse criteria to set the parameters of hypohepatia event configurator, which was proved excellent maneuverability and elasticity. The loss rate of positive cases was low. Setting parameters of adverse drug events configurator was the key point and should be based on different target drugs as well as the characteristics of different adverse drug events.
Triazole antifungal agents; Drug-induced liver injury; Active surveillance; Fluconazole; Voriconazole; Itraconazole
R969.3
A
1672 – 8157(2017)01 – 0045 – 04
2014全军后勤科研重点项目(BWS14R039)
郭代红,女,主任药师,硕士生导师,主要从事药事管理及临床药学工作。E-mail:guodh301@163.com
朱曼,女,副主任药师,主要从事临床药学工作。E-mail:zhucindy301@189.cn

