落叶松人工林林地土壤微生物边缘效应研究
徐辉,屈惠蕾,孟春
(东北林业大学 工程技术学院,哈尔滨 150040)
落叶松人工林林地土壤微生物边缘效应研究
徐辉,屈惠蕾,孟春*
(东北林业大学 工程技术学院,哈尔滨 150040)
采用稀释倒平板法和氯仿熏蒸法,以东北林业大学哈尔滨实验林场落叶松林人工地0~80 cm土层范围为研究对象,研究落叶松人工林土壤微生物边缘效应特征及边缘效应的主要影响因子,结果表明:①土壤微生物数量及生物量碳均随土壤深度加深呈指数减少,80%左右的微生物数量和生物量碳存在于地表至地表下40 cm的土层中。土壤微生物存在边缘效应。生态交错带下限可以采用积分的方式求得。②土壤微生物数量以及生物量碳的垂直分布与土壤全C、全N、孔隙度呈显著正相关。在全C、全N不成为限制因素时,土壤孔隙度是影响土壤微生物边缘效应的关键因素。
落叶松人工林;土壤微生物;边缘效应
0 引言
土壤微生物在土壤剖面上存在明显的垂直分异[1],通常土壤表层的微生物数量和生物量碳较多,且其随土层深度的增加而减少[2-3],至1 m深处减少约20倍。
土壤微生物在土壤垂直剖面上的这种分布特征可以从土壤的物理结构及其与大气相接处的界面来分析。
从物理结构上看,土壤由固、液和气三项物质组成,其存在的状态和容积比例,对土壤生态学过程起着重要的作用。尤其是土壤的孔隙体系,它不仅是土粒相互作用形成的支架产物、水分存在的空间、生物栖息之地,而且由于土壤孔隙在垂直空间的分异性造成了土壤与大气相接的界面实际上是土、气交错带,并由此导致土壤理化性质、土壤生物在表层土壤与底层土壤间存在很大的变异,或者说,影响了土壤微生物的结构和功能,因此,在土壤和大气间存在着生态交错地带,并由此产生交错带的特殊功能。由此,引入“边缘效应”一词来表征土壤微生物在土气交错地带的特殊功能,即在土气生态交错地带,土壤微生物存在“边缘效应”,边缘效应决定了土壤微生物的多样性和微生物量、土壤微生物活性,而边缘效应的产生决定于土壤因子和近地表气候因子(图1)。
落叶松是北方重要的速生树种,而近年来落叶松人工林地出现衰退现象比较严重,本实验以落叶松人工林为研究对象,主要的研究目的:①以落叶松人工林林地土壤微生物为特例,研究其边缘效应特征;②通过土壤微生物数量和生物量碳与土壤理化性质的相关性分析,探讨影响土壤微生物边缘效应的主要影响因子。从而为落叶松人工林地的生产经营和管理提供生物学上的依据。
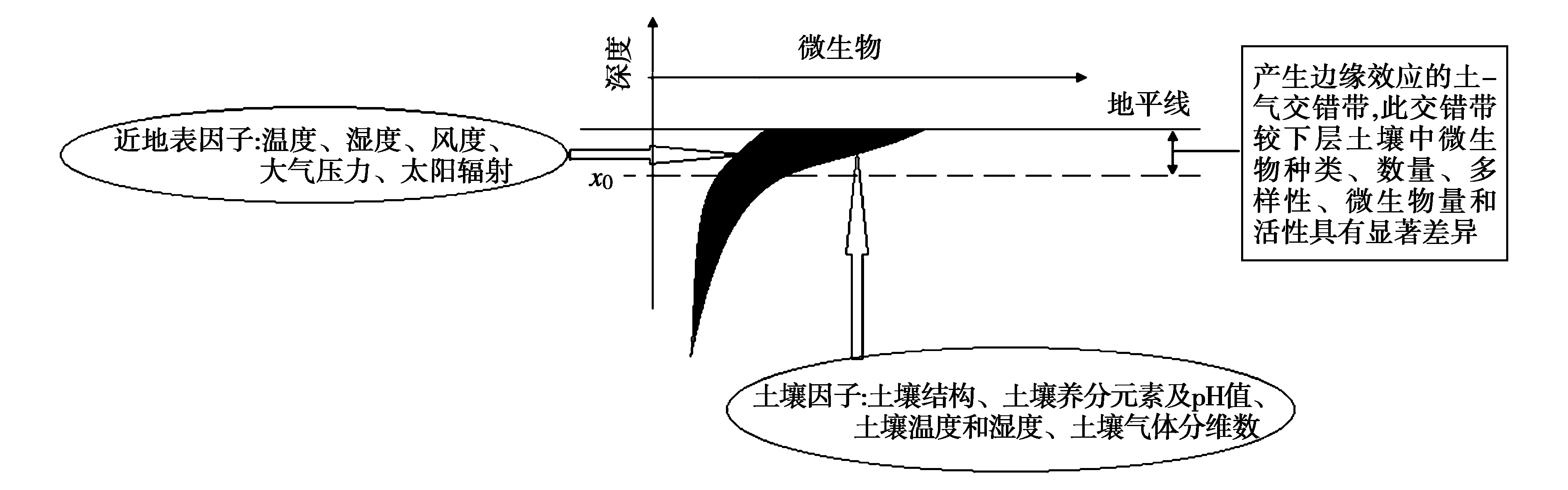
图1 土壤微生物边缘效应示意简图Fig.1 Schematic diagram of soil microbial edge effect
1 材料与方法
1.1 试验土样采集
土壤取自于东北林业大学哈尔滨试验林场落叶松人工林地。林分状况和土壤理化性质详见参考文献[4]和[5]。
采用Z型5点取样法,于林中选取3个样方(10 m×10 m)。2015年6月、8月和10月,分别在每个样方内挖掘1个土壤剖面,深至80 cm。在土壤剖面上每10 cm分一层取土。土样有2种取法:①取三个剖面相同土层内的土壤均匀的混合后分为三份,一份用来测微生物数量,一份用来测定微生物生物量碳,另一份供测定土壤营养元素。②用环刀(直径50.46 mm×高50 mm)在每个剖面各层取样1个,供测定孔隙度和容重使用。
1.2 分析方法
土壤细菌用牛肉膏蛋白胨培养基培养,土壤放线菌用高氏1号培养基培养,土壤真菌采用马丁(Martin)氏孟加拉红琼脂培养基培养[6]。采用稀释倒平板计数法测定和计算可培养微生物的数量[7]并且每个稀释度进行三次重复试验[8]
土壤微生物菌落数=平均每皿菌落数×稀释倍数/干土质量(cfu/g干土)。
土壤生物量碳采用氯仿(CHCl3)熏蒸浸提法[9]测定,每层土壤生物量碳测定进行三次重复试验。
土壤有机碳质量分数=(v0-v1)×c×3×ts×1 000/m
土壤生物量碳质量分数=2.64×Ec。
式中:v0为滴定空白所消耗的FeSO4溶液体积mL;v1为滴定土壤浸提液消耗的FeSO4溶液体积mL;c为FeSO4溶液的浓度mol/L;ts为稀释倍数;m为烘干土质量g;Ec为不熏蒸与熏蒸土壤有机碳的差值[10]。
土壤容重、孔隙度采用环刀法测定,采用半微量凯氏法测定土壤全N,采用火焰光度法测定土壤全K,采用氢氧化钠-钼锑抗比色法测定土壤全P,土壤pH值采用水浸电位法测定,全C采用水合热法测定[4-5]。
1.3 数据分析
实验测得数据利用Excel、SPSS19.0软件进行相关性分析,绘制微生物数量和生物量碳的误差条形图。
2 结果与分析
2.1 落叶松林地土壤微生物数量不同月份垂直分布
6月、8月和10月土壤微生物总数变化范围分别是0.70×106~15.46×106、1.55×106~39.09×106、0.55×106~10.59×106cfu/g干土,其中,6月、8月和10月细菌变化范围分别是0.68×106~15.29×106、1.53×106~38.89×106、0.53×106~10.42×106cfu/g干土,真菌变化范围分别是0.46×104~5.87×104、0.72×104~9.42×104、0.38×104~3.49×104cfu/g干土,放线菌变化范围分别是1.76×104~16.52×104、1.08×106~10.51×106、1.15×104~13.64×104cfu/g干土(如图2所示)。

注:细菌(×106);真菌(×104);放线菌(×104)。图2 土壤微生物数量垂直分布图Fig.2 Vertical distribution of soil microbial quantity
对不同地区、不同起源的落叶松林地土壤微生物数量的诸多研究表明,土壤微生物数量随土壤深度增加而减少[11],本研究也有相同的实验结果,即6月、8月和10月土壤微生物中,细菌、真菌、放线菌数量均呈现出随土壤深度增加而逐渐减少的趋势(图2),微生物总数量及3种微生物数量随土壤深度均呈指数变化,其相关系数(R2)分别达到0.895~0.988(表1)。

表1 落叶松土壤微生物数量、生物量碳(y)与土壤深度(x)相关模型
细菌、真菌和放线菌主要集中在0~30 cm范围的土层内。在0~30 cm的土层内,6月微生物总数量占整个剖面(0~80 cm)微生物总量的78.04%,在此范围内的细菌占细菌总数的80.36%,真菌占真菌总数的61.25%,放线菌占放线菌总数的64.43%;8月微生物总数量占整个剖面深度(0~80 cm)微生物总量的77.66%,这范围内的细菌占细菌总数的77.78%,真菌占真菌总数的63.24%,放线菌占放线菌总数的66.23%;10月3种微生物数量占微生物总量的72.33%,此范围内的细菌占细菌总数的72.51%,真菌占真菌总数的62.33%,放线菌占放线菌总数的64.09%。有学者讲土壤表层微生物含量高的原因归咎于地表水热、通气良好,积聚了大量的枯枝落叶,营养充分,为微生物提供良好的生长繁殖环境[12]
在同一的土层中,6月、8月和10月细菌占微生物总数量分别为96.55%~98.66%、98.32%~99.52%和96.36%~98.39%;真菌占微生物总数分别为0.34%~1.44%、0.24%~0.87%和0.31%~0.69%;放线菌占微生物总数分别为1.00%~2.48%、0.26%~0.84%和1.28%~2.95%。各月份各土层中,细菌数量占据绝对优势,真菌和放线菌的数量相对较少,总体表现为细菌>放线菌>真菌。这与于洋等人[13]河北省木兰围场华北落叶松人工林林缘样地的土壤微生物的研究结果相同。
2.2 落叶松林地土壤生物量碳不同月份垂直分布
6月、8月和10月土壤生物量碳变化范围分别是19.09~286.86、18.32~430.15 、15.14~317.03 mg/kg(如图3所示),其月际变化趋势类似于邸雪莹等人兴安落叶松林土壤生物量碳的月际变化[14]。土壤生物量碳随土壤深度增加呈指数变化,其相关系数(R2)分别达到0.988、0.980和0.983(表1)。土壤表层10 cm范围内土壤生物量碳含量最大,6月、8月和10月分别为286.86、430.15 、317.03 mg/kg,此组数值均低于杨凯等人[15]宁东部地区40年生落叶松人工林林地各季节土壤表层(0~5 cm)生物量碳的含量。70~80 cm处土壤生物量碳含量最小,6月、8月和10月分别为19.09、18.32 、15.14 mg/kg。土壤生物量碳主要集中在0~40 cm范围内,在此范围内,6月、8月和10月土壤生物量碳分别占总量的82.36%、88.29%和87.27%。
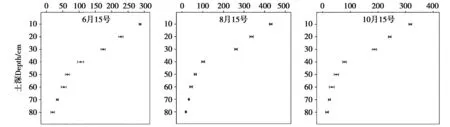
图3 土壤生物量碳垂直分布图Fig.3 Vertical distribution of soil biomass carbon
2.3 落叶松林地土壤微生物数量、微生物碳与土壤理化性质相关性分析
对土壤微生物数量和生物量碳与土壤理化性质之间进行偏相关分析。结果显示(表2),微生物总数量及3种微生物数量与全C、孔隙度呈现极显著正相关(P<0.01);与全N在8月和10月呈现极显著正相关(P<0.01),在6月表现显著正相关(P<0.05);与全P在8月和10月呈现显著正相关性(P<0.05),在6月呈现相关性略差(P<0.05);与全K在6月和8月两月份内呈现极显著正相关(P<0.01或P<0.05),在10月相关性略差(P<0.05);与容重呈现极显著负相关(P<0.01);微生物总数量和放线菌与土壤pH值仅在10月表现为显著相关(P<0.05),其他月份均不显著(P<0.05)。生物量碳与全C、全P、全N、全K、孔隙度呈现极显著正相关(P<0.01);与土壤pH值在6月和8月表现为负相关,在10月则表现为正相关,相关性均不显著(P<0.05)。这一结果与邸雪莹等人[14]研究结果有相同或相似之处。
由此可见,土壤微生物数量垂直分布受环境因子的影响,随深度的变化,全C、全N、全K、孔隙度和容重起到主要的影响作用,土壤生物量碳垂直分布同样受环境因子的影响,其中全C、全N、全K、孔隙度起主要影响作用。
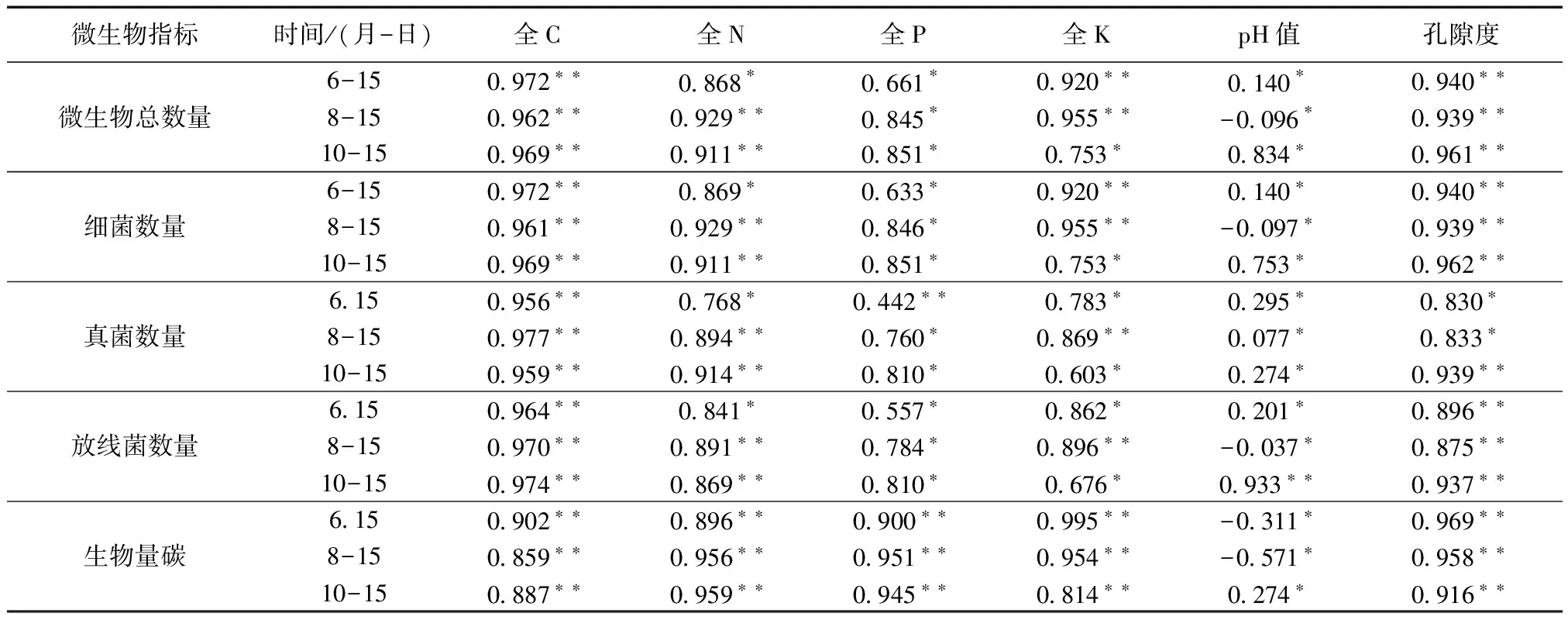
表2 土壤里化特性与微生物指标的偏相关性系数
注:**P<0.01,*P<0.05。
3 讨论
3.1 土壤微生物随深度变化趋势分析
Scheibe A认为[16],树种多样性不影响土壤微生物群落,拓展至不同植被覆盖情况,美国黑松林[17]微生物的研究均呈现出随土壤深度呈指数减少的现象。本文的研究也有相同的结论,不论微生物总数量还是3种微生物分类计,均出现随土壤深度增加指数减少的现象。在0~30 cm包含了微生物总量的72.33%~78.04%,在这个层次内,细菌、真菌和放线菌占各自总量的百分比介于61.25%~80.33%,其中,细菌所占比例最高,真菌所占比例最低。生物量碳也表现出了同样的变化趋势,在0~40 cm土层内,生物量碳占总量82.36%~88.29%。在这里,将土壤微生物沿垂直方向上的这种分布特点,称之为土壤微生物的边缘效应。
边缘效应产生于生态交错带内,生态交错带的大小可根据生态交错带内微生物占土壤微生物总数的百分比求得,即,构造一个指数函数来表示土壤微生物含量随土壤深度变化的情况。
y=aebx。
(1)
式中:y为微生物数量或生物量碳;x为土壤深度,x 对公式(1)积分,得 (2) 由于土壤微生物是在一定厚度单位土壤内存在,而在地表处不存在微生物数量或生物碳量的问题,所以,上限取值为x1,且x1<0。 (3) 在本文中,x1=-10 cm,λ=0.8,将表1中相关数据代入公式(3),得到土壤微生物生态交错带下限为地表下42.287~50.983 cm(表1)。此组数值略大于-40 cm深度。 3.2 土壤微生物随深度变化影响因素分析 土壤微生物随土壤深度不同的变化与土壤全碳和全氮表现出了极显著或显著相关性,而其他微量元素对土壤微生物变化的影响不如全碳和全氮的显著性高。但是,对该林地土壤全碳、全氮、全磷和全钾的研究表明,这4种土样元素随着深度的变化并没有一致的变化趋势,而且在不同深度方向上也未达到差异显著性[4-5]。因此,全碳和全氮对土壤微生物随土壤深度变化影响的极显著或显著相关性,只是表明在土壤中碳、氮含量未成为限制因素时,这两种元素含量对土壤微生物具有重要作用,是构成土壤微生物生命体的基本物质。 土壤pH值对于土壤中微生物群落结构的影响是相当复杂的[18],因此,pH值与土壤微生物在深度方向上变化的相关性表现出了不确定性。同样,磷、钾2种微量元素与土壤微生物在深度方向上变化的相关性也表现出了不确定性。 土壤孔隙度是反映土壤结构指标之一,孔隙度的大小不仅影响到微生物能否进入土体内及其数量的多少[19],还影响到土体中氧气分维数的高低。研究表明,土壤孔隙度虽然不存在深度上的差异显著性,但却有随土壤深度的增加而逐渐变小的变化趋势[4],这种变化趋势使得越接近地表的土壤里氧气分维数越高。微生物是多数为好氧型的,通气良好对于细菌的生活与繁殖也是极为有利的[20-22]。,因此,单因素及多因素分析结果均表现出土壤微生物随土壤深度的变化与土壤孔隙度呈显著正相关,土壤孔隙度对土壤微生物随土壤深度变化的具有决定性的作用。 落叶松林地土壤微生物随土壤深度呈指数减少,80%左右的微生物存在于地表至地表下40 cm的土层中,落叶松林地土壤微生物存在较强的边缘效应,其生态交错带下限可以采用积分的方式求得。 土壤全碳和全氮是构成微生物生命体的两种基本物质,在碳、氮不成为限制因素时,土壤孔隙度变化对土壤微生物随土壤深度的变化起着决定性作用。 [1]杨林章,徐棋.土壤生态系统[M].北京:科学出版社,2005. [2]范瑞英,杨小燕,王恩姮,等.未干扰黑土土壤微生物群落垂直分布特征[J].土壤通报,2014,45(2):389-393. [3]Stanislav M,Premysl F,Dusan R,et al.The relationships among microbial parameters and the rate of organicmatter mineralization in forest soils,as influenced by forest type[J].Pedobiologia,2014,57:235-244. [4]孟春,罗京,赵淑苹,等.两种人工林土壤物理性质时空变异性[J].东北林业大学学报,2012,40(11):102-106. [5]孟春,罗京,庞凤艳.落叶松人工林主要营养元素时空变异[J].森林工程,2013,29(3):33-38. [6]许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986. [7]林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010. [8]李阜棣,喻子牛,何绍江.农业微生物学实验技术[M].北京:中国农业出版社,1996. [9]Benizri E,Amiaud B.Relation between plants and soil microbial communities in fertilized grassland[J].Soil Biology & Biochemistry,2005,37(11):2055-2064. [10]姚槐应,黄昌勇.土壤微生物生态学及其实验技术[M].北京:科学出版社,2006. [11]姜海燕,闫伟.大兴安岭兴安落叶松林土壤微生物分布特征[J].浙江林学院学报,2010,27(2):228-232. [12]吴则焰,林文雄,陈志芳,等.武夷山国家自然保护区不同植被类型土壤生物群落特征[J].应用生态学报,2013,24(8):2301-2309. [13]于洋,王海燕,丁国栋,等.华北落叶松人工林土壤微生物数量特征及其与土壤性质的关系[J].东北林业大学学报2011,39(3):76-80. [14]邸雪颖,耿莹莹,孙龙.兴安落叶松林土壤微生物生物量季节动态及影响因素[J].东北林业大学学报,2012,40(5):1-4. [15]杨凯,朱教君,张金鑫,等.不同林龄落叶松人工林土壤微生物生物量碳氮的季节变化[J].生态学报,2009,29(10):5500-5507. [16]Seheibe A,Steffens C,Seven J,et al.Effects of tree identity dominate over tree diversity on the soil microbial community structure[J].Soil Biology & Biochemistry,2015,81:219-227. [17]Hartmann M,Lee S,Hallam S J,et al.Bacterial,archaeal and eukaryal community structures throughout soil horizons of harvested and naturally disturbed forest stands[J].Environmental Microbiology,2009,11(12):3045-3062. [18]Fierer N,Jackson R B.The diversity and biogeography of soil bacterial communities[J].Proc.Natl.Acad.Sci.U.S.A.,2006,103(3):626-631. [19]Hassink J,Bouwman L A,Zwart K B,et al.Relationship between habitable pore space soil biota and mineralization rates in grassland soil[J].Soil Biology & Biochemistry,1993,25(1):47-55. [20]郎惠卿,白艳,李波.小兴安岭落叶松苔草沼泽土壤微生物[J].东北师大学报自然科学版,1994(4):77-82. [21]高天雷,尹学明.人造林窗对粗枝云杉人工林土壤微生物量的影响[J].四川林业科技,2014,35(3):27-31. [22]毛波,董希斌,唐国华.诱导改造对大兴安岭低质山杨林土壤肥力的影响[J].东北林业大学学报,2015,43(8):50-54. Study on soil microbial edge effect inLarixgmelini Rupr plantation Xu Hui,Qu Huilei,Meng Chun* (College of engineering and technology,Northeast Forestry University,Harbin 150040) The 0~80 cm soil layer of Larix gmelini Rupr plantation in Harbin experimental forest stand of northeast forestry university was taken as research object,the main influence factors of microbial characteristics and edge effect of Larix gmelinii soil was studied by dilution plate and chloroform fumigation methods.The results showed that the microbial quantity of soil and microbial biomass carbon exponentially decreased with the increase of soil depth,and about 80% of them were in 40 cm-depth soil layer under the he earth's surface.Soil microbe had edge effect.The lower limit of ecological ecotone could be determined by the method of integral.Vertical distribution of soil microbial quantity and microbial biomass carbon positively related to soil total carbon,total nitrogen,and soil porosity.Soil porosity is the key factor that affects soil microbial edge effect when carbon and nitrogen don't become the limiting factors. Larixgmelini Rupr plantation;soil microbe;edge effect 2016-08-11 徐辉,研究生。研究方向:森林作业与环境。 *通信作者:孟春,副教授。研究方向:森林作业与环境。E-mail:504973901@qq.com 徐辉,屈惠蕾,孟春.落叶松人工林林地土壤微生物边缘效应研究[J].森林工程,2017,33(2):50-55. S 714 A 1001-005X(2017)02-0050-06

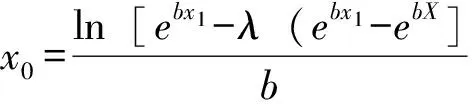
4 结论

